Вычислите значение ЭДС гальванического элемента
(-) Mg / MgSO4 // CuSO4 / Cu (+) Напишите процессы на аноде и катоде.
Решение.
Дана схема гальванического элемента, из которой видно, что анодом является магний, а катодом — медь
А (-) Mg / MgSO4 // CuSO4 / Cu (+) К
(–) А: Mg0 - 2e = Mg2+
(+) K: Cu2+ +2e = Cu0
ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА
E0Сu|Cu+ = + 0,337 В
E0Mg2+|Mg = –2,37 В
ЭДС = +0,337 – (–2,37 В) = 2,71 В
3. Рассчитайте ЭДС гальванического элемента, составленного из стандартного водородного электрода и свинцового электрода, погруженного в 0,01 М раствор PbCl2. На каком электроде идёт процесс окисления, а на каком — восстановление?
Решение.
E0Н+|Н2 = 0,00 В
E0Рb2+|Pb0 = –0.126 В
В данной паре потенциал свинца имеет более отрицательное значение, поэтому анодом является свинец:
(–) А: Pb0 - 2e = Pb2+
(+) K: 2H+ +2e = H20
Определим электродный потенциал свинца:
E = E° + (0,059/n)lg [Pb2+]
E = -0,126 + (0,059/2)∙lg0,01 = -0,185 В
ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА
ЭДС = 0 + 0,185 = 0,185 В
На основании стандартных электродных потенциалов определите, какую ЭДС имеет гальванический элемент
Zn|Zn2+ || Ni2+|Ni
Решение.
ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА
Е0 Ni|Ni2+ = - 0,250 В
Е0Zn|Zn2+ = - 0,763 В
Данные гальванические элементы составлены из стандартных электродов, поэтому:
ЭДС = Е0 Ni|Ni2+ – Е0Zn|Zn2+ = – 0,250 – (–0,763) = 0,513 В
|
|
|
5. Вычислите электродный потенциал магния погруженного в раствор MgSO4 с концентрацией ионов Mg2+, равной 0,01 моль/л.
Решение:
Вычисление электродного потенциала металла при любой концентрации его ионов (моль/л) в растворе производится по уравнению Нернста. Для магниевого электрода:
E = E0 + 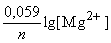 = –2,363 +
= –2,363 + 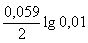 = –2,422 В.
= –2,422 В.
6. Вычислите ЭДС гальванического элемента, состоящего из двух электродов: Ti | Ti2+ (0,01 моль/л) || Ni2+ (1 моль/л) | Ni. Написать процессы на аноде и катоде. Вычислить константу равновесия гальванического элемента.
Решение:
ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА
В данном гальваническом элементе катод - Ni2+ |Ni , а анод - Ti|Ti2+
Схема гальванического элемента:
А (–) Ti | Ti2+ || Ni2+ | Ni (+) К
Процессы на электродах:
(–) А: Ti – 2e- = Ti2+
(+) K: Ni2+ + 2e- = Ni.
По уравнению Нернста рассчитываем значение электродного потенциала анода.
E Ti|Ti2+ = E0 Ti|Ti2+ + 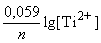 = –1,630 +
= –1,630 + 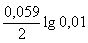 = –1,689 В
= –1,689 В
Значение электродного потенциала катода равно величине стандартного электродного потенциала никелевого электрода, так как концентрация ионов Ni2+ в растворе составляет 1 моль/л.
E Ni|Ni2+ = E0 Ni|Ni2+ = – 0,250 В;
ЭДС (E0) = –0,250 – ( –1,689) = 1,439 В.
|
|
|
 =
= 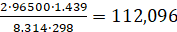

7. По уравнению токообразующей реакции составьте схему гальванического элемента: Ni + СuSO4 = NiSO4 + Cu. Напишите уравнения анодного и катодного процессов. Рассчитайте стандартную ЭДС.
Решение.
E0 Ni|Ni2+ = – 0,250 В;
E0Сu|Cu+ = + 0,337 В
В данной паре потенциал никеля имеет более отрицательное значение, поэтому анодом является никель:
Процессы на электродах:
(–)А: Ni0 - 2e- = Ni2+.
(+) К: Сu2++ 2e- = Cu0
Составим схему гальванического элемента:
(-) Ni0|NiSO4 || CuSO4| Cu0 (+)
ЭДС гальванического элемента можно рассчитать как разность потенциалов: ЭДС = EК – ЕА = +0,337 – (- 0,250) = 0,587 В
Дата добавления: 2021-12-10; просмотров: 127; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
