Реакции обмена в водных растворах электролитов
Лекция №13
Диссоциация воды.
Реакции обмена в водных растворах.
Водородный показатель. Среда водных растворов электролитов
Вода относится к слабым электролитам. Примерно 1 молекула из 555 миллионов при комнатной температуре распадается на катион водорода и гидроксид – анион:
H₂O ↔ H+ + OH-
Для данного обратимого процесса можно написать выражение константы диссоциации:
Кд = ⟮Н+⟯ · ⟮ОН-⟯/⟮Н₂О⟯
Поскольку на ионы диссоциируют лишь незначительная часть молекул воды, то ее концентрацию ⟮Н₂О⟯ можно считать постоянной. Если обе постоянные величины в выражении константы диссоциации перенести в левую часть равенства, мы получим новую константу, которую называют ионным произведением воды КН₂О:
КН₂О = Кд ·⟮Н₂О⟯= ⟮Н+⟯ · ⟮ОН-⟯
Получается, что равновесные концентрации катионов водорода и гидроксид – анионов в водном растворе взаимосвязаны. Если добавить в раствор кислоту и тем самым увеличить содержание ионов Н+, то концентрация анионов уменьшится, и произведение ⟮Н+⟯ · ⟮ОН-⟯ останется тем же самым. Установлено, что при 25⁰С ионное произведение воды равно 1,0 · 10-14.
В чистой воде концентрация ионов водорода гидроксид-анионов равны между собой и, следовательно, составляют по 1,0 · 10-7 моль/л. Такую среду называют нейтральной.
Кислую среду имеет раствор, в котором концентрация катионов водорода превышает 10-7, т. е. больше концентрации гидроксид-ионов:
|
|
|
⟮Н+⟯> ⟮ОН-⟯, ⟮Н+⟯> 1.0 · 10-7 моль/л
Щелочной называется среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
⟮Н+⟯ <⟮ОН-⟯, ⟮Н+⟯ <1.0 · 10-7 моль/л
Например, раствор с концентрацией ионов водорода 3,5 · 10-2 моль/л будет кислотным, а с концентрацией 8,7 · 10-11 моль/л – щелочным.
Использовать для количественной характеристики кислотности растворов подобные числа не очень удобно. Поэтому, в 1909 г. датский химик Сёрен Сёренсен предложил для этого более удобную величину – так называемый водородный показатель рН.
Водородным показателем рН называют отрицательный десятичный логарифм концентрации ионов водорода:
рН = - lg ⟮H+⟯
Например, если ⟮H+⟯ = 1,0 · 10-3 моль/л, то рН = 3, среда раствора кислотная; если ⟮H+⟯ = 1,0 · 10-13 моль/л, то рН =13, среда раствора щелочная; если ⟮H+⟯ = 1,0 · 10-7 моль/л, то рН =7, среда нейтральная.
Чем меньше значение рН, тем больше кислотность раствора, и, наоборот, с увеличением значения рН кислотность раствора уменьшается, щелочность увеличивается.
Зависимость между концентрацией ионов водорода, значением рН и реакцией среды раствора показана на схеме:
|
|
|
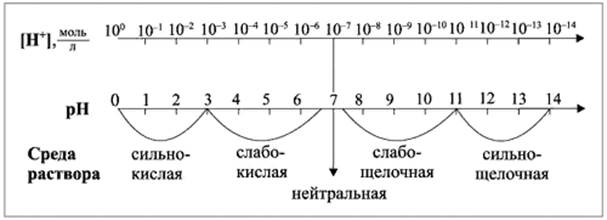
Существуют различные методы определения рН растворов. Примерную оценку кислотности водных растворов электролитов можно привести с помощью особых веществ, называемых индикаторами. Индикаторы обратимо изменяют свой цвет в зависимости от среды, т. е. рН растворов. Наиболее распространенными индикаторами являются лакмус, метиловый оранжевый, фенолфталеин:
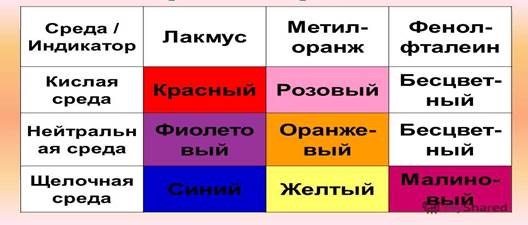
Велика роль водородного показателя в самых различных явлениях и процессах – и в природе, и в технике. Многие производственные процессы в пищевой, химической и других областях промышленности, а также биологические процессы протекают лишь при определенной реакции среды.
Во внутренней среде живых организмов рН постоянно. Так желудочный сок при нормальной кислотности имеет рН = 1,7 (сильно кислая среда), кровь - рН = 7,4 (слабощелочная), слезы – рН = 6,9 (слабокислая, близка к нейтральной).
Реакции обмена в водных растворах электролитов
Реакции, протекающие в растворах между электролитами, называются реакциями ионного обмена – это реакции между ионами, образовавшимися в результате диссоциации электролитов.
|
|
|
Реакции обмена в растворах электролитов протекают в направлении связывания ионов
Для того чтобы показать суть реакции ионного обмена, записывают три последовательных уравнения:
1. молекулярное уравнение – отражает молекулярный состав, вступивших в реакцию веществ;
2. полное ионное уравнение – отражает ионный состав, находящийся в растворе;
3. сокращенное ионное уравнение – показывает основную суть реакции ионного обмена, т. е. направление связывания ионов.
Так, например, при взаимодействии гидроксида натрия с соляной кислотой образуются хлорид натрия мало диссоциирующее вещество – вода, а следовательно связывание ионов произойдет в сторону образования воды:
NaOH + HCl ⟶ NaCl + H₂O – молекулярное уравнение
Na+ + OH- +H+ + Cl- ⟶ Na++ Cl- + H₂O – полное ионное уравнение
OH- + H+⟶ H₂O – сокращенное ионное уравнение
При взаимодействии гидроксида натрия с раствором сульфата меди (II) образуется сульфат натрия и нерастворимое основание – гидроксид меди (II):
2NaOH + CuSO4 ⟶ Na₂SO4 +Cu(OH)₂↓
2Na+ + 2OH- +Cu2+ + SO42- ⟶ 2Na+ + SO42- + Cu(OH)₂ ↓
2OH- +Cu2+⟶ Cu(OH)₂ ↓
Реакции ионного обмена протекают до конца, если:
1. Образуется осадок
2. Выделяется газ
3. Образуется малодиссоциирующее вещество, например вода.
|
|
|
Если в растворах нет таких ионов, которые могут связываться между собой с образованием осадка, газа или оксида (вода), то реакция является обратимой. Например, при взаимодействии растворов хлорида калия и нитрата натрия не происходит связывания ионов, т. к все вещества – и вступившие в реакцию, и образовавшиеся в ходе нее, являются растворимыми веществами:
KCl + NaNO3 ↔ KNO3 + NaCl
K+ + Cl- + Na+ + NO3- ↔ K+ + NO3- + Na+ + Cl-
Вопросы для самоконтроля
1. Что такое водородный показатель? По какой формуле рассчитывается?
2. Какие типы сред вы знаете водных растворов вы знаете?
3. Каковы концентрация ионов водорода и водородный показатель в кислотной среде?
4. Каковы концентрация ионов водорода и водородный показатель в щелочной среде?
5. Каковы концентрация ионов водорода и водородный показатель в нейтральной среде?
6. С помощью каких веществ можно определить характер среды раствора? Какие вы знаете?
7. Как называются реакции, протекающие между ионами в растворах электролитов?
8. В каком случае эти реакции протекают до конца?
Дата добавления: 2021-12-10; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
