Задачи для самостоятельной работы.
Задания для комбинированных занятий по физике
Выполнить в лекционных тетрадках конспект лекции № 8
Решить задачи по вариантам (варианты такие же, как сидите в кабинете №7) на дополнительную оценку
Фото конспекта и задач отправить в открытую группу в контакте «Физика и Астрономия»
https://vk.com/club196121729
Лекция № 8
Тема: Основы термодинамики. Первый закон.
Термодинамика изучает состояние вещества, не учитывая его внутреннее строение. Термодинамика дает макроскопическое описание системы. Изменение внутренней энергии тела происходит с изменением температуры тела.
Есть несколько способов изменить температуру тела. Например, температура тела меняется при нагревании в пламени, сгорающего топлива. При этом тепло, выделяющееся при сгорании топлива, уходит на нагревание тела.
Понять физическую природу теплоты в термодинамике невозможно без представлений об атомно-молекулярном строении вещества. С молекулярной точки зрения любое тело состоит из громаднейшего числа мельчайших частиц, называемых молекулами и атомами. Эти частицы находятся в беспрерывном тепловом движении.
Процесс нагревания тела в пламени сгорающего топлива выглядит следующим образом. Горение есть химическая реакция соединения двух веществ −− обычно кислорода и горючего −− и образования новых веществ. Кинетическая энергия молекул продуктов горения при этом во много раз превосходит первоначальную кинетическую энергию веществ. Образовавшиеся при горении молекулы бомбардируют молекулы вещества, помещенного в пламя горелки. Кинетическая энергия молекул вещества меньше кинетической энергии молекул пламени. При столкновении этих молекул часть энергии. Энергия, которую получает или теряет тело, или система тел в процессе теплообмена с окружающей средой называется количеством теплоты или просто теплотой. Обозначается Q. В международной системе (СИ) единицей количества теплоты, также как работы и энергии, является Джоуль: [Q]=Дж.
|
|
|
На практике еще иногда применяется внесистемная единица количества теплоты – калория: 1 кал=4,19 Дж1 кал=4,19 Дж.
Если Q>0, то теплота подводится к системе. Если Q<0, то теплота |Q| отводится от системы. Если Q=0, то теплота не подводится, не отводится, т. е. система является теплоизолированной.
Количество теплоты является функцией процесса, а не функцией состояния, то есть количество теплоты, полученное системой, зависит от способа, которым она была приведена в текущее состояние. Поэтому формула для количества теплоты Q зависит от протекающего процесса.
Удельная теплоемкость c вещества −− количество теплоты, которое надо к нему подвести, чтобы изменить температуру 1 кг вещества на 1 градус Цельсия:
|
|
|
c=Qm⋅ΔT,[c]=Джкг⋅0С.
Ее можно определить и другим способом. Удельная теплоемкость cc вещества −−теплоемкость 1 кг вещества:
c=Cm.
Удельная теплоемкость воды cв=4200Джкг Удельная теплоемкость льда cл=2100Джкг⋅
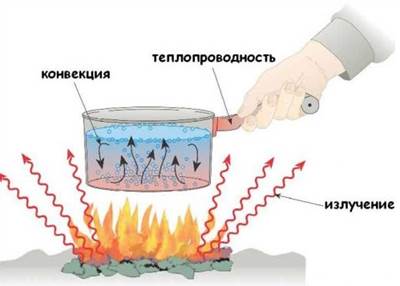
Теплопередача — процесс передачи теплоты (обмена энергией).
Существуют три вида теплопередачи:
· теплопроводность — теплопередача от более нагретых участков твердых тел к менее нагретым;
· конвекция — передача теплоты струями жидкостей или газов;
· излучение — передача теплоты посредством электромагнитных волн.
В термодинамике работа газа −− это результат взаимодействия системы с внешними объектами (например, поршнями), в результате чего изменяются параметры системы. При расширении работа силы давления газа на подвижный поршень равна A=FΔx. Со стороны газа на поршень действуют сила, равная произведению давления газа на площадь поршня F=pS. Подставив вторую формулу в первую, получим A=pSΔx=pΔV.
Пусть с газом проводят некоторый процесс. Работа газа A в этом процессе численно равна площади S под графиком этого процесса в координатах p и V (на pV−диаграмме), если газ расширяется (рис. 1), и она равна этой площади S, взятой со знаком минус, если газ сжимается (рис. 2). Если же в течение процесса объем газа остается постоянным (рис. 3), то работу газ не совершает, т. е. A=0.
|
|
|

Следует различать работу газа A и работу над газом A над (работа внешних сил над газом). Для одного и того же процесса эти две работы равны по модулю, но отличаются по знаку: A над = −A.
Также следует знать, что при расширении в вакуум работу газ не совершает.
Внутренняя энергия идеального газа −− это сумма кинетических энергий движения молекул.
Потенциальные энергии не учитываются, потому что газ является идеальным (не учитывается взаимодействие молекул).
В случае с идеальным газом его внутренняя энергия u зависит только от его температуры T (закон Джоуля) и определяется по формуле:
u=i2νRT,
где ν −− количество моль газа, R −− универсальная газовая постоянная, T −− температура газа, i −− количество степеней свободы молекулы газа. Значения ii для разных газов приведены в таблице.
| Тип газа | ii | Примеры газа |
| одноатомный | 3 | гелий HeHe, аргон ArAr |
| двухатомный | 5 | водород H2H2, кислород O2O2 |
| многоатомный (число атомов >2>2) | 6 | водяной пар H2OH2O, озон O3O3 |
|
|
|
Тогда изменение внутренней энергии Δu идеального газа в рассматриваемом процессе:
Δu=i2νRΔT,
где ΔT −− изменение температуры газа в этом процессе.
Для реального (неидеального) газа его внутренняя энергия u зависит не только от температуры T, но и от занимаемого им объема V.
Адиабатный (адиабатический) процесс −− медленный процесс без теплообмена с окружающей средой.
В этом процессе Q=0, поэтому A=−ΔU, то есть работа газа равна убыли внутренней энергии газа.
Для любого процесса с газом справедлив первый закон термодинамики (первое начало термодинамики):
Q=Δu+A,
где Q −− количество подведенной теплоты к газу, Δu −− изменение внутренней энергии газа, и A −− работа, которую совершает газ.
Первый закон термодинамики – по своей сути закон сохранения энергии с учетом изменения внутренней энергии и теплопередачи: при любых физических взаимодействиях энергия не возникает и не исчезает, а только передается от одних тел другим или превращается из одной формы в другую.
Тема: Основы термодинамики. Первый закон.
Алгоритмы решения задач
Задача №1
Давление идеального одноатомного газа изохорно увеличивают в 4 раза, затем объем газа увеличивают в 2,5 раза так, что давление линейно зависит от объема и возрастает в 2 раза, после чего газ возвращают в исходное состояние в процессе, в котором давление линейно зависит от объема. Найдите КПД (в процентах) такого цикла.
Решение:
Работа за цикл равна площади треугольника (рис.):
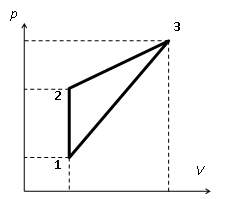
A = (1/2)(p2 − p1)(V3 − V2) = (1/2)(4p1 − p1)(2,5V1 − V1) = 2,25 ν RT1.
Газ получает тепло на участках 1 – 2 и 2 – 3. Полученное количество теплоты равно
Q = Q13 = (U3 − U1) + A31,
Q = (3/2)νR(T3 − T2) + (1/2)(p2 + p3)(V1 − V2),
Q = (3/2)νR(2 × 2,25 × 4T1 − T1) + (1/2) (4p1 + 4 × 2p1)(2,5V1 − V2) = 37,5νRT1.
Получаем, что КПД цикла равен η = A/Q = 0,06, т. е. 6 %.
Ответ: η = 6 %.
Задача №2
В вертикальном цилиндре под массивным поршнем находится одноатомный газ. Сколько теплоты необходимо сообщить газу, чтобы он при расширении совершил работуΔA? Теплообменом газа с окружающей средой пренебречь.
Решение:
Считая, что нагревание газа в цилиндре происходит достаточно медленно, можно утверждать, что давление p газа в цилиндре остается неизменным. Поэтому работу газа можно найти из соотношения: ΔA = pΔV, где ΔV − изменение объема газа. При изобарическом изменении объема ν молей газа согласно уравнению Менделеева – Клапейрона его температура должна измениться на величину
ΔT = pΔV/(νR),
где R – газовая постоянная. Учитывая, что при изобарическом процессе молярная теплоемкость идеального одноатомного газа равна 2,5R, получим, что искомое количество теплоты равно
ΔQ = (5/2)νRΔT = (5/2)ΔA.
Ответ: ΔQ = (5/2)ΔA.
Задача №3
Идеальный одноатомный газ, имевший температуру T1, изобарически переводят в состояние 2 с температурой T2 > T1, затем изохорически – в состояние 3 с температурой T3 < T2, а после изобарического сжатия – в такое состояние 4, из которого его переводят в исходное состояние изохорически. Найти КПД этого цикла.
Решение:
КПД тепловой машины по определению равен: η = A/Q1, где A – работа, совершенная за один цикл, а Q1 – количество теплоты, полученное при этом рабочим веществом от нагревателя.
С учетом обозначений на рисунке,
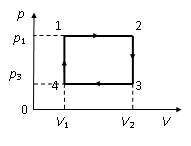
где приведена pV-диаграмма заданного цикла, работа газа за один цикл
A = (p1 − p3)(V2 − V1).
Учитывая, что согласно уравнению Клапейрона – Менделеева произведение давления pгаза на занимаемый им объем V равно газовой постоянной R умноженной на число молей ν и его абсолютную температуру T, искомая работа может быть найдена по формуле:
A = νR(T2 − T1 − T3 + T4).
При переходе из точки 1 в точку 2 газ совершает положительную работу. Одновременно с этим возрастает и внутренняя энергия газа, т. к. увеличивается его температура (T2 > T1). Следовательно, на участке 1 – 2 газ должен получать тепло от нагревателя. Учитывая, что молярная теплоемкость идеального одноатомного газа при изобарическом нагревании равна2,5R, полученное количество теплоты равно
Q12 = 2,5νR(T2 − T1).
На участке 2 – 3 температура газа по условию задачи уменьшается, а его объем остается постоянным. Поэтому на этом участке газ отдает тепло холодильнику. На следующем участке газ также должен отдавать тепло. Наконец на участке 4 – 1 при неизменном объеме давление газа увеличивается и, следовательно, увеличивается его температура. Поскольку молярная теплоемкость одноатомного газа при изохорическом процессе равна 1,5R, на этом участке газ получает от нагревателя количество теплоты
Q41 = 1,5νR(T1 − T4).
Таким образом, полученное газом за один цикл количество теплоты
Q1 = Q12 + Q41.
Объемы газа в точках 1 и 4 и, соответственно, 2 и 3 по условию задачи равны, а поэтому должны выполняться следующие соотношения:
p1/p3 = T1/T4 = T2/T3.
Из этих соотношений следует, что неизвестная температура газа
T4 = T1T3/T2.
Подставляя это в ранее полученные выражения, находим, что искомый КПД равен
η = [T2(T2 − T1 − T3) + T1T3]/[T2(2,5T2 − T1) − 1,5T1T3].
Ответ: η = [T2(T2 − T1 − T3) + T1T3]/[T2(2,5T2 − T1) − 1,5T1T3].
Задача №4
Холодильник работающий по циклу Карно, поддерживает в камере температуру Tк = 260 K, отводя из нее за цикл работы энергию Qк = 400 Дж. Температура радиатора холодильника равна Tр = 300 K. Какую среднюю мощность потребляет холодильник, если длительность его цикла равна τ = 1,5 с?
Решение:
Если работу, совершенную тепловой машиной за один цикл, обозначить A, Q1 – количество теплоты, полученное от нагревателя, и Q2 – переданное машиной холодильнику так же за цикл, то на основании закона сохранения энергии можно утверждать, что A = Q1 − Q2, а КПД машины можно определить из соотношения:
η = A/(A + Q2).
С другой стороны, согласно второму закону термодинамики (в формулировке Карно) КПД тепловой машины, работающей по циклу Карно, определяется только абсолютными температурами нагревателя T1 и холодильника T2 и равно
η = (T1 − T2)/T1.
Поскольку цикл Карно является обратимым, то те же соотношения должны быть справедливы и для холодильника, работающего по указанному циклу. Обозначив искомую мощность N и учитывая, что
A = Nτ, T1 = Tp, T2 = Tк и Q2 = Qк,
после алгебраических преобразований получим:
N = (Tр/Tк − 1)Qк/τ ≈ 41 Вт.
Ответ: N ≈ 41 Вт.
Тема: Основы термодинамики. Первый закон.
Задачи для самостоятельной работы.
Вариант 1: 5.1, 5.3, 5.5.
Вариант 2: 5.2, 5.4, 5.5.
5.1. Для погружения и всплытия подводной лодки в ней имеются два сообщающихся между собой резервуара. В погруженном состоянии один из резервуаров емкостью Vзаполнен водой, во втором емкостью V1 находится сжатый воздух. Каково должно быть минимальное давление сжатого воздуха, чтобы при всплытии лодки с глубины H сжатый воздух полностью вытеснил воду из балластной цистерны? Атмосферное давление нормальное, изменением температуры воздуха при расширении пренебречь.
5.2. Посредине откачанной и запаянной с обоих концов горизонтальной трубки находится столбик ртути длиной h = 19,6 мм. Если трубку поставить под углом α = 30° к горизонту, то столбик ртути переместится на Δl1 = 20 мм, если поставить вертикально − на Δl2 = 30 мм. До какого давления из трубки?
5.2. В стеклянную манометрическую трубку, запаянную с одного конца, налита ртуть. Высота столба воздуха в запаянном колене равна 2H, причем уровень ртути в открытом колене стоит на H выше, чем в закрытом. Манометр установлен в ракете, которая начинает подниматься вертикально вверх с ускорением а = g. Какова будет разность уровней ртути в коленах манометра при подъеме ракеты, если в кабине ракеты поддерживается нормальное атмосферное давление?
5.3. Компрессор захватывает при каждом качании воздух объемом v = 1 л при нормальном атмосферном давлении и температуре Т1 = 273 К и нагнетает его в автомобильный баллон, объем которого V = 0,5 м3, температура воздуха в баллоне T2 = 290 К. Сколько качаний должен сделать компрессор, чтобы площадь соприкосновения покрышки с полотном дороги уменьшилась на ΔS =100 см2, если до этого она равнялась S = 450 см2 и на колесо приходится нагрузка F = 4,9 кН?
5.4. Поршни двух одинаковых цилиндров связаны между собой жесткой тягой так, что объемы под поршнями равны. Под поршнями находится одинаковое количество газа при температуре То. Каково будет давление в цилиндрах, если один из них нагреть до температуры Т1, а второй охладить до температуры T2? Чему будет равно при этом относительное изменение объема газа в каждом цилиндре? Весом поршней и тяги пренебречь, трение не учитывать, атмосферное давление ра.
5.5. Сосуд емкостью 2V = 2 × 10−3 м3 разделен пополам полупроницаемой перегородкой. В одну половину сосуда введен водород массой mв = 2 г и азот массой mа = 28 г, в другой половине вакуум. Через перегородку может диффундировать только водород. Во время процесса поддерживается температура T = 373 К. Какие давления установятся в обеих частях сосуда?
Дата добавления: 2021-12-10; просмотров: 67; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
