Приготовление растворов из фиксаналов
Метод кислотно-основного титрования
Методы кислотно-основного титрования основаны на использовании реакции нейтрализации между кислотами и основаниями:
Н3О + + ОН- → 2Н2О,
или упрощено
Н+ + ОН- ↔ Н2О.
В зависимости от титранта (рабочего раствора) различают методы алкалиметрии и ацидиметрии
Алкалиметрия (от alcali – щелочь metreo – измеряют) – метод определения сильных и слабых кислот, кислых солей, солей слабых оснований путем титрования стандартным раствором сильного основания
В алкалиметрии в качестве титрантов используют растворы щелочей (NaOH, KOH, Ba(OH)2 ), в которых молярная концентрация эквивалента вещества колеблется в интервале от 0,01 моль/дм3до 0,2 моль/дм3 .
Алкалиметрию используют для количественного определения кислот и солей, гидролизующихся по катиону, т.е. имеющих кислую реакцию среды.
Ацидиметрия(acidus – кислота и metreo – измеряю) – метод определения сильных и слабых оснований, солей слабых кислот, основных солей и других соединений, обладающих основными свойствами, путем титрования стандартным раствором сильной кислоты (НСl, Н2SO4 ).
В ацидиметрии в качестве рабочего раствора (титранта) чаще всего используют соляную кислоту, реже - серную, т.к. она в ряде случаев может образовывать с исследуемым веществом осадки, которые будут влиять на точность результатов анализа. Азотная кислота, являясь сильным окислителем, может вступать в побочные реакции, не предусмотренные стехиометрией основного процесса, поэтому в ацидиметрии используется редко, кроме того, её растворы могут частично разлагаться при нагревании и на свету.
|
|
|
Приготовление рабочих растворов
Растворы щелочей (NaOH, KOH, Ba(OH)2) готовят по точной массе рассчитанной навески, поскольку щелочи являются гигроскопичными и даже при правильном хранении содержат в качестве примесей небольшое количество воды и карбонатов, их получают разбавлением концентрированных растворов с последующей стандартизацией другим раствором, титр которого известен. Для этих целей обычно используют стандартные растворы щавелевой Н2С2О4*2Н2О или янтарной Н2С4Н4О4 кислот:
Н2С2О4 + 2NaOH = Na2C2O4 + 2H2O
Н2С4Н4О4 + 2NaOH = Na2C4H4O4 + 2H2O
Рабочие растворы щелочей сохраняют свою устойчивость, если их хранить не в стеклянной, а в парафинированной либо фторопластовой посуде. Необходимо также учитывать, что растворы щелочей поглощают СО2 из воздуха с образованием карбонатов. Вследствие этого их титр желательно устанавливать непосредственно перед проведением анализа.
Растворы кислот (НСl и H2SO4 и др.) нельзя приготовить по точной навеске исходного вещества из-за летучести и гигроскопичности. Поэтому их готовят разбавлением концентрированных растворов
|
|
|
При необходимости концентрацию исходной кислоты определяют, предварительно измерив, плотность кислоты ареометром


Рисунок 1-опреление массовой концентрации кислоты по плотности
Точную концентрацию растворов кислот устанавливают титрованием стандартного раствора исходного вещества
В ацидиметрии для этих целей используют растворы карбоната натрия Na2CO3 (соды) или декагидрата тетрабората натрия Na2B4O7*10H2O (буры), полученные растворением в соответствующем объёме H2O рассчитанной навески.
Уравнения протекающих при этом реакций будут иметь вид:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
Na2B4O7 + 2HCl + 5H2O = 2NaCl + 4H3BO3
Таким образом, фактор эквивалентности соды и буры в этом случае равен 1/2.
Рабочие растворы кислот (HCl, H2SO4) являются устойчивыми и могут храниться без изменения своего количественного и качественного состава продолжительное время. Обычно в ацидиметрии используют растворы с молярной концентрацией химического эквивалента кислоты от 0,01 моль/дм3до 0,2 моль/дм3 .
Ацидиметрия используется для количественного определения оснований и солей, вступающих в необратимое взаимодействие с сильными кислотами.
|
|
|
Для стандартизации рабочих растворов в кислотно-основном титровании могут использоваться и те растворы НСl, H2SO4 либо NaOH, KOH, точный титр которых уже установлен с помощью первичных стандартов. Стандартные растворы кислот и щелочей можно получить также из фиксаналов, выпускаемых промышленностью. Это значительно сокращает затраты времени и средств на подготовительной стадии анализа.
Приготовление растворов из фиксаналов
Точные растворы можно быстро приготовить используя для этого фиксаналы.
Фиксанал представляет собой точно отвешенную массу вещества или его раствора, запаянного в стеклянную ампулу.
Фиксанал продается в коробках по 10 ампул. На каждой ампуле имеется штемпель или этикетка с обозначением формулы находящегося в ампуле вещества и его количества - 0,1 или 0,01 эквивалент
При количественном перенесении содержимого ампулы в мерную колбу и разбавлении его до 1 л получают точно 0,1 или 0,01 н. раствор.
Для приготовления раствора сначала удаляют теплой водой штемпель (или этикетку) с ампулы, затем ополаскивают ее дистиллированной водой. В обычную химическую воронку помещают коротким острым концом вверх боек с крестовидным утолщением, который обычно прилагается к каждой коробке фиксанала. Воронку с бойком вставляют в горло мерной колбы вместимостью 1 л. Затем дно ампулы разбивают осторожным ударом об острый конец бойка, после чего пробивают вторым бойком боковое или верхнее углубление ампулы.
|
|
|
Содержимое ампулы тщательно вымывают струей воды из промывалки в мерную колбу. Вещество в колбе растворяют в воде и доводят объем раствора до метки. Колбу закрывают пробкой и раствор хорошо перемешивают.


Рисунок 2- приготовление раствора из фиксанала
Кислотно-основное титрование
В процессе титрования изменяется концентрация ионов Н+ или ОН-, следовательно изменяется рН титруемого раствора (рН- водородный показатель)
При определенном значении рН достигается точка эквивалентности и титрование должно быть закончено.
Значение рН в точке эквивалентности зависит от природы реагирующих веществ и от их концентрации. Точка эквивалентности может быть достигнута в нейтральной, кислой или щелочной средах.
Чтобы понять, достигнута точки эквивалентности или еще нет, обычно используют различные кислотно-основные индикаторы. Для этого перед непосредственным титрованием в колбу с анализируемым раствором добавляют пару капель необходимого индикатора, и в момент достижения точки эквивалентности раствор начинает менять свой цвет.
Кислотно-основные индикаторы
Индикаторы кислотно-основного титрования представляют собой слабые органические кислоты и основания, у которых молекулярная и ионная формы отличаются окраской. В процессе диссоциации эти две формы находятся в равновесии.
Изменение рН в кислотно-основном титровании нарушает равновесие процесса диссоциации индикатора, что вызывает накопление в растворе одной из форм индикатора, окраску которой можно визуально наблюдать.
Условно индикатор кислоту обозначают HInd, а ее анион Ind-, индикатор гидроксид-IndОН, а его катион Ind+
Уравнения диссоциации индикаторов:
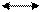 HInd Н+ + Ind-
HInd Н+ + Ind-
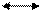 IndОН
IndОН 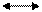 Ind+ + ОН-
Ind+ + ОН-
Недиссоциированные молекулы метилового оранжевого имеют красную окраску, а анионы желтую
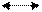 HInd
HInd  Н+ + Ind-
Н+ + Ind-
красная желтая
Недиссоциированные молекулы фенолфталеина бесцветны, а анионы красно-фиолетового цвета
 HInd Н+ + Ind-
HInd Н+ + Ind-
Бесцветная красно-фиолетовая
Для каждого индикатора есть свой интервал значений рН, в пределах которого индикатор изменяет свою окраску. Этот интервал называется интервал перехода окраски индикатора.
Окраске индикатора, при которой заканчивают титрование, отвечает определенное значение рН, лежащее внутри области перехода, которое называют показателем титрования (рТ)этого индикатора.
Дата добавления: 2021-12-10; просмотров: 71; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
