Гемоглобиновая буферная система
В организме человека буферные системы находятся в крови (плазме и эритроцитах), в клетках и межклеточных пространствах других тканей.
Буферные системы крови представлены буферными системами плазмы крови и эритроцитов.
Буферные системы плазмы — гидрокарбонатная, белковая и фосфатная, роль последней незначительна.
В эритроцитах функционируют гемоглобиновая, гидрокарбонатная буферные системы, а также небольшие количества органических фосфатов, также обладающих буферным действием в клетке. Буферная емкость буферных систем крови представлена в табл 1.
Таблица 1
Вклад буферных систем крови в поддержание протолитического гомеостаза
| Буферные системы | Относительная буферная емкость, % |
| Буферные системы плазмы крови: | 44 |
| гидрокарбонатная белковая неорганические фосфаты (фосфатная) | 35 7 2 |
| Буферные системы эритроцитов: | 56 |
| гемоглобиновая и оксигемоглобиновая гидрокарбонатная Органические фосфаты | 35 18 3 |
Гидрокарбонатная буферная система
Главное назначение гидрокарбонатной системы заключается в нейтрализации кислот. Гидрокарбонатный буферная система является системой быстрого реагирования, так как продукт ее взаимодействия с кислотами — углекислый газ быстро выводится через легкие. Помимо плазмы, гидрокарбонатная система содержится в эритроцитах, интерстициальной жидкости, почечной ткани.
Гидрокарбонатная буферная система составляет 53 % общей буферной емкости крови (35 % в плазме, 18 % в эритроцитах).
Значение рН гидрокарбонатной буферной системы определяется по уравнению Гендерсона-Гассельбаха:
рН = 6,11+ 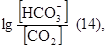
которое имеет свои особенности:
а) в стандартных условиях Kд(Н2СО3) имеет вид:
Kд(Н2СО3) = 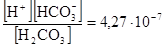 , а рKд(Н2СО3) = 6,37.
, а рKд(Н2СО3) = 6,37.
Непосредственно измерить концентрацию угольной кислоты в крови практически невозможно. В физиологических условиях угольную кислоту принято условно рассматривать как весь растворенный в организме СО2, так и СО2, гидратированный до угольной кислоты, поэтому константа диссоциации угольной кислоты принимает следующий вид:
K 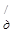 =
= 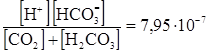 ,
,
Заметим, что K 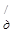 была определена экспериментально и затем ее показатель вошел в уравнение Гендерсона-Гассельбаха.
была определена экспериментально и затем ее показатель вошел в уравнение Гендерсона-Гассельбаха.
б) вследствие малой растворимости СО2 в плазме крови общую концентрацию угольной кислоты выражают через произведение парциального давления СО2 (в норме 40 мм рт.ст.) углекислого газа (рСО2) и коэффициента его растворимости в плазме крови, равном 0,033. При этих условиях уравнение Гендерсона-Гассельбаха записываем следующим образом:
рН = 6,11+ 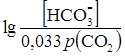
Если выразить рСО2 плазмы крови через кПа, то в норме оно равно 5,3 кПа, тогда коэффициент растворимости равен 0,23 а концентрация СО2 » 1,2 ммоль/л. При этом постоянная внеклеточная концентрация гидрокарбонат-ионов составляет 24 ммоль/л.
Подставив в это уравнение значение рН = 7,4 (норма), определим, что 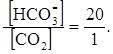
Это соотношение является важной биологической константой и позволяет сделать следующие выводы:
а) при физиологическом значении рН буферная емкость гидрокарбонатной системы значительно больше по кислоте, чем по основанию, что обусловлено особенностями метаболизма нашего организма;
б) при физиологическом значении рН плазмы крови и эритроцитов СО2 находится преимущественно в виде НСО 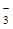 .
.
При попадании протонов в кровь равновесие реакций смещается в сторону повышения давления СО2 в газовой фазе легких, поэтому лишний газ выдыхается.
При попадании же в плазму крови анионов ОН– процессы происходят в обратной последовательности: увеличивается скорость диссоциации Н2СО3, что вызывает растворение в плазме крови некоторого дополнительного количества содержащегося в легких углекислого газа. Таким образом, высокая интенсивность процесса дыхания может обеспечить достаточно быстрые сдвиги этих равновесий и компенсационного нарушения кислотно-основного равновесия в организме за 10-15 мин. Изменяющееся при этом соотношение [НСО 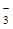 ]/CO2 восстанавливается до нормы в течение 10 – 18 часов за счет изменения объема легочной вентиляции.
]/CO2 восстанавливается до нормы в течение 10 – 18 часов за счет изменения объема легочной вентиляции.
Гидрофосфатная буферная система.
Гидрофосфатная (фосфатная) буферная система содержит дигидрофосфат-ион [Н2РО 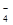 ] (кислота) и гидрофосфат-ион [НРО
] (кислота) и гидрофосфат-ион [НРО 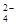 ] (основание) и функционирует в основном в плазме.
] (основание) и функционирует в основном в плазме.
В клетках она представлена КН2РО4 и К2НРО4, а в межклеточной жидкости NaH2PO4 и Na2НРО4.
Буферная ёмкость фосфатной буферной системы (аналогично карбонатной) больше по кислоте, чем по основанию.
Пользуясь уравнением Гендерсона-Гассельбаха, можно рассчитать соотношение
при рН = 7,4, учитывая, что в физиологических условиях рKa(Н2РО 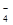 ) = 6,8:
) = 6,8:
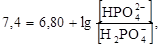 отсюда
отсюда 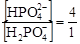 .
.
Действие фосфатной буферной системы сопряжено с физиологическим механизмом поддержания рН почками.
При поступлении в кровь какой-либо нелетучей кислоты протекает реакция:
Н+ + НРО 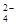 Н2РО
Н2РО 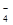 ,
,
при этом сильная кислота замещается эквивалентным количеством слабой кислоты Н2РО 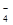 , которая концентрируется в почках и выделяется с мочой, значение рН которой понижается.
, которая концентрируется в почках и выделяется с мочой, значение рН которой понижается.
Однако в норме соотношение [НРО 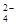 ]/[Н2РО
]/[Н2РО 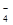 ] остается без особых изменений. Анионы сильных кислот выводятся в составе аммонийных солей вместе с катионами NH
] остается без особых изменений. Анионы сильных кислот выводятся в составе аммонийных солей вместе с катионами NH 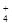 . Основным источником NH3 служит гидролитическое дезаминирование глутамина в присутствии очень активного в почках фермента глутаминазы. Этот процесс называется аммониогенезом и также направлен на удаление избытка Н+. Анионы гидрокарбоната НСО
. Основным источником NH3 служит гидролитическое дезаминирование глутамина в присутствии очень активного в почках фермента глутаминазы. Этот процесс называется аммониогенезом и также направлен на удаление избытка Н+. Анионы гидрокарбоната НСО 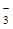 из первичной мочи (ультрафильтрат плазмы крови) почти полностью задерживаются почками и возвращаются обратно в кровь.
из первичной мочи (ультрафильтрат плазмы крови) почти полностью задерживаются почками и возвращаются обратно в кровь.
При попадании в кровь основания протекает реакция:
Н2РО 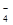 + ОН– + = Н2О+ НРО
+ ОН– + = Н2О+ НРО 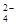 ,
,
при этом сильное основание ОН– замещается эквивалентным количеством воды. Образующийся избыточный гидрофосфат выводится почками с мочой, значение рН которой при этом повышается.
Во внутриклеточной жидкости при приеме мясной пищи повышается концентрация протонов, при приеме растительной пищи – анионов ОН–. Это приводит к расходованию НРО 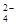 и Н2РО
и Н2РО 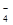 и, как следствие, повышению количества сопряженных кислот и оснований, избыток которых выводится с мочой, что и объясняет широкий интервал ее значений рН.
и, как следствие, повышению количества сопряженных кислот и оснований, избыток которых выводится с мочой, что и объясняет широкий интервал ее значений рН.
Полное восстановление соотношения концентраций компонентов фосфатной буферной системы [НРО 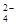 ]/[Н2РО
]/[Н2РО 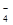 ] происходит только через 2-3 суток, что необходимо учитывать при терапевтической коррекции нарушения кислотно-основного равновесия организма.
] происходит только через 2-3 суток, что необходимо учитывать при терапевтической коррекции нарушения кислотно-основного равновесия организма.
Белковая буферная система
Белки – это полиамфолиты, которые способны отщеплять протоны за счет кислотных групп –СООН и - 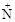 Н3, а также присоединять протоны за счет основных групп: карбоксильной –СОО– и амино –NН2.
Н3, а также присоединять протоны за счет основных групп: карбоксильной –СОО– и амино –NН2.
Изоэлектрическая точка (рI) – это значение рН, при котором макромолекула белка электронейтральна. Для каждого белка рI имеет индивидуальное значение.
При рН >pIбелка сопряженная кислотно-основная пара представлена молекулой белка, имеющей биполярно-ионное строение, и акцептором протонов – анионом белка, а при рН < pIбелка – молекулой белка и донором протонов – катионом белка.
Н3 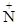 –Prot–COOН Н3
–Prot–COOН Н3 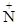 –Prot–COO– Н2N–Prot–COO– +Н2О.
–Prot–COO– Н2N–Prot–COO– +Н2О.
катион анион
Механизм действия кислотной белковой буферной системы:
Н3 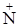 –Prot–COOН + ОН–Н3
–Prot–COOН + ОН–Н3 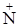 –Prot–COO– + Н2О;
–Prot–COO– + Н2О;
белок-кислота
Н3 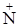 –Prot–COO– + Н+Н3
–Prot–COO– + Н+Н3 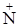 –Prot–COOН.
–Prot–COOН.
сопряжен. основание
Механизм действия основной белковой буферной системы:
Н2N–Prot–COO– + Н+Н3 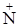 –Prot–COO–;
–Prot–COO–;
белок-основание
Н3 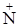 –Prot–COO– + ОН– Н2N–Prot–COO–+ Н2О.
–Prot–COO– + ОН– Н2N–Prot–COO–+ Н2О.
сопряж. кислота
В связи с этим буферная емкость по кислоте анионного буферной системы больше, чем по основанию. Так, например, для альбуминов буферная емкость по кислоте
10 ммоль/л, а для глобулинов – 3 ммоль/л.
Из всех свободных аминокислот плазмы крови только гистидин имеет значение
рKa = 6, близкое к значению рН (плазмы) = 7,4, поэтому он обладает значительным буферным действием. Вклад остальных аминокислот очень мал.
Основную часть белков плазмы составляют альбумины и глобулины, изоэлектрические точки которых лежат в слабокислой среде при значениях рН 4,9–6,3, поэтому в физиологических условиях при рН = 7,4 белки находятся преимущественно в виде аниона – акцептора протонов.
Гемоглобиновая буферная система
Гемоглобиновая буферная система работает внутри эритроцитов и состоит из сопряженных кислотно-основных пар: HHb/Hb– и HHbO2/HbO 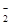 .
.
Гемоглобиновая буферная система — главная буферная система эритроцитов, на долю которой приходится около 35% всей буферной емкости крови.
Оксигемоглобин является более сильной кислотой, чем гемоглобин (рKa(HHb) = 8,2); pKa(HHbO2) = 6,95), поэтому избыток протонов будет в первую очередь связываться анионами гемоглобина:
Н+ + Нb-– НHb ;
Напротив, анионы гидроксила будут в первую очередь нейтрализоваться оксигемоглобином:
ОН– + HHbO2 HbO 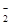 + Н2О;
+ Н2О;
При рН 7,25 (внутри эритроцитов) оксигемоглобин ионизирован на 65%, а гемоглобин — на 10%. Присоединение кислорода к гемоглобину уменьшает значение рН крови, так как при этом образуется более сильная кислота. С другой стороны, по мере отдачи кислорода оксигемоглобином в тканях значение рН крови вновь увеличивается. Процессы переноса кислорода гемоглобином и буферирования тесно связаны между собой.
Действие гемоглобиновой буферной системы сопряжено с процессами газообмена в капиллярах легких и тканей.
Гемоглобиновая буферная система эффективно функционирует с бикарбонатной буферной системой.
Гемоглобиновая система участвует в следующих процессах: связывании протонов, накапливающихся в результате метаболических процессов (кислотная функция), и протонировании гидрокарбонат-иона с последующим выделением углекислого газа (основная функция
Гемоглобиновую буферную систему можно рассматривать как одно из важнейших звеньев в транспорте углекислого газа из тканей в легкие в форме гидрокарбонат-иона.
Анионы всех буферных систем, кроме гидрокарбонатной, называются буферными основаниями. Их роль в связывании метаболического СО2 можно выразить суммарным уравнением:
СО2 + Н2О + Вuf - ↔ HBuf + HCO3-
Количество протонов, которое может быть связано, зависит от концентрации буферных оснований. Поскольку постоянство рН обеспечивается изменением концентраций компонентов буферной системы, поддержание кислотно-основного состояния организма зависит от его способности восстанавливать предел сопротивляемости (буферной емкости).
Все механизмы, поддерживающие протолитический гомеостаз, тесно связаны. Изменение концентрации одного из видов ионов, происходящее при включении буферной системы, влечет за собой изменение концентраций ионов, не участвующих в протолитических реакциях, для сохранения электронейтральности плазмы крови. Изменение концентрации ионов вызывает изменение осмотического давления, которое также поддерживается в организме на постоянном уровне.
Ацидоз. Алкалоз.
Все буферные системы организма обладают большей буферной емкостью по кислоте, чем по основанию,
Это соотношение находится в соответствии с особенностями метаболизма человеческого организма, образующего больше кислотных продуктов, чем основных.
Именно поэтому очень важным показателем для физиологических сред является буферная емкость Вк по кислоте.
При заболеваниях органов дыхания, кровообращения, печени, желудка, почек, при отравлениях, голодании, диабете, ожоговой болезни может наблюдаться уменьшение или увеличение Вк по сравнению с нормой. Возникают патологические явления: ацидоз и алкалоз.
Ацидоз
– смещение рН крови в кислую область. Сопровождается уменьшением кислотной буферной емкости физиологической системы по сравнению с нормой.
Алкалоз
– смещение рН крови в щелочную область. Сопровождается увеличением кислотной буферной емкости физиологической системы по сравнению с нормой.
Диапазон изменения значений рН при различных типах нарушения кислотно-основного баланса в организме представлен в табл. 2, а причины и классификация ацидоза и алкалоза – в табл. 3.
Таблица 2
Диапазон изменения значений рН при различных типах нарушения
кислотно-основного баланса в организме
| Типы нарушений | Ацидоз | Алкалоз |
| Компенсированный | 7,35 < pH < 7,45 щелочной резерв уменьшается | 7,35 < pH < 7,45 щелочной резерв увеличивается |
| Некомпенсированный | 6,8 < pH < 7,45 | 7,45 < pH < 7,9 |
Таблица 3
Основные причины и классификация ацидоза и алкалоза
| Типы ацидоза, алкалоза | Основные причины |
| Респираторный (газовый) ацидоз | Гиповентиляция легких при: – нарушении регуляции дыхания при травмах и опухолях мозга, кровоизлияниях в мозг; – введении транквилизаторов,барбитуратов; – отравлении алкоголем, опиатами; – пневмонии, отеке легких, попадании инородных предметов в дыхательный тракт. |
| Респираторный (газовый) алкалоз | Гипервентиляция легких при: – вдыхании разреженного воздуха; – тепловой отдышке; – лихорадочном состоянии, истерии. |
| Метаболический ацидоз и алкалоз | Нарушение протолитического баланса in vivo вследствие изменения соотношения скоростей поступления и образования, а также выведения кислот и оснований (диабет, инсульт) |
| Выделительный ацидоз | Заболевания почек, потеря кишечного сока (диарея) |
| Выделительный алкалоз | Потеря желудочного сока (при неукротимой рвоте), заболевания почек |
| Экзогенный ацидоз | Введение в организм большого количества кислот, отравление метанолом |
| Экзогенный алкалоз | Введение в организм большого количества щелочных продуктов |
Дата добавления: 2021-12-10; просмотров: 34; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
