КОЛЛОИДНЫЕ СИСТЕМЫ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
ДИСПЕРСНЫЕ И КОЛЛОИДНЫЕ СИСТЕМЫ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
Важная роль в пищевой технологии принадлежит дисперсным и коллоидным системам и их свойствам.
Дисперсные системы гетерогенны и состоят из двух фаз. Одна из них — сплошная, называется дисперсионной средой. Другая — раздробленная и распределенная в первой, называется дисперсной фазой.
Дисперсными системами являются большинство продуктов питания, сырье и полуфабрикаты: хлеб, мука, шоколад, сыры, творог, сухое молоко, соки, шампанское, пиво, конфеты и т. п.
Частицы веществ дисперсной фазы могут иметь различные размеры и форму: сферическую, цилиндрическую, прямоугольную, а чаще — неправильную. Образование различных дисперсий можно проиллюстрировать на примере уменьшения размеров куба по трем его осям. При значительном уменьшении размера в одном его измерении образуется пленка или поверхностный слой, при уменьшении размеров куба одновременно в двух измерениях образуются нити или капилляры, а уменьшение его размеров по всем трем измерениям приводит к образованию мелких частиц. Раздробленность определяется размером тела по той оси, уменьшением которой она достигнута, т. е. наименьшим размером а. Раздробленность характеризуется также величиной, обратной размеру о, т. е. l/а. Эта величина называется дисперсностью D. Кроме этого раздробленность характеризуется величиной удельной поверхности Syд, определяемой отношением площади межфазной поверхности к объему тела S/V. Все три характеристики раздробленности связаны между собой: с уменьшением размера а увеличиваются дисперсность D и удельная поверхность Sа
|
|
|
Изменение удельной поверхности Syд при дроблении 1 см вещества на частицы (кубики) меньшего размера показано в табл. 9.1.
Таблица 9.1

Увеличение размеров частиц и связанное с этим увеличение размеров удельной поверхности влекут за собой некоторое изменение свойств дисперсных систем.
КЛАССИФИКАЦИЯ ДИСПЕРСНЫХ СИСТЕМ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
Все дисперсные системы классифицируют по степени дисперсности. Дисперсные системы с частицами, размер которых превышает 10-3 см, относятся к грубодисперсным системам (рис. 35). Эти частицы при распределении в жидкости или газе, где они постепенно оседают или всплывают, наблюдаются визуально. Системы с частицами, размер которых лежит в пределах от 10-5 до 10-3 см (от 0,1 до 10 мкм), называются микрогетеро-генными. Частицы таких систем видны только в микроскоп, в газовой или жидкой среде они также оседают или всплывают.
Гетерогенные системы с частицами размером от 10-7 до 10-5 см (от 1 до 100 нм) относят к ультрамикрогетерогенным. Такие системы называют коллоидными. Частицы в них настолько малы, что вещество, из которого они состоят, почти целиком находится в коллоидном состоянии, т. е. практически содержит только поверхностные атомы и молекулы. Такие частицы по сравнению с отдельной молекулой обладают определенным агрегатным состоянием, которого не имеет молекула. При увеличении числа молекул в частице она постепенно приобретает все свойства фазы. Коллоидные системы вследствие большой удельной поверхности обладают значительной поверхностной энергией, что обусловливает неустойчивость системы, — она всегда стремится к самопроизвольному уменьшению межфазной поверхности, т. е. к снижению дисперсности. Способность коллоидных систем увеличивать размеры частиц путем их агрегации называется агрегативной неустойчивостью.
Дисперсные системы классифицируются не только по размерам частиц, но и по агрегатному состоянию дисперсной фазы и дисперсионной среды. Сочетание трех агрегатных состояний (твердое, жидкое и газообразное) дает 9 типов дисперсных систем (табл. 9.2). Условно их обозначают дробью, числитель которой указывает на агрегатное состояние дисперсной фазы, а знаменатель — дисперсионной среды. Например, обозначение Г/Ж показывает, что система состоит из газообразной дисперсной фазы и жидкой дисперсионной среды (газообразное вещество в жидкости).
|
|
|
|
|
|
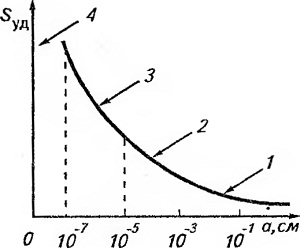
Рис. 35. Зависимость удельной поверхности от поперечного размера частиц для системы:
1 — грубодисперсной; 2 — микрогетерогенной; 3 — коллоидной; 4 — молекулярно-дисперсной
Таблица 9.2
| Дисперсная фаза | Дисперсионная среда | Условное обозначение системы | Название системы и примеры |
| Твердая | Твердая | Т/Т | Твердые гетерогенные системы: шоколад, кристаллический ирис |
| Жидкая | » | Ж/Т | Капиллярные системы (жидкость в пористых телах): мармелад, бисквитное тесто |
| Г азообразная | » | Г/Т | Пористые тела, твердые пены: пастила, зефир, пористый шоколад |
| Твердая | Жидкая | Т/Ж | Суспензии и лиозоли: взвеси, пасты, какао тертое, помадные массы |
| Жидкая | >> | ж/ж | Эмульсии: кремы, молоко, масло, сметана |
| Г азообразная | » | г/ж | Газовые эмульсии и пены: шампанское, пиво |
| Твердая | Газообразная | т/г | Аэрозоли (пыли, дымы), порошки: мучная, сахарная пыль, какао-порошок, крахмал |
| Жидкая | ъ | ж/г | Аэрозоли: туманы, в том числе и промышленные, распыленные для высушивания соки, молоко |
| Газообразная | » | г/г | Коллоидная система не образуется |
|
|
|
КОЛЛОИДНЫЕ СИСТЕМЫ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
Коллоидное состояние характеризуется следующими основными признаками: определенными размерами частиц (10-7... 10-5 см), гетерогенностью и многокомпонентностью.
Дисперсные системы с частицами коллоидных размеров принято называть золями (от латинского слова solutio — раствор).
Системы с газовой дисперсионной средой независимо от природы газа называют аэрозолями. Системы с жидкой дисперсионной средой — лиозолями (от греческого слова lios — жидкость). В зависимости от природы жидкости лиозоли называют гидрозолями (вода), органозолями (органическая среда) или более конкретно — алкозолями (спирты), этерозолями (эфиры) и т. д.
По размеру частиц золи занимают промежуточное положение между истинными растворами и грубодисперсными системами — порошками, суспензиями и эмульсиями. Коллоидные системы образуются двумя путями: диспергированием — дроблением
крупных частиц грубодисперсных систем до коллоидной дисперсности; конденсацией — соединением атомов ионов или молекул в более крупные частицы коллоидных размеров. При этом необходимыми условиями образования коллоидных систем являются нерастворимость вещества дисперсной фазы в дисперсионной среде; достижение частицами дисперсной фазы коллоидной дисперсности; наличие стабилизатора, сообщающего коллоидной системе агрегативную устойчивость.
Стабилизаторами могут быть вещества, специально вводимые в дисперсионную среду, например поверхностно-активные вещества или продукты взаимодействия дисперсной фазы с дисперсионной средой. Стабилизаторы создают вокруг коллоидных частиц адсорбционный защитный слой, препятствующий их агрегатированию.
В производстве различных пищевых продуктов диспергирование и конденсация занимают одно из ведущих мест. Это обусловлено особенностями вещества в дисперсном состоянии, которые обеспечивают удобства фасования, транспортирования, дозирования, способствуют увеличению скоростей химических и биохимических реакций и процессов растворения, сорбции, экстракции и других процессов.
Диспергирование используют при дроблении и измельчении зерна в муку, какао-бобов в какао тертое и какао-порошок, сахара в сахарную пудру, в консервной промышленности при гомогенизации плодово-ягодных пюре и т. п.
Конденсация возникает в ректификационных аппаратах при получении спирта, кристаллизации сахара, выпаривании растворов, оклейке вин и т. д.
Коллоидные системы обладают молекулярно-кинетическими свойствами, обусловленными самопроизвольным движением частиц. Это такие свойства, как диффузия, осмотическое давление и распределение частиц по высоте.
Причиной диффузии (самопроизвольное выравнивание концентраций) частиц в коллоидных системах является броуновское движение, которое, в свою очередь, является следствием геплово-го движения молекул дисперсионной среды. Скорость диффузии обратно пропорциональна размеру диффундирующих частиц, поэтому в коллоидных системах, частицы которых имеют размеры порядка 10_7...10~5 см, т. е. значительно больше молекул обычных низкомолекулярных веществ, скорость диффузии невелика.
На коллоидные частицы, распределенные в дисперсионной среде, действуют две противоположно направленные силы: сила тяжести и сила диффузии. Под действием силы тяжести частицы стремятся осесть на дно — седиментировать (от латинского слова sedimentum — осадок). Силы диффузии же стремятся распределить частицы равномерно по всему объему системы. Таким образом, дисперсные системы способны сохранять определенное распределение частиц по объему. Эта способность называется седиментиционной или кинетической устойчивостью. Грубодисперсные системы кинетически неустойчивы, их частицы велики и поэтому под действием силы тяжести оседают на дно. Молекулярные системы (газы, растворы) обладают очень высокой кинетической устойчивостью. Кинетическая устойчивость коллоидных систем зависит от размеров их частиц: чем меньше размер частиц, тем более кинетически устойчива коллоидная система.
МИКРОГЕТЕРОГЕННЫЕ СИСТЕМЫ В ПИЩЕВЫХ ПРОИЗВОДСТВАХ
К микрогетерогенным системам с размером частиц 10~5... 1СГ3 см относят суспензии (Т/Ж), эмульсии (Ж/Ж), пены (Г/Ж), аэрозоли (Т/Г и Ж/Г) и порошки (Т/Г). Как правило, эти системы непрозрачны, частицы гетерогенных систем быстро оседают. Все эти системы широко распространены в природе и имеют большое значение в пищевой промышленности.
Суспензии. Представляют собой дисперсные системы с твердой дисперсной фазой и жидкой дисперсионной средой. К ним относятся фруктовые и овощные пасты, помадные конфетные массы, какао тертое и др.
Суспензии имеют ряд общих свойств с порошками; эти системы подобны им по дисперсности. В пищевой промышленности суспензии образуются при получении крахмала, при осаждении осадков в производстве сахара, пива, вина, в кондитерской промышленности и др.
Эмульсии. Дисперсные системы, состоящие из жидкой дисперсной фазы и жидкой дисперсионной среды, называются эмульсиями. Обязательное условие образования эмульсии — нерастворимость вещества дисперсной фазы в дисперсионной среде.
Обычно эмульсии получают методом механического диспергирования. Для этого используют различные мешалки, смесители, гомогенизаторы, коллоидные мельницы и ультразвук.
Жидкости, из которых получают эмульсии, нерастворимы друг в друге и, следовательно, отличаются по своим свойствам.
Практически одной из жидкостей всегда является вода, а другой — какая-либо неполярная, нерастворимая в воде жидкость, например масло.
Эмульсии — неустойчивые системы. Неустойчивость этой системы проявляется в самопроизвольном слиянии капелек дисперсной фазы — коалесценции, что приводит к разрушению эмульсии и разделению ее на два слоя. Устойчивость эмульсиям может придать только третий компонент — стабилизатор или эмульгатор. Роль эмульгатора в образовании устойчивой эмульсии заключается, во-первых, в том, что он адсорбируется на границе раздела фаз масло — вода (М/В) и снижает межфазное поверхностное натяжение, т. е. является поверхностно-активным веществом, а во-вторых, концентрируясь на поверхности капелек дисперсной фазы, эмульгатор образует механически прочный слой (пленку). Наличие такой защитной пленки на поверхности частиц дисперсной фазы препятствуют их слиянию, т. е. предохраняет эмульсию от коалесценции.
Природа эмульгатора определяет не только устойчивость, но и тип эмульсии. Эмульгаторы, растворимые в воде, способствуют образованию прямых эмульсий (М/В); эмульгаторы, растворимые в неполярных жидкостях, дают обратные эмульсии (В/М).
К представителям эмульсий относится ряд важнейших жиросодержащих продуктов, например молоко, сливки, сливочное масло, сметана и майонез. Все это — эмульсии. Жиры — необходимая составная часть продуктов питания, но так как они нерастворимы в воде, то лучше усваиваются в эмульгированном состоянии. Поэтому употребляемые в пищу жидкие или твердые жиры (растительное масло, животные жиры) в организме сначала переводятся в эмульгированное состояние под действием желчи, а потом усваиваются.
Аэрозоли и порошки. Это дисперсные системы, дисперсионной средой которых является газ (воздух), а дисперсной фазой могут быть твердые частицы или капельки жидкости. Обычно аэрозоли классифицируются по агрегатному состоянию дисперсной фазы. Аэрозоль с жидкой дисперсной фазой называют туманом, с твердой — дымом и пылью. Аэрозоли с твердой дисперсной фазой, размеры частиц которой больше, чем у дымов, называют обычно пылью. Это деление достаточно условно. Размеры частиц аэрозолей лежат в пределах от 10-5 до 10-2 см. Аэрозоли имеют большое практическое значение в ряде отраслей пищевой промышленности. К типичным аэрозолям относятся водяной туман, топочный дым, мучная и сахарная пыль. В ряде случаев в промышленности прибегают к искусственному получению аэрозолей. Так, для высушивания соки, пюре, молоко распыляют до мельчайших капелек в сухом горячем воздухе. Из образующегося аэрозоля благодаря его большой удельной поверхности испарение влаги идет очень интенсивно и сушка заканчивается за 15...20 с.
Образование аэрозолей может привести к нежелательным и опасным последствиям. Так, пыль многих веществ — муки, сахара, крахмала, угля — образует с воздухом взрывоопасные смеси.
Порошки можно рассматривать как осажденные аэрозоли с твердыми частицами. Однако частицы в них могут быть более крупными и достигать в диаметре 1...2 мм. Размер частиц промышленных порошков определяется их целевым назначением и часто является одним из основных показателей качества продукта. Например, дисперсность и распределение частиц по размерам в какао-порошке влияют на вкусовые качества и пищевую ценность этого продукта. Степень помола зерна оказывает влияние на качество муки.
Частицы порошка всегда находятся в контакте и по этой причине имеют свойство текучести, которое, в свою очередь, зависит от плотности, размера и формы частиц, состояния их поверхности, влажности и других свойств. Повышение дисперсности приводит к уменьшению текучести вследствие роста общей поверхности контакта. Увеличение влажности также снижает текучесть порошков.
Пены. Высококонцентрированные дисперсные системы, в которых дисперсионная среда — жидкость, а дисперсная фаза — газ, называются пенами. Пузырьки газа в пенах имеют большие размеры, форму многогранников и отделены друг от друга очень тонкими слоями дисперсионной среды. Для получения пен применяют диспергационные методы: интенсивное встряхивание или перемешивание жидкости.
Устойчивую пену можно получить только в присутствии стабилизатора — пенообразователя. Это связано с тем, что поверхность жидкости, соприкасающаяся с газообразной средой, находится в особых условиях по сравнению с основной массой жидкости. Эти условия возникают потому, что молекулы поверхностного слоя жидкости в отличие от молекул, находящихся в глубине, подвергаются неодинаковому притяжению молекул жидкости и газа. Каждая молекула внутри жидкости со всех сторон притягивается соседними молекулами, расположенными на расстоянии радиуса сферы действия межмолекулярных сил (рис. 36). В результате силы притяжения компенсируются и равнодействующая этих сил равна нулю.
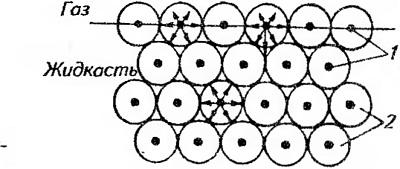
Рис. 36. Схема возникновения поверхностного натяжения:
1 — молекулы; 2 — сферы действия межмолекулярных сил
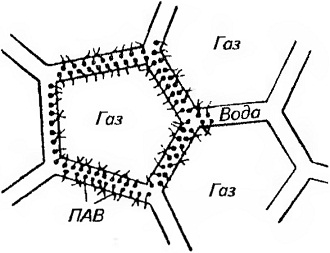
Рис. 37. Схема структуры пены
У молекул поверхностного слоя часть сферы действия межмолекулярных сил находится в газовой фазе, плотность которой меньше плотности жидкости, поэтому равнодействующая всех сил притяжения будет направлена внутрь жидкости перпендикулярно к ее поверхности. Вследствие этого поверхностные молекулы жидкости всегда находятся под действием силы, стремящейся втянуть их внутрь. Это приводит к тому, что поверхность жидкости всегда стремится сократиться. Этим объясняются и шарообразная форма капли жидкости (шар имеет минимальную поверхность), и идеально гладкая поверхность жидкости в широком сосуде. При увеличении поверхности некоторое число молекул из глубины жидкости переходит на поверхность. Процесс переноса молекул из равновесного состояния в особое состояние молекул поверхностного слоя требует затраты внешней работы. Работа по увеличению площади поверхности жидкости переходит в потенциальную энергию молекул поверхностного слоя — поверхностную энергию. Последняя, в свою очередь, отнесенная к единице поверхности, называется поверхностным натяжением
а = F/S,
где F— поверхностная энергия; S — площадь поверхности.
Пенообразующие вещества с длинной молекулярной цепью уменьшают поверхностное натяжение, облегчают образование пены и придают ей стабильность, так как они адсорбируются на границе вода — воздух и образуют высоковязкую структурированную пленку, препятствующую сгеканию жидкости (рис. 37). В этом случае толщина слоя жидкости между пузырьками воздуха уменьшается медленно и пена может существовать длительное время.
Пенообразователями могут служить поверхностно-активные вещества (ПАВ), молекулы которых имеют достаточно длинную углеводородную цепь. Многие молекулы органических веществ состоят из двух частей: полярной группы и неполярного углеводородного радикала. К полярным группам относятся —СООН,-ОН, -NH, —SH, -CN и т. д. Эти группы гидрофильны, т. е. хорошо смачиваются водой. В отличие от них углеводородные радикалы гидрофобны, т. е. не смачиваются водой. Схематически дифильные, состоящие из гидрофильной и гидрофобных частей молекулы изображают в виде символа —•, в котором прямой чертой обозначают неполярный радикал, а кружком — полярную группу.
К типичным пенообразователям водных пен относятся спирты, мыла, белки. Пенообразование имеет важное практическое значение. В частности, многие продукты, такие, как хлеб и ряд кондитерских изделий, имеют структуру пены, что определяет их вкусовые свойства и пищевую ценность.
Дата добавления: 2021-12-10; просмотров: 720; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
