Зависимость скорости реакции от рН
Структура, свойства и функции белков.
Выяснение структуры белков является одной из главных проблем современной биохимии.
Белковые молекулы представляют собой высокомолекулярные соединения, образованные аминокислотами.
Большинство белков имеют 4 уровня организации (4 структуры белковой молекулы).
Первичная структура белка.
В настоящее время расшифрована первичная структура около 2500 белков, а в природе имеется 1012 разнообразных белков.
Первичная структура – это последовательность (порядок) соединения аминокислотных остатков с помощью пептидной связи.
Пептидная связь образуется за счет карбоксильной группы одной аминокислоты и аминогруппы другой аминокислоты.
В образовании первичной структуры участвуют 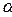 -аминокислоты.
-аминокислоты.
Пептидная связь образует остов полипептидной цепи, она является повторяющимся фрагментом.
Особенности пептидной связи:
1. Копланарность – все атомы, входящие в пептидную связь, находятся в одной плоскости.
2. Заместители по отношению связи C-N-связи находятся в транс положении.
3. Пептидная связь способна к образованию двух водородных связей с другими группами, в том числе с пептидными.
Пептидная связь – прочная ковалентная связь, энергия связи равняется 110 ккал/моль.
Свойства первичной структуры белка
|
|
|
1. Детерминированность – последовательность аминокислот в белке генетически закодирована. Информация о последовательности аминокислот содержится в ДНК.
2. Уникальность – для каждого белка в организме характерна определенная последовательность аминокислот.
Аминокислоты, входящие в состав белков делят на 2 группы:
1. Взаимозаменяемые аминокислоты – это амиокислоты, сходные по структуре и свойствам.
2. Невзаимозаменяемые аминокислоты, отличающиеся по структуре и свойствам.
В белковой молекуле различают 2 вида замен аминокислот:
1. Консервативная – замена одной аминокислоты на другую сходную по структуре. Такая замена не приводит к изменению свойств белка.
Примеры: гли-ала, асп-глу, тир-фен, вал-лей.
2. Радикальная замена – замена одной аминокислоты на другую отличающуюся по структуре. Такая замена приводит к изменению свойств белка.
Примеры: глу-вал, сер-цис, про-три, фен-асп, илей-мет.
При радикальной замене возникает белок с другими свойствами, что может привести к патологии.
Радикальная замена глу на вал в шестом положении в молекуле гемоглобина приводит к развитию серповидно-клеточной анемии. При этой патологии эритроциты в условиях низкого парциального давления приобретают форму серпа. После отдачи кислорода такой гемоглобин превращается в плохо растворимую форму и начинает выпадать в осадок в виде веретенообразных кристаллоидов, названных тактоидами. Тактоиды деформируют клетку и эритроциты приобретают форму серпа. При этом происходит гемолиз эритроцитов. Болезни протекает остро и дети погибают. Эта патология называется серповидно-клеточной анемией.
|
|
|
3. Универсальность первичной структуры. Белки, выполняющие одинаковые функции в разных организмах имеют одинаковую или близкую первичную структуру.
4. В природных белках одна и та же аминокислота не встречается подряд больше 3 раз.
Вторичная структура белка.
Вторичная структура – это способ укладки полипептидной цепи в спиральную или складчатую конформацию.Конформация – это пространственное расположение в органической молекуле замещающих групп, способных свободно изменять свое положение в пространстве без разрыва связей, благодаря свободному вращению вокруг одинарных углеродных связей.Различают 2 вида вторичной структуры белка:
1.  -спираль
-спираль
2.  -складчатость.
-складчатость.
Вторичную структуру стабилизируют водородные связи. Водородные связи возникают между атомом водорода в NH группе и карбоксильным кислородом.
|
|
|
Характеристика  -спирали.
-спирали.
-
 -спираль стабилизируется водородными связями, которые возникают между каждой первой и четвертой аминокислотой. Шаг спирали включает 3,6 аминокислотных остатка.
-спираль стабилизируется водородными связями, которые возникают между каждой первой и четвертой аминокислотой. Шаг спирали включает 3,6 аминокислотных остатка. - Образование
 -спирали происходит по часовой стрелке (правый ход спирали), т.к. природные белки состоят из L-аминокислот.
-спирали происходит по часовой стрелке (правый ход спирали), т.к. природные белки состоят из L-аминокислот.
Для каждого белка характерна своя степень спирализации полипептидной цепи. Спирализованные участки чередуются с линейными. В молекуле гемоглобина  и
и  -цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
-цепи спирализованы на 75%, в лизоциме – 42%, пепсине – 30%.
Степень спирализации зависит от первичной структуры белка.
-
 -спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии.
-спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии. - В образовании водородных связей участвуют все пептидные группы. Это обеспечивает максимальную стабильность
 -спирали.
-спирали.
Спирализации белковой молекулы препятствует аминокислота пролин.
 - складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
- складчатость имеет слабоизогнутую конфигурацию полипептидной цепи.
Для  - складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
- складчатости характерны водородные связи в пределах одной полипептидной цепи или сложных полипептидных цепей.
|
|
|
В белках возможны переходы от  -спирали к
-спирали к  -складчатости и обратно вследствие перестройки водородных связей.
-складчатости и обратно вследствие перестройки водородных связей.
 -складчатость имеет плоскую форму.
-складчатость имеет плоскую форму.
 -спираль имеет стержневую форму.
-спираль имеет стержневую форму.
Водородные связи – слабые связи, энергия связи 10 – 20 ккал/моль, но большое количество связей обеспечивает стабильность белковой молекулы.
В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Третичная структура белка.
Третичной структурой белка называется способ укладки полипептидной цепи в пространстве.
По форме третичной структуры белка делят на глобулярные и фибриллярные.
В стабилизации третичной структуры белковой молекулы участвуют ковалентные связи (пептидные и дисульфидные). Основную роль в стабилизации играют нековалентные связи: водородные, электростатические взаимодействия заряженных групп, межмолекулярные ван-дер-вальсовы силы, взаимодействия неполярных боковых радикалов аминокислот, так называемые гидрофобные взаимодействия.
Гидрофобные радикалы аминокислот ала, вал, изолей, мет, фен в водной среде взаимодействуют друг с другом. При этом неполярные гидрофобные радикалы аминокислот как бы погружаются внутрь белковой молекулы, образуя там сухие зоны, а полярные радикалы оказываются ориентированными в сторону воды.
При укладке полипептидная цепь белка стремится принять энергетически выгодную форму с меньшим запахом энергии.
При формировании третичной структуры полипептидная цепь изгибается в местах нахождения пролина, глицина.
Глобулярные белки растворимы в воде, а фибриллярные нет.
Четвертичная структура белка.
Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).
Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура.
Под четвертичной структурой понимают объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.
В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер.
Для белков с четвертичной структурой характерно понятие субъединицы.
Субъединица – это функционально активная часть молекулы белка.
Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2  и 2
и 2  -цепей.
-цепей.
Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия.
Денатурация.
Денатурация – это процесс нарушения высших уровней организации белковой молекулы (вторичного, третичного, четвертичного) под действием различных факторов.
При этом полипептидная цепь разворачивается и находится в растворе в развернутом виде или в виде беспорядочного клубка.
При денатурации утрачивается гидратная оболочка и белок выпадает в осадок и при этом утрачивает нативные свойства.
Денатурацию вызывают физические факторы: температура, давление, механические воздействия, ультразвуковые и ионизирующие излучения; химические факторы: кислоты, щелочи, органические растворители, алкалоиды, соли тяжелых металлов.
Различают 2 вида денатурации:
- Обратимая денатурация – ренатурация или ренактивация – это процесс, при котором денатурированный белок, после удаления денатурирующих веществ вновь самоорганизуется в исходную структуру с восстановлением биологической активности.
- необратимая денатурация – это процесс, при котором биологическая активность не восстанавливается после удаления денатурирующих агентов.
Свойства денатурированных белков.
1. Увеличение числа реактивных или функциональных групп по сравнению с нативной молекулой белка (это группы COOH, NH2, SH, OH, группы боковых радикалов аминокислот).
2. Уменьшение растворимости и осаждение белка (связано с потерей гидратной оболочки), развертыванием молекулы белка, с «обнаружением» гидрофобных радикалов и нейтрализации зарядов полярных групп.
3. Изменение конфигурации молекулы белка.
4. Потеря биологической активности, вызванная нарушением нативной структуры.
5. Более легкое расщепление протеолитическими ферментами по сравнению с нативным белком – переход компактной нативной структуры в развернутую рыхлую форму облегчает доступ ферментов к пептидным связям белка, которые они разрушают.
Ферментные методы гидролиза основаны на избирательности действия протеолитических ферментов расщепляющих пептидные связи между определенными аминокислотами.
Пепсин расщепляет связи, образованные остатками фенилаланина, тирозина и глутаминовой кислоты.
Трипсин расщепляет связи между аргинином и лизином.
Химотрипсин гидролизует связи триптофана, тирозина и фенилаланина.
Структура и свойства ферментов.
Ферменты (энзимы) – специфические белки, входящие в состав всех клеток и тканей живых организмов, играющие роль биологических катализаторов.
Доказательства белковой природы ферментов.
1. Инативация ферментов при нагревании. Инактивация ферментов совпадает с денатурацией белка. Ферменты разрушаются также под действием минеральных кислот, щелочей, солей, алкалоидов, при облучении рентгеновскими и ультрафиолетовыми лучами.
2. Электрохимические свойства ферментов.
a. Изоэлектрическая точка ферментов.
b. Поведение ферментов при изменении концентрации водородных генов.
c. Высокая специфичность ферментов.
d. Ферменты не способны проникать через полупроницаемые мембраны.
e. Сохранение активности ферментами после действия водоотнимающими средствами (ацетон, спирт, нейтральные соли щелочных металлов).
Для ферментов и неорганических катализаторов характерны общие свойства:
1. Неорганические катализаторы и биологические катализаторы – ферменты требуются в небольшом количестве для проведения реакции.
2. Катализаторы биологические и неорганические выделяются после реакции в неизменном виде.
3. Катализаторы не сдвигают химического равновесия.
4. Катализаторы биологические и небиологические ведут реакцию в обход энергетического барьера, т.е. снижают энергию активации.
Отличия:
1. Ферменты обладают более высокой биологической активностью.
Пример: уреаза разлагает мочевину за 10-4 сек, а под действием воды этот процесс пройдет за 3200 лет.
Гидролиз белков
без фермента 100 – 1100С, 20% HCl – 8-10 часов
с ферментом 370С, pH  7,0 – 1-1,5 часа
7,0 – 1-1,5 часа
2. Высокая специфичность действия ферментов.
Белок  аминокислоты.
аминокислоты.
Протеолитические ферменты разрывают определенные пептидные связи. Ферменты катализируют превращение определенного субстрата или группы субстратов.
3. Активность ферментов зависит от t, pH. Ферменты действуют в более мягких условиях t=370-380, pH – организма, микроэлементы.
4. ферменты действуют последовательно и кооперативно (т.е. сообща).
S  A
A  B
B  C
C  P
P
5. Локализация ферментов по отдельным компартментам.
6. Активность ферментов регулируется.
7. Скорость ферментативной реакции зависит от концентрации фермента.
Ферменты классифицируют по химической структуре:
| Ферменты (энзимы)
| ||
| Простые | Сложные (холоферменты) | |
| (состоят из аминокислот, относятся пищеварительные ферменты: пепсин, трипсин, амилаза, ДНК-аза) | Белковая часть (апофермент состоит из аминокислот) | Небелковая (кофактор; витамины, нуклеотиды, ионы Ме: Fe, Mg, Co, Zn) |
Кофактор делят на 2 группы в зависимости от прочности связи:
1. кофермент – легкоотделяемая небелковая часть
2. простетическая группа – трудноотделяемая часть фермента.
Функции белковой и небелковой части фермента.
1. Белковая часть (апофермент) отвечает за активность и специфичность.
2. Небелковая часть (кофактор) отвечает за превращение субстрата («руки» фермента – разрыв связи, перенос).
Пример: Фермент аминотрансфераза состоит из белковой части и небелковой, которая представлена пиридоксальфосфатом (витамин B6). Этот кофермент обеспечивает перенос NH2-группы с аминокислоты на кетокислоту. Удаление белковой части приводит к потере специфичности (фермент начинает переносить еще 15 групп) и теряет активность.
Небелковая часть фермента неспецифична и может входить в состав разных ферментов и выполнять разные функции.
Пример: Гем входит в состав каталазы, которая обеспечивает расщепление H2O2. Гем входит также в состав цитохромов, которые осуществляют перенос электронов.
Каталаза Бел.ч Гем  H2O2
H2O2
Цитохромы Бел.ч Гем 
Коферменты делят:
1. Переносчики р и  - дегидрогеназы, ферменты, осуществляющие окислительно-восстановительные реакции.
- дегидрогеназы, ферменты, осуществляющие окислительно-восстановительные реакции.
Пример: НАД (витамин В5) – нуклеотид
ФАД (витамин В2) – нуклеотид
2. Переносчики различных функциональных групп – трансферазы.
Пример: Пиродоксальфосфат (ПФ) – NH2
Биотин (витамин Н) - CO2
3. Разрыв химических связей, соединение, изомеризация.
Пример: ТДФ (В1)- тиаминдифосфат
Взаимодействие фермента с субстратом идет при участии активного (ых) центров фермента.
Различают следующие виды активных центров:
1. Субстратный (якорная площадка) активный центр – обеспечивает присоединение субстрата за счет образования слабых связей: водородных, ван-дер-ваальсовых, гидрофобных взаимодействий.
2. Каталитический активный центр – отвечает за превращение субстрата. В пространстве эти центры могут быть разделены, а могут быть совмещены.
3. Аллостерический (регуляторный) обеспечивает присоединение низкомолекулярных веществ, приводит к изменению активности фермента. Аллостерический центр удален от субстратного и каталитического центров.
Закономерности построения активных центров.
1. Активные центры формируются за счет ограниченного числа аминокислот (12-16). Часто аминокислоты удалены друг от друга. Активные центры возникают при образовании четвертичной структуры.
2. В построении активных центров часто участвуют аминокислоты: гис, сер, лиз, асп, цис.
3. В построении активных центров сложных ферментов участвуют группировки кофакторов.
4. Олиго- и мультимерные ферменты на каждом протомере имеют свой каталитический и субстратный центр, аллостерический центр формируется за счет нескольких протомеров. При разрушении четвертичной структуры нарушается аллостерический центр и регуляция прекращается, а каталитическая функция характерная для протомера сохраняется.
5. Активный центр – это трехмерная структура, имеющая вид впадины или щели.
Теории, объясняющие механизм взаимодействия фермента и субстрата.
Теория Фишера – теория предшествующего соответствия, теория «ключ – замок». Согласно теории активный центр фермента существует и точно соответствует субстрату.
Недостатки (противоречия) теории:
- Нет соответствия в термодинамических расчетах (разница в расчетном количестве выделяемой энергии и практически выделяемом количестве энергии).
- По этой теории фермент может ошибаться и присоединять похожий субстрат.
- Субстраты часто низкомолекулярные вещества, а ферменты высокомолекулярные, содержащие большое число аминокислот. Теория не объясняла существование групповой специфичности.
Теория Кошленда – индуцированного соответствия, т.е. активный центр формируется в момент взаимодействия фермента и субстрата, т.е. происходит подгонка. В субстрате происходит изменение связей. Наличие активных центров определяют специфичность.
Виды специфичности.
1. Абсолбтная – одному субстрату соответствует один фермент.
Уреаза катализирует расщепление мочевины, аспартаза катализирует взаимодействие NH3 с фумаровой кислотой, в результате образуется аспарагиновая кислота, но аспартаза не действует на малеиновую кислоту.
СООН COOH
| |
CH CH2
||  |
|
CH  CHNH2
CHNH2
| |
COOH COOH
Фумарат Аспартат
2. Относительная групповая специфичность. Фермент расщепляет группу субстратов, для которых характерен один тип связей.
Пример: пепсин расщепляет пептидную связь –CO-NH между аминокислотами.
Аналогично действуют трипсин, химотрипсин, пептидазы.
Химотрепсин расщепляет пептидные связи между три, тир и фен, но при определенных условиях могут расщеплять амидные и сложноэфирные связи.
3. Стереохимическая специфичность – фермент обеспечивает превращение определенного оптического (стереоизомера). В организме происходит превращение L-аминокислот, но D-углеводов.
Фумараза катализирует превращение фумаровой кислоты (транс-изомер), но не действует на малеиновую кислоту (цис-изомер).
При исследовании специфичности ферментов было установленно, что молекула субстрата должна обладать двумя структурными особенностями:
1. Субстрат должен содержать специфическую химическую связь, которую фермент мог атаковать.
2. В молекуле субстрата должна быть функциональная группа, называемая связывающей группой, которая способна связываться с ферментом и ориентировать молекулу субстрата в активном центре фермента, чтобы атакуемая связь субстрата была правильно расположена по отношению к каталитической группе фермента.
Изоферменты.
Изоферменты – это множественные формы ферментов.
Изоферменты отличаются по сродству к субстрату, по максимальной скорости катализирумой реакции (по активности), по электрохимическим свойствам, по константе Михаэлиса, по тканевой локализации.
Изоферменты состоят из нескольких субъединиц.
Примером изоферментов является лактатдегидрогеназа (ЛДГ), катализующая реакцию превращения пир  лак и наоборот.
лак и наоборот.
ЛДГ состоит из 4 субъединиц двух разных типов – Н и М и в результате комбинаций образуется 5 изоферментов:
ЛДГ1 – Н4
ЛДГ2 – Н3М
ЛДГ3 – Н2М2
ЛДГ4 – НМ3
ЛДГ5 – М4
Изоферменты отличаются по молекулярной массе, электрофоретической подвижности, по отношению к активаторам и ингибиторам.
Для каждой ткани в норме характерно свое соотношение форм (изоферментный спектр) ЛДГ.
В сердечной мышце преобладает ЛДГ1 (Н4), а в скелетных мышцах и печени ЛДГ5 (М4).
Это свойство изоферментов используется в клинике для дифференциальной диагностики органических и функциональных поражений органов и тканей. По изменению содержания изоферментов в сыворотке крови судят о нахождении патологического процесса, так и о степени поражения органа или ткани.
| Витамин | Коферментная форма | Переносимая группа | Тип катализируемой реакции |
| В1 тиамин | ТДФ- тиаминдифосфат ТПФ (ТТФ) - тиаминпирофосфат | Отщепление СО2 | Окислительное декарбоксилирование |
| В2 рибофла-вин | ФМН – флавинмононуклеотид ФАД – флавинаденин-динуклеотид | Протоны (Н+) и электроны (  ) )
| Дегидрирование |
| В3 пантоте-новая кислота | HSKoA – (аш эс коэнзим А) | Ацильная группа (R-C=O) | | Ацилирования |
| В5 никотин-амид | НАД – никотинамидаде-ниндинуклеотид НАДФ – никотинамид-адениндинуклеотид фосфат | Протоны и электроны | Дегидрирование |
| В6 пиридок-саль | ПФ – пиридоксаль фосфат | NH2-группа (амино-группа) | Трансаминирование |
| В7 биотин | Коферментной формой является сам витамин | СО2 | Карбоксилирование |
| В9,10 фолиевая кислота | ТГФК – тетрагидро-фолиевая кислота ТГФК-СН3 – метилтетра-гидрофолиевая кислота, СН2ОН–ТГФК – гидроксиметилен, ТГФК-С=О – формил- | ТГФК Н | Перенос одноуглерод-ных фрагментов: метил – СН3, гидрокси-метилен - СН2ОН, формил –С=О | H | |
| В12 кобал-амин | СН3-В12 – метил-кобаламин, ДА-В12 – дезоксиаденозил кобаламин | Перенос метильной группы СН3 | Трансметилирование |
Факторы, влияющие на активность ферментов.
- Концентрация субстрата [S]
- Концентрация фермента [F]
- Температура
- рН
- Низкомолекулярные вещества (активаторы, ингибиторы).
Концентрация субстрата зависит от питания, возраста, физической нагрузки.
Зависимость скорости ферментативной реакции субстрата выражается уравнением Михаэлиса-Ментен:

Vmax – максимальная скорость реакции
[S] – концентрация субстрата
Km – константа Михаэлиса.
Анализ уравнения Михаэлиса-Ментен.
- Концентрация субстрата мала, стремиться к нулю. При этих условиях [S] можно пренебречь:
[S]  0, при этом [S] можно пренебречь:
0, при этом [S] можно пренебречь:
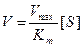
- Концентрация субстрата стремится к бесконечности, пренебрегаем Km и уравнение имеет вид:
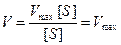
Сокращаем на [S] и скорость реакции равняется Vmax.
- Если принять, что
 , то из уравнения Михаэлиса-Ментен, разделив его на Vmax, получили Km=[S]:
, то из уравнения Михаэлиса-Ментен, разделив его на Vmax, получили Km=[S]:
 и разделив на Vmax получим
и разделив на Vmax получим 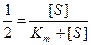 . Решая уравнение относительно Km получаем Km+[S] = 2[S],
. Решая уравнение относительно Km получаем Km+[S] = 2[S],
Km=[S]
Km – величина, численно равная концентрации субстрата при  , выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
, выраженная в молях. Km = 10-1 – 10-6 – для клеток организма, величина const.
Km показывает:
- Степень сродства между ферментом и субстратом, существует обратная зависимость – чем меньше Km, тем больше сродство F к S.
- Km позволяет определить какой субстрат будет превращаться под действием данного фермента:
Например, этиленгликоль – составная часть антифриза и алкагольдегидрогеназа (АДГ) будет превращать его в щавелевую кислоту, которая является ядом для печени.
Алкагольдегидрогеназа превращает этиловый спирт в уксусный альдегид и степень сродства АДГ к С2Н5ОН выше, чем к этиленгликолю и на этом основан способ нейтрализации этиленгликоля.
- Km показывает степень сродства между белковой и небелковой частью F,
- Km позволяет определить вид ингибирования.
Способ определения Km .
- Построение график Михаэлиса-Ментен:
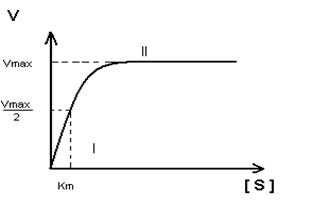
I участок – с увеличением концентрации субстрата увеличивается скорость ферментативной реакции
II участок – с увеличением концентрации субстрата скорость реакции не изменяется, т.к. все активные центры заняты.
Недостаток графика Михаэлиса-Ментен при определении Km заключается в том, что Vmax достигается с трудом, реакции в клетке протекают с оптимальной скоростью, а не Vmax.
- Построение графика Лайнуэвера-Бэрка – метод обратных величин
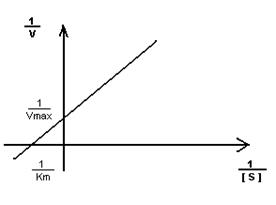
Преимущество метода заключается в том, что прямую можно построить по двум точкам и нет необходимости определять максимальную скорость.
Зависимость скорости ферментативной реакции от концентрации фермента.
Зависимость носит линейный характер. Скорость химической реакции, катализируемой данным ферментом прямопропорциональна  концентрации фермента. При этом концентрация субстрата величина постоянная. Это обясняетя большим количеством активных центров при определенном количестве молекул субстрата
концентрации фермента. При этом концентрация субстрата величина постоянная. Это обясняетя большим количеством активных центров при определенном количестве молекул субстрата
Зависимость скорости ферментативной реакции от температуры.
 При t=36-380 ферменты обладают наибольшей активностью. Эта температура называется температурный оптимум:
При t=36-380 ферменты обладают наибольшей активностью. Эта температура называется температурный оптимум:
С повышением t0 до оптимума активность ферментов повышается.
Высокие t вызывают денатурацию ферментов.
Низкие t снижают активность ферментов.
Изменение t0 приводит к нарушению связей, закрепляющих белковую структуру ферментов (третичную, четвертичную), т.е. вызывает денатурацию.
Обратимая денатурация наблюдается при понижении t0. Это позволяет хранить ферменты, биологические жидкости, кровь.
Повышение температуры необратимо нарушает белковую структуру фермента. Это свойство используется при стерилизации материалов, инструментов.
Лихорадка – защитное свойство организма, т.к. происходит денатурация ферментов микроорганизмов и поэтому нецелесообразно применять жаропонижающие средства.
Зависимость скорости реакции от рН
 На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
На графике эта зависимость имеет вид колокола. На вершине кривой есть точка оптимума рН, где фермент имеет наибольшую активность. рН оказывает воздействие на степень ионизации кислотных и основных групп. При различных значениях рН активный центр может находиться в частично ионизированной или неионизированной форме, что оказывает влияние на третичную структуру активного центра и на формирование фермент-субстратного комплекса.
Влияние рН.
Ферменты, как и все белки содержат много зараженных положительно и отрицательно групп (-NH2 ,-COOH), которые входят в состав аминокислот арг, лиз, асп, глу. Общий заряд зависит от соотношения между этими группами. Заряд белка-фермента изменяется в зависимости от концентрации в клетке ионов водорода, которые нейтрализуют (подавляют диссоциацию) карбоксильной группы:

и образуют положительно заряженные группы: 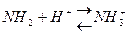
Таким образом увеличение положительного заряда или уменьшение отрицательного заряда на поверхности фермента обусловлено повышением концентрации ионов водорода.
Состояние белковой молекулы, при котором суммарный заряд белка равен 0, называется изоэлектрическим состоянием.
Значение рН, при котором заряд белковой молекулы равен 0, называется изоэлектрической точкой (ИЭТ).
Большинство ферментов отличаются наибольшей активностью и стабильностью в области изоэлектрической точки.
Резкие колебания рН способствуют денатурации белка, т.е. уменьшению ферментативной активности.
Значение рН, при котором фермент проявляет максимальную активность, называется оптимумом рН, который характерен для данного фермента, реагирующего с определенным субстратом.
Внутриклеточные ферменты обычно имеют оптимум рН соответствующий нейтральной среде (рН =7) близкой к нормальному значению рН для жидкостей организма. Есть ферменты оптимум рН которых находится в сильнокислой и сильнощелочной среде

Классификация ферментов.
Выделяют шесть классов ферментов:
- Гидролазы – ферменты, расщепляющие субстрат при участии молекул воды.
- Лиазы – ферменты, расщепляющие молекулы субстрата без участия воды, при этом часто образуются низкомолекулярные продукты – СО2, NH3, Н2О.
- Изомеразы – ферменты, вызывающие в молекуле изомерные превращения.
- Феразы (трансферазы) – ферменты, переносящие группы от одной молекулы на другую или из одного положения в другое в пределах одной молекулы.
- Оксидоредуктазы - ферменты, катализирующие перенос протонов и электронов (т.е.окислительно-восстановительные реакции).
- Лигазы(синтетазы) – ферменты, катализирующие синтез крупных молекул из более мелких.
Номенклатура ферментов.
Рабочее название фермента складывается из названия субстрата, типа катализируемой реакции и окончания –аза.
Систематическое название складывается из названия субстратов, названия типа катализируемого химического превращения и окончания –аза.
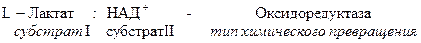
Название класса указывает на тип химической реакции, катализируемой ферментами. Классы делятся на подклассы – уточняет действие фермента, так как указывает на природу химической группы субстрата, атакуемой ферментом. Подкласс делится на подподклассы. Подподклассы конкретизируют действие фермента, уточняя природу атакуемой связи субстрата или природу акцептора.
I. Оксидоредуктазы катализируют окислительно-восстановительные реакции. Оксидоредуктазы называют также дегидрогеназами или редуктазами. Оксидоредуктазы переносят протоны и электроны. Оксидоредуктазы делят на подклассы:
1. Аэробные дегидрогеназы – переносят протоны и электроны на кислород.
Коферментами оксидоредуктаз являются:
НАД – никотинамидадениндинуклеотид – содержит витамин В5 – никотинамид.
НАДФ – никотинамидадениндинуклеотид фосфат, содержит витамин В5.
ФАД – флавинадениндинуклеотид, содержит витамин В2 – рибофлавин.
ФМН – флавинмононуклеотид, содержит витамин В2 – рибофлавин.
Оксидоредуктазы катализируют реакции дегидрирования, т.е. отщепление водорода.
Оксидоредуктазы окисляют следующие функциональные группы:
-ОН, -С=О, -NH2
|
Н
Коферменты дегидрогеназ присоединяют протоны и электроны.
НАД-зависимые дегидрогенизы окисляют следующие функциональные группы: спиртовый гидроксил (ОН), альдегидную группу (СОН), аминогруппу (NH2).
НАД-зависимые дегидрогеназы катализируют следующие типы реакций:
- Дегидрирование гидроксильных групп
СН3 СООН
| лактатдегидрогеназа |

 HC-O С=О
HC-O С=О
| |
COOH НАД+ НАДН +Н+ СН3
Лактат пируват
Молочная кислота
- Дегидрирование альдегидных групп (дегидрирование глицеральдегид – 3 – фосфата)
СН3 СООН
| + НАД+ + Н3РО4  | + НАДН + Н+
| + НАДН + Н+
HC-OH НC-OН
| |
CH2OPO3H2 CH2OPO3H2
Глицеральдегид-3-фосфат 1,3-бифосфоглицериновая кислота
- Дегидрирование аминогрупп
СООН СООН
| |
СН2 +НАД СН2
 | | + НАДН + Н+
| | + НАДН + Н+
СН2 глутаматдегидрогеназа СН2
| |
СНNH2 С=О
| |
COOH СООН
Глутаминовая кислота 
ФАД – зависимые дегидрогеназы окисляют (дегидрируют) следующие функциональные группы: отщепление водорода от групп –СН2- СН2- с образованием двойной связи.
Пример:
СООН СООН
| ФАД ФАДН2 |
 СН2 СН
СН2 СН
 | ||
| ||
СН2 сукцинатдегидрогеназа СН
| |
СООН СООН
Сукцинат фумарат
2. Анаэробные дегидрогеназы переносят протоны и электроны не на кислород, а на какой-то другой субстрат. Эти ферменты называют также оксигеназами.
II. Трансферазы – ферменты, катализирующие реакции переноса различных групп от одного субстрата к другому.
Подклассы трансфераз:
1. Аминотрансферазы осуществляют перенос аминогруппы с аминокислоты на кетокислоту. Катализируют реакцию трансаминирования.
2. Метилтрансферазы катализируют перенос метильных групп (СН3-).
3. Фосфотрансферазы катализируют перенос остатка фосфорной кислоты. В подкласс фосфотрансфераз входят киназы, которые используют АТФ в качестве донора фосфатного остатка.
III. Лиазы – ферменты, катализирующие разрыв С-О, С-С, С-N и других связей, а также обратимые реакции отщепления различных групп, без участия воды.
1. Карбоксилазы – присоединение карбоксильной группы (СО2).
2. Дегидратазы – отнятие молекулы воды от субстрата.
3. Альдолазы – расщепляют связь С-С.
4. Гидратазы – ферменты воды по двойной связи.
IV. Изомеразы – ферменты, катализирующие превращение в пределах одной молекулы.
Катализируют реакции изомеризации. Подклассы: мутазы, таутомеразы, рацемазы, эпимеразы, изомеразы.
V. Гидралазы – ферменты, катализирующие разрыв связей в присутствии воды.
VI. Лигазы (синтетазы) – ферменты, катализирующие соединение двух молекул с использованием энергии фосфатной связи АТФ.
Влияние низкомолекулярных веществ на активность фенрментов.
Низкомолекулярные вещества, изменяющие скорость ферментативных реакций делят на 2 группы:
1. Активаторы – ускоряющие протекание ферментативной реакции.
2. Ингибиторы – замедляют протекание ферментативных реакций.
Активаторы делят на 2 группы:
- В качестве активатора могут выступать коферменты или простетическая группа (в основном витамины).
Для этой группы характерны те же закономерности, что описаны для взаимодействия фермента и субстрата F+S и A+Ko подчиняются одним закономерностям 

Km определяет сколько вводить Ko.
- Активаторы, являющиеся связующим звеном между F и S (ориентирование фермента и субстрата) и обеспечивающим взаимодействие фермента и субстрата (F A S), взаимодействие апофермента и кофактора Апоф А Ко
Часто это ионы Ме – Со, Mn, Mg, Zn.
Значение ингибирования активности ферментов.
1. Ингибирование лежит в основе действия лекарственных веществ и токсических агентов.
2. Ингибирование – один из подходов к изучению ферментативного действия (например, структуры активного центра).
Ингибирование бывает 2-х видов:
- Необратимое
- Обратимое
Необратимое ингибирование имеет место тогда, когда присоединение ингибитора к ферменту носит необратимый характер.
 Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
Например: это действие алкилирующих агентов (подацетамид) необратимо действующих на тиогруппу ферментов. Необратимость связана с тем, что равновесие смещено вправо, в сторону образования ковалентного производного фермента:
F-S-H + J-CH2CONH2  F-S-CH2-CONH2 + HJ
F-S-CH2-CONH2 + HJ
Необратимым является действие токстческих фосфоорганических соединений, которые называют нервно-паралитическими ядами, они ингибируют ацетилхолинэстеразу, участвующую в передаче нервных импульсов.
Необратимое ингибирование
Многие ингибиторы необратимо связываются с Е или ES, и, поскольку это влияет на Vmax, такое ингибирование относят к неконкурентному.
Ингибиторы этого типа часто ковалентно связываются с ферментом или с комплексом фермент-субстрат, необратимо изменяя нативную конфигурацию. Это объясняет токсическое действие Hg2+, Pb2+ и соединений мышьяка.
На необратимом ингибировании основано действие пенициллина. Пенициллин ингибирует действие одного из ферментов, участвующих в сборке клеточной стенки бактерий. Клетки, ен имеющие клеточной стенки, легко лизируются.
Действие аспирина основано на ковалентной модификации фермента. Аспирин снижает скорость синтеза простагландинов, выступая в роли ингибитора циклооксигеназного компонента эндопероксид-синтетазы. Считается, что возникновение болей, воспалений, температуры связано с простагландинами.
При интоксикации связывание яда или его вытеснение из комплекса фермент-ингибитор возможно с помощью реактиваторов, или противоядий. К ним относятся все SH – содержащие комплексоны (цистеин, димеркаптопропанол), лимонная кислота.
Обратимое ингибирование бывает 2-х видов:
- Конкурентное
- Неконкурентное
Обратимое конкурентное ингибирование – активность фермента восстанавливается после удаления ингибитора путем увеличения концентрации субстрата.
Отличительный признак конкурентного ингибитора – конкурентный ингибитор по структуре близок субстрату. Конкурентный ингибитор конкурирует с субстратом за активный центр фермента.
Пример: сукцинатдегидрогеназа катализирует превращение сукцината в фумарат. Конкурентным ингибитором сукцинатдегидрогеназы является малоновая кислота, которая содержит на одну группу СН2 меньше, чем сукцинат.
СООН СООН COOH
| СДГ | |
 СН2
СН2  СН CH2
СН CH2
 | || |
| || |
СН2 СН COOH
| | малоновая кислота
СООН СООН
Сукцинат и малоновая кислота являются структурными аналогами и конкурируют за активный центр фермента. (Это является подтверждением тому, что активный центр не является жестким образованием, подходящим субстрату, как «ключ-замок».)
При конкурентном ингибировании степень ингибирования фермента не зависит от абсолютной концентрации ингибитора, а от соотношения ингибитора и субстрата, если это соотношение J:S=1:50, то активность фермента ингибируется на 50%.
Действие конкурентного ингибитора снимается повышением концентрации субстрата, так как сродство фермента и субстрата выше, чем сродство фермента и ингибитора.
Кm F и S и Km F и J различны и это узнают путем построения графиков Михаэлиса-Ментен и Лайнуэвера-Бэрка


Vmax – одинакова
Km с ингибитором увеличивается.
Действие многих химиотерапевтических средств основано на конкурентном ингибировании. Например, сулфаниламидные препараты, используемые для лечения болезней, вызываемых микробными инфекциями. Сульфаниламидные препараты по структуре сходны с п-аминобензойной кислотой. ПАБК является предшественником в микробиологическом синтезе фолиевой кислоты, из которой кофермент, необходимый для синтеза нуклииновых кислот микроорганизмов. При введении сульфаниламидных препаратов наблюдается угнетение фермента и гибель микроорганизмов.
На конкурентном ингибировании основано применение и фторурацила, который используется при лечения рака.
Неконкурентное, обратимое ингибирование.
Действие неконкурентного ингибитора не может быть устранено увеличением концентрации субстрата.
Неконкурентный ингибитор не связывается с активным центром, он может связываться со свободным ферментом  , либо с комплексом FS
, либо с комплексом FS  , либо с тем и другим, но обе формы JF и JFS – не активны.
, либо с тем и другим, но обе формы JF и JFS – не активны.

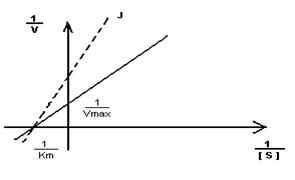
Km- не изменяется, т.к. нет связывания с активным центром.
Vmax – уменьшается.
Наиболее общий тип неконкурентного ингибирования имеет место при действии реагентов, обратимо связывающих SH-группы цис, входящего в каталитический центр или близко от него. Это ионы Cu2+, Hg2+, Ag+ и их производные с образованием меркаптидов:

Ферменты, для активации которых необходимы ионы Ме ингибируются по такому способу агентами связывающими эти ионы:
 ферро или ферроцианид.
ферро или ферроцианид.
Регуляция активности ферментов.
Использование ферментов в фармации, медицине.
Виды регуляции активности ферментов:
1. Аллостерическая модификация.
- Активация зимогенов.
- Регуляция путем химической модификации.
Аллостерическая модификация.
 Этот вид активации характерен для ключевых обменных процессов:
Этот вид активации характерен для ключевых обменных процессов:


Ключевой фермент начинает (открывает) процесс.
Ферменты, от активности которых зависит скорость процесса, называются регуляторными или аллостерическими.
Особенности аллостерических ферментов.
1. Регуляторные ферменты – это олиго или мультиферменты.
- Регуляторные ферменты имеют аллостерический центр или центры, которые формируются за счет 2 или нескольких протомеров.
- Для регуляторных ферментов характерен сигмоидный характер зависимости скорости реакции от концентрации субстрата.
S-образная форма кривой объясняется по-видимому тем, что регуляторный фермент состоит не из одной полипептидной цепи, а из нескольких. Каждый протомер обладает свойством связывать субстрат (есть субстратные и каталитические центры на каждом протомере) с образованием F-S-комплекса. Активные центры конкурируют между собой за субстрат до тех пор пока не произойдет полного насыщения всех активных центров, после этого скорость реакции быстро достгает максимума.
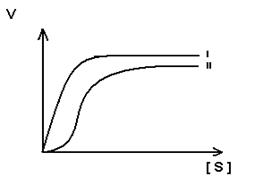 I.- простой фермент
I.- простой фермент
II – регуляторный фермент.
Вещества, связывающиеся с активны центром и изменяющие структуру белковой молекулы фермента, а следовательно и пространственную ориентацию функциональных групп аминокислот, составляющих субстратный и каталитический центры называют модификаторами.
Модификаторы бывают двух видов:
- Положительные модификаторы (+) – после присоединения активность ферментов повышается.
- Отрицательные модификаторы(-) после взаимодействия с ферментом снижают его активность.
Модификаторы обычно низкомолекулярные вещества. Это субстраты конечные продукты реакции.
Различают три вида регуляторных ферментов:
1. Гомотропные – для этого класса ферментов субстрат является положительным модулятором или регуляция по принципу прямой положительной связи.
2. Гетеротропные – активируются другими модификаторами, ингибируются конечным продуктом или регуляция по принципу обратной отрицательной связи.
3. Гомогетеротропные – для этих ферментов характерно смешанное регулирование и субстратом и другими соединениями.
Активация зимогенов.
Многие пищеварительные ферменты синтезируются в неактивной форме – в виде зимогенов (пепсиноген, трипсиноген и др.).
Эти неактивные зимогены активируются после попадания в ЖКТ, благодаря этому не происходит переваривания клеток, где происходит синтез ферментов. Зимогены не активны, так как содержат дополнительные участки или группы, которые препятствуют доступу субстрата к активному центру. Удаление этой блокирующей группы протеолитическими ферментами приводит к необратимой активации зимогена.
Трипсиноген 

Эндопептидаза расщепляет пептидную связь между лиз в положении 6 и лей в положении 7, в результате отщепляется пептид и образуется активный трипсин.
Схема активации зимогена:
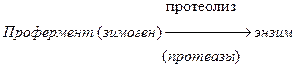
По такой схеме происходит активация целого ряда зимогенов:
- Пищеварительные ферменты
- Ферменты свертывания крови
- Белковые гормоны
- Кининовая система, компонент
- Фибриллярный белок проколлоген
 коллоген.
коллоген.
Основная черта активации зимогенов заключается в каскадном (последовательном) включении зимогенов с образованием активных ферментов например 12-перстной кишки.
Регуляция путем химической модификации.
По существу это изменение химической структуры активного центра. В некоторых случаях фермент может существовать в клетке в неактивной форме или слабоактивном состоянии, но присоединение фосфатной группы при участии фосфорилирующего фермента, называемого киназой, к аминокислоте вблизи от активного центра, активирует фермент. Такая система может быть возвращена в исходное состояние под действием фермента, отщепляющего фосфатную группу.
Киназа Ф
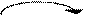 F (актив)
F (актив)
 F(неакт) Ф
F(неакт) Ф
Фосфотаза – Ф
Такой механизм очень важен, т.к. активность киназы и фосфатазы могут изменяться под действием гормонов.
Уровни организации ферментов в клетке.
Большинство ферментов в клетке имеют сложное строение, т.е. это мультиферменты.
По сложности молекулярная организация мультиферменые системы, осуществляющие последовательные реакции можно разделить на 3 уровня.
I уровень организации
В простейших мультиферментных системах отдельные ферменты растворены в цитозоле и работают независимо друг от друга; предполагается, что во время своего действия они физически друг с другом не связаны. Небольшие молекулы субстрата, характеризующиеся высокой скоростью диффузии, очень быстро находят дорогу от одного фермента к другому:
II уровень организации
Отдельные ферменты, относящиеся к этим системам, могут ассоциировать друг с другом в форме ферментных комплексов.
Например: синтетаза жирных кислот, представляющая систему из семи разных ферментов, молекулы которых объединены в тесно связанный комплекс, который с трудом распадается на отдельные ферменты, причем после диссоциации все они оказываются неактивными (биологически выгодно – сокращается скорость образования конечного продукта).
III уровень организации
Это наиболее высокоорганизованные ферментные системы, связанные с крупными надмолекулярными структурами (мембраны, рибосомы).
Цепь дыхательных ферментов, прикрепленных к мембране митохондрий и представляющих собой по существу часть мембраны. Мембраны могут изменять специфичность ферментов, изменяя пространственную конформацию белковой молекулы фермента (четмертичная структура). Например, АТФ-аза, связанная с мембраной синтезирует АТФ, а свободная разрушает.
Биологическое окисление.
В процессе обмена веществ пищевые продукты (углеводы, липиды) подвергаются катаболизму.
Катаболизм – это процесс расщепления высокомолекулярных веществ до низкомолекулярных веществ, идущий с выделением энергии. В процессе катаболизма происходит упрощение структуры высокомолекулярных веществ.
Энергия, выделившаяся в процессе катаболизма, используется для синтеза новых веществ, т.е. в процессе анаболизма.
Взаимодействие превращения вещества и энергии называются метаболизмом.
Процессы окисления протекают в организме и вне организма. Эти процессы имеют сходства и различия.
Сходство между окислением в организме и вне организма.
- В результате окисления образуются одинаковые конечные продукты СО2 и Н2О.
- Выделяется одинаковое количество энергии.
Различия между окислением в организме и вне организма.
1. Вне организма энергия выделяется за счет окисления атомов углерода, а в организме за счет окисления атомов водорода.
- Вне организма кислород соединяется с окисляемым субстратом. В организме кислород не соединяется с субстратом.
- Вне организма энергия выделяется одномоментно и не аккумулируется, т.е. не запасается. В организме энергия выделяется порциями, «каскадно» и аккумулируется (запасается). «Каскадное» выделение энергии предохраняет клетку от перегрева.
- Основной реакцией окисления в организме является реакция дегидрирования, т.е. отщепление водорода (протонов). Вспомогательными реакциями являются реакции дегидратации и декарбоксилирования.
- Процесс окисления в организме многоступенчатый, ферментативный процесс.
Процесс окисления субстратов в биологических объектах называется биологическим окислением.
Виды биологического окисления.
- Тканевое дыхание
- Субстратное окисление
Тканевое дыхание – многоступенчатый ферментативный процесс, в котором конечным акцептором электронов является кислород.
В процессе тканевого дыхания участвую ферменты – оксидоредуктазы, образующие дыхательную цепь.
Дыхательная цепь – это комплекс оксидоредуктаз, участвующих в переносе протонов и электронов от окисляемого субстрата к кислороду.
Дыхательная цепь локализована в кристах митохондрий.
Строение дыхательной цепи.
Дыхательная цепь включает 4 группы ферментов:
1. Пиридинзависимые дегидрогеназы – коферментом является НАД, НАДФ.
2. Флавинзависимые дегидрогеназы – коферментом является ФАД, ФМН.
3. Коэнзим Q или убихинон.
4. Цитохромы b, c, a, a3.
Цитохромы являются геминовыми белками, в качестве небелковой части содержат гем. В составе гема содержатся атом железа, который может изменять степень окисления с +3 до +2, присоединяя или отдавая электрон.
В составе дыхательной цепи выделяют два участка:
1. Участок, включающий пиридинзависимые дегидрогеназы – коэнзим Q обеспечивает перенос протонов и электронов. На уровне коэнзима Q протоны уходят в среду митохондрий, т.к. цитохромы по своему строению способны переносить только электроны.
2. Участок цитохромов, обеспечивающий перенос только электронов.
Основное значение цитохромной системы перенос электронов от окисляемого субстрата на молекулярный кислород с образованием воды:
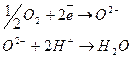
Схема переноса электронов и протонов по дыхательной цепи.
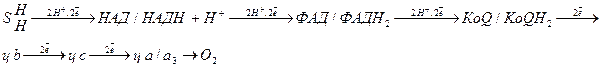 По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
По дыхательной цепи от окисляемого субстрата до кислорода передается 2 протона и два электрона.
Коферменты дыхательной цепи принимая протоны и электроны превращаются в восстановленную форму, а отдавая их снова превращается в окисленную форму.
Движущей силой, обеспечивающей перенос протонов и электронов от субстрата к кислороду, является разность редокс-потенциалов. В дыхательной цепи происходит нарастание редокс-потенциала (от –0,32 в до +0,81 в О2)
Для синтеза одной макроэргической связи АТФ требуется перепад редокс-потенциалов между участками дыхательной цепи примерно в 0,22 в на пару перенесенных электронов.
Длина дыхательной цепи (количество ферментов) может быть различна и зависит от природы окисляемого субстрата.
Для клетки важно, чтобы молекула кислорода, присоединив 4 электрона, полностью восстановилась до двух молекул воды. При неполном восстановлении кислорода в случае присоединения двух электронов образуется перекись водорода, а в случае присоединения одного электрона – супероксидный радикал  . Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
. Перекись водорода и супероксидный радикал токсичны для клетки, т.к. повреждают клеточные мембраны, взаимодействую с остатками ненасыщенных жирных кислот мембранных липидов.
Аэробные клетки защищают себя от действия перекиси и супероксида с помощью двух ферментов: супероксиддисмутазы и каталазы.

Пути использования энергии переноса электронов.
При переносе пары электронов происходит изменение свободной энергии и эта энергия используется по двум путям:
1. Энергия переноса электронов используется на синтез АТФ.
2. Энергия переноса электронов используется для выработки тепла.
При переносе пары электронов по дыхательной цепи происходит изменение свободной энергии, равная 52,6 ккал. Этой энергии достаточно для синтеза 3 молекул АТФ. Синтез трех молекул АТФ в стандартных условиях требует затраты  ккал.
ккал.
В трех пунктах переноса электронов происходит наибольшее изменение свободной энергии и эти пункты называются пунктами сопряжения тканевого дыхания и окислительного фосфорилирования.
Окислительное фосфорилирование это процесс ресинтеза АТФ из АДФ и Фн, сопряженный с тканевым дыханием.
Пункты сопряжения находятся на участках:
1. НАД/ФАД
2. ц в/ц с
3. ц а/а3  О2
О2
Пункты сопряжения постоянны, но их количество зависит от природы окисляемого субстрата.
При окисления НАД – зависимых субстратов имеет место 3 пункта сопряжения, т.е. выделяется 3АТФ, при окислении ФАД – зависимых субстратов имеет место 2 пункта сопряжения и выделяется 3 АТФ, при окислении цитохромзависимых субстратов, количество АТФ, зависит от того, на какой цитохром сбрасываются электроны: при сбросе электронов на цитохром b выделяется 2АТФ в процессе окислительного фосфорилирования, а на цитохром с – 1АТФ.
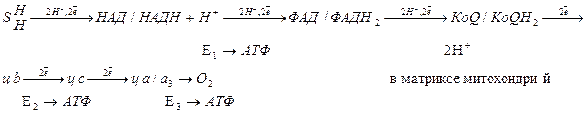 Коэффициент фосфорилирования – это соотношение Р/О как показатель сопряжения дыхания и фосфорилирования.
Коэффициент фосфорилирования – это соотношение Р/О как показатель сопряжения дыхания и фосфорилирования.
Было установлено, что при поглощении одного атома кислорода (или при переносе пары электронов от субстрата к кислороду) поглощается не один атом неорганического фосфата, а примерно три т.е. коэффициент Р/О примерно равен 3. Т.е. в дыхательной цепи имеется как минимум три пункта сопряжения, где неорганический фосфат участвует в образовании АТФ.
Процесс биологического окисления может не сопровождаться синтезом АТФ.
Окисление, не сопровождающееся синтезом АТФ, называется свободным окислением. В этом случае энергия выделяется в виде тепла. Это может наблюдаться при действии токсинов и сопровождается повышением температуры тела.
Причины нарушения биологического окисления.
1. Недостаток субстратов окисления (углеводов, липидов, т.е. пищи).
2. Нарушение работы ферментов в дыхательной цепи:
1. Дефект апофермента (нарушен синтез белковой части фермента).
2. Дефект кофермента (нарушение синтеза коферментов из-зи недостатка витаминов В2,В5, К).
3. Недостаток кислорода.
4. Действие ингибиторов.
Аминобарбитал ингибирует перенос протонов и электронов на участке НАД/ФАД, окисление НАДзависимых субстратов прекращается.
Антимицин ингибирует перенос электронов на участке цитохром b, цитохром с.
Цианады ингибируют перенос электронов на участке цитохромоксидазы/кислород.
При большинстве физиологических состояний перенос электронов сопряжен с окслительным фосфорилированием.
Ряд соединений может вызвать разобщение тканевого дыхания и окислительного фосфорилирования. Разобщителями этих процессов являются следующие соединения: 2,4 – динитрофенол, гормон щитовидной железы – тироксин, дикумарин и его производные, жирные кислоты.
Разобщение окислительного фосфорилирования и тканевого дыхания может быть биологически полезным. Разобщение представляет собой способ генерирования тепла для поддержания температуры тела у зимнеспящих животных и млекопитающих адаптированных к холоду. В качестве разобщителя выступают жирные кислоты, которые накапливаются в бурой жировой ткани. Такой бурый жир есть и у новорожденных детей, что позволяет поддерживать температуру тела при еще несовершенной системе терморегуляции.
У больных с гиперфункцией щитовидной железы отмечается повышение температуры тела, что обусловлено разобщением процессов тканевого дыхания и окислительного фосфорилирования, вызванного тироксином.
При недостатке кислорода в тканях процесс тканевого дыхания затруднен и в тканях протекает субстратное окисление.
Субстратное окисление – это процесс окисления, при котором конечным акцептором электронов является субстрат, а не кислород.
Субстратное окисление – это аварийный источник получения энергии при недостатке кислорода.
Недостаток кислорода (гипоксия) возникает в организме при физической работе, при подъеме в горы, опускании под воду, при заболеваниях органов дыхания, сердечно-сосудистой системы и кроветворной системы.
Субстратное окисление энергетически менее выгодно, чем тканевое дыхание, т.к. редокс-потенциалы субстратов отличаются незначительно.
В организме наряду с окислительным фосфорилированием процессом, дающим энергию является субстратное фосфорилирование.
Субстратное фосфорилирование – это процесс образования макроэргических соединений за счет макроэргических связей субстрата.
Важнейшим макроэргическим соединением является АТФ.
Энергия макроэргических связей аккумулируется в ряде соединений: креатинфосфат, 1,3-дифосфоглицерат, ГТФ и др.
Биологическое окисление
Тканевое дыхание Свободное окисление Субстратное окисление
Связано с Энергия
окислительным выделяется
фосфорилированием в виде тепла
Энергия выделяется
в виде АТФ
Фосфорилирование
Окислительное фосфорилирование Субстратное фосфорилирование
связано с мембранами митохондрий не связано с мембранами
митохондрий
| Процесс | Ингибиторы тканевого дыхания | Разобщители тканевого дыхания и окислительного фосфорилирования | Ингибиторы синтеза АТФ |
|
| Аминобарбитал, ротенон, антимизин, цианиды | 2,4-динитрофенол, жирные кислоты, дикумарин и его производные, тироксин | Антибиотики олигомицин, рутамицин |
| Ионофоры: | Валиномицин, грамицидин |
Одно время пытались использовать некоторые разобщающие агенты для борьбы с ожирением за счет понижения эффективности синтеза АТФ. Но эти вещества оказались крайне токсичны, и потому от такого их применения отказались.
Существует еще группа веществ как ионофоры, т.е. переносчики ионов. Это жирорастворимые вещества, способные связывать определенные ионы и переносить их через мембрану. Ионофоры отличаются от разобщителей тем, что ионофоры переносят через мембрану не ионы водорода, а какие-нибудь другие катионы. Например, токсичный антибиотик валиномицин образует жирорастворимый комплекс с ионами К+, легко проходящий через внутреннюю мембрану митохондрий, тогда как в отсутствие валиномицина ионы К+ проникают сквозь нее с трудом. Ионофор грамицидин облегчает проникновение ионов К+ и Na+.
Ионофоры и разобщители подавляют окислительное фосфорилирование, увеличивая проницаемость мембраны для ионов Н+, К+ или Na+.
Окислительное фосфорилирование
Ферменты ЦПЭ фиксированы в митохондриальной мембране и их действие характеризуется не только величиной, но и пространственной направленностью, т.е. действуют векторно.
Проявлением векторности является перенос ионов Н+ с внутренней стороны мембраны (со стороны матрикса) на наружную. С НАДН электроны переходят на ФМН, а протоны освобождаются с внутренней стороны мембраны. Протоны, необходимые для восстановления ФМН, поступают из матрикса. На следующем этапе электроны с ФМН Н2 переходят на убихинон, а протоны – в межмембранное пространство; убихинон получает протоны из матрикса и так далее. ЦПЭ работает как протонный насос, перекачивая ионы Н+ из матрикса на наружную сторону мембраны. В результате по сторонам мембраны возникает разность концентраций протонов и одновременно разность электрических потенциалов со знаком + на наружной повехности.
Электрохимический потенциал заставляет протоны двигаться в обратном направлении – с наружной поверхности внутрь. Движение протонов идет по протонным каналам, где располагается АТФ-аза, катализирующая реакщию:
АДФ + Н3РО4 = АТФ + Н2О
АТФ при участии транслоказы поступает из матрикса на наружную сторону мембраны, а затем в цитозоль.
Гипотеза Митчелла
Согласно этой гипотезе, цепь переноса электронов – насос, перекачивающий ионы Н+. Энергия, высвобождаемая при переносе электронов используется для перемещения ионов Н+ из митохондриального матрикса наружу, что приводит к возникновению электрохимического Н+- градиента сболее высокой концентрацией ионов Н+ в наружной водной фазе. Этот же процесс ведет к появлению трансмембранного электрического потенциала – наружная сторона мембраны оказывается электроположительной. Ионы Н+ из окружающей среды вновь устремляются внутрь, т.е. в митохондриальный матрикс, на этот раз по электрохимическому градиенту. Этот переход ионов Н+ из зоны с более высокой в зону с более низкой их концентрацией сопровождается выделением свободной энергии, за счет которой синтезируется АТФ.
Электрохимический Н+-градиент с более высокой концентрацией Н+ на наружной мембране.
Трансмембранный электрический потенциал – наружная мембрана заряжена положительно, а внутренняя – отрицательно.
Ионы Н+ из окружающей среды по электрическому градиенту идут внутрь митохондрии и этот процесс сопровождается выделением свободной энергии, которая идет на синтез АТФ.
Обмен углеводов.
Обмен углеводов в организме человека складывается из следующих процессов:
1. Расщепление в желудочно-кишечном тракте до моносахаридов поступающих с пищей полисахаридов с пищей полисахаридов и дисахаридов. Всасывание моносахаридов из кишечника в кровь.
2. Синтез и распад гликогена.
3. Анаэробное окисление глюкозы. В тканях существует два основных пути распада глюкозы: анаэробный путь гликолиза, который идет без потребления кислорода, и аэробный путь прямого окисления глюкозы или пентозофосфатный путь.
4. Аэробный метаболизм пирувата, включающий окислительное декарбоксилирование пирувата и превращение ацетил-КоА в ЦТК.
5. Глюкогенез, т.е. образование углеводов из неуглеводных продуктов, таких как пируват, лактат, глицерин, аминокислоты.
Обмен углеводов.
| Обмен углеводов
| |||
| Распад (гликогенолиз) и синтез (гликогенез) гликогена | Гликолиз | Пентозо- фосфатный путь | глюконеогенез |
| Окислительное декарбоксилирование пирувата | |||
| ЦКТ | |||
Значение углеводов в организме:
1. Углеводы – это основной энергетический материал.
2. Углеводы выполняют пластическую функцию. К ним относятся пентозы нуклеотидов и гликопротеинов, гетерополисахариды межклеточного вещества.
3. Углеводы могут превращаться в липиды и некоторые аминокислоты.
Источником углеводов организма служат углеводы пищи – крахмал, сахароза и лактоза. Кроме того, глюкоза, может образовываться в организме из аминокислот, глицерина.
Углеводы пищи в пищеварительном тракте распадаются на мономеры. В переваривании принимают участие гидролазы.
Специфические гидролазы: мальтаза, сахараза, лактаза вырабатываются клетками кишечника и содержатся в кишечном соке.
Продукты полного переваривания углеводов – глюкоза, галактоза и фруктоза – через клетки кишечника поступают в кровь. При всасывании из кишечника в кровь моносахариды проникают через клеточные мембраны путем облегченной диффузии и с помощью активного транспорта. Активный транспорт обеспечивает перенос моносахаридов против градиента концентрации, и поэтому может функционировать тогда, когда концентрация глюкозы или галактозы в кишечнике невелика.
Важнейшие сахара через воротную вену проникают в печень, где идет превращение фру и гал в глю.
Гликолиз.
Гликолиз (от греч. glykys – сладкий, lysis - распад) – один из центральных путей катаболизма глюкозы.
В процессе гликолиза происходит расщепление шестиуглеродной молекулы пирувата. Первые пять этапов составляют подготовительную стадию гликолиза. Продуктом первой стадии гликолиза является глицеральдегид-3-фосфат. Подготовительная стадия гликолиза служит для того, чтобы превратить углеродные цепочки всех метаболизируемых гексоз в один общий продукт – глицеральдегид-3-фосфат.
Вторая стадия гликолиза, состоящая тоже из 5 ферментативных реакций, сопровождается образованием энергии.
Стадии гликолиза.
I. 1. Фосфорилирование глюкозы: реакция протекает необратимо, катализируется гексокиназой и требует затраты АТФ:

Необратимые реакции – это реакции, протекающие в прямом направлении под действием одного фермента, а в обратном под действием другого.
Связывание гексогеназы с гексозой происходит по типу индуцированного соответствия: молекула фермента претерпевает конформационные изменения. Активность гексокиназы ингибируется глю-6-фосфатом.
В печени присутсвует другая форма фермента – глюкокиназа. Глюкокиназа специфична в отношении D-глюкозы. Глюкокиназа печени действует при возрастании концентрации глюкозы, например после приема пищи, богатой углеводами.
Гликолиз включает химические превращения 3 разных типов:
1. Распад углеродного скелета глюкозы с образованием пирувата (путь атомов углерода).
2. Фосфорилирование АДФ высокоэнергетическими фосфорилированными содинениями с образованием АТФ (путь фосфатных групп).
3. Перенос водородных атомов или электронов.
Ферменты, катализикующие гликолиз, локализованы в цитозоле.
Ферменты, катализирующие те этапы окисления углеводов, которые требуют присутствия О2, локализируются в митохондриальных мембранах.
В этих условиях глюкокиназа действует на избыточную глюкозу крови и переводит ее в глюкозо-6-фосфат для отложения в запас в виде гликогена.
В мышечной ткани глюкокиназа отсутствует.
2.Превращение глю-6-ф во фру-6-ф

3. фосфорилирование фру-6-ф во фру-1,6-дф
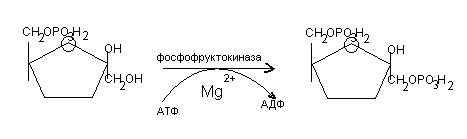
4. Расщепление фру-1,6-дф на триозы:

В дальнейших превращениях принимает участие глицеральдегид-3-ф, который образуется в результате изомеризации дигидроксиацетонфосфата:
Дигидроксиацетонфосфат 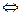 глицеральдегид-3-фосфат
глицеральдегид-3-фосфат
В количественном отношении больше образуется дигидроксиацетонфосфата.
II. На второй стадии гликолиза запасается энергия.
Из одной молекулы глю образуется две молекулы глицеральдегид-3-фосфата, которые участвуют в дальнейших превращениях.
1. Окисление глицеральдегид-3-фосфата до 1,3-фосфоглицероилфосфата: дифосфоглицериновая кислота (гликолитическая оксидоредуктация)
СН2ОРО3Н2 СН2ОРО3Н2
| глицеральдегид- 2 |
СНОН фосфатдегидрогеназа CHOH


 | |
| |
С=О C=O
| 2НАД++Фн 2НАДН+Н+ |
Н OPO3H2
3-ФГА 1,3-фосфоглицератфосфат
Коферментом глицеральдегидфосфатдегидрогеназы является НАД+ . Механизм действия этого фермента очень сложен.
2. Образование 3-фосфоглицерата:

3. Образование 2-фосфоглицерата:

4. Образование фосфоенолпирувата – субстратное фосфорилирование:
 Высокоэнергетическое фосфорилированное соединение фосфоенолпируват.
Высокоэнергетическое фосфорилированное соединение фосфоенолпируват.
5. Образование пирувата:

Дальше процесс идет в зависимости от наличия или отсутствия кислорода в клетке.
При анаэробных условиях, например в напряженно работающих скелетных мышцах. Пируват превращается в лактат:

В этих условиях образовавшийся при гликолизе НАДН регенерируется за счет пирувата, d восстанавливается до лактата.
Электроны, пришедшие сначала от глицеральдегид-3-фосфат к НАД+, переносятся в форме НАДН на пируват. Восстановление НАД катализируется ЛДГ.
С накоплением лактата в скелетных мышцах связано возникновение чувства усталости. ЛДГ представлена 5 различными изоферментами. ЛДГ сердечной мышцы характеризуется низкой Кm для пирувата, а ЛДГ мышечной ткани имеет более высокую величину Кm для пирувата.
Суммарная реакция:
Глю + 2АДФ + 2Фн  2Лак + 2 АТФ
2Лак + 2 АТФ
При анаэробном гликолизе образуется 4 молекулы АТФ, но выделяется только 2 молекулы, т.к. 2 молекулы АТФ затрачиваются в процессе фосфорилирования.
Значение анаэробного гликолиза:
Окисление глю в условиях недостатка кислорода в тканях позволяет получить энергию клеткой при гипоксии, которая может быть вызвана физической нагрузкой, а также нарушениями со стороны сердечно-сосудистой и дыхательной систем. При ИБС наблюдается анаэробный гликолиз, т.к. нарушается при дефиците О2 работа дыхвтельной цепи, а следовательно окисление глю и жирных кислот, которые является главнейшими источниками энергии.
II. При достаточном содержании О2 в клетке глю окисляется до конечных продуктов – СО2, Н2О и этот процесс называется аэробным окислением глю.

Конечным продуктом аэробного гликолиза является пируват, а энергетический баланс складывается из 3 молекул АТФ образовавшихся в результате субстратного фосфорилирования и остается еще 2 молекулы восстановленного НАДН, от концентрации которого зависит активность процесса. Для продолжения процесса необходим сброс Н2 на ферменты дыхательной цепи, но сама молекула НАДН через мембрану митохондрий проникнуть не может, для этого используются переносчики и перенос осуществляется с помощью 2-х механизмов:
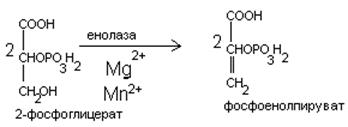
1. Глицерофосфатный челночный механизм;
2. Малатно-аспартатный челночный механизм.
Глицерофосфатный челночный механизм.
| Цитоплазма | Митохондрии | |
  
| 
|
Малатный челночный механизм.
| Цитоплазма | Митохондрии | |
   
| 
|
В процессе гликолиза образуется восстановленная форма НАДН, которая не может непосредственно передавать водород на дыхательную цепь, т.к. митохондриальная мембрана непроницаема для НАДН. Перенос водорода с цитозольного НАДН в митохондрии происходит при участии специальных механизмов, называемых челночными. Суть механизмов сводится к тому, что НАДН в цитозоле восстанавливает какое-то соединение, способное проникать в митохондрию; в митохондрии это соединение окисляется, восстанавливая внутримитохондральный НАД, и вновь переходит в цитозоль.
Баланс аэробного гликолиза:
1. Анаэробный гликолиз – субстратное фосфорилирование – 2АТФ
Глю  2пир
2пир
2. 2Пир  2 СН3СОSKoА – окислительное декарбоксилирование 2 НАДН- 6АТФ
2 СН3СОSKoА – окислительное декарбоксилирование 2 НАДН- 6АТФ
3. Регенерация 2 НАДН в челночном механизме - 6 АТФ
4. ЦТК  2 СН3СОSKoА
2 СН3СОSKoА  СО2 24 АТФ
СО2 24 АТФ
 Н2О
Н2О
38 АТФ
СХЕМА ГЛИКОЛИЗА.

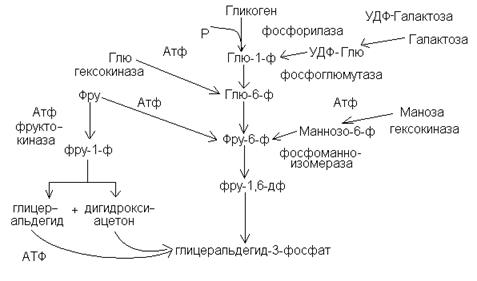
Включение в гликолиз других моносахаридов.
В гликолиз вовлекаются, кроме глюкозы и другие моносахара. Такие как D-фруктоза, манноза и галактоза.
Фруктоза и манноза фосфорилируются с помощью неспецифической гексокиназы с образованием фруктозо-6-фосфата и является метаболитом гликолиза. Маннозо-6-фосфат изомеризуется фосфоманнозоизомеразой во фруктозо-6-фосфат.
Имеется и другой путь включения фруктозы в гликолиз. Фруктоза под действием фруктокиназы печени превращается во фруктозо-1-фосфат, а под действием альдолазы расщепляется на дигидроксиацетонфосфат и глицеральдегид.
Галактоза сначала также фосфорилируется в печени с помощью галактокиназы: D-галактоза + АТФ  галактозо-1-Ф +АДФ Затем галактозо-1-фосфат превращается в глюкозо-1-фосфат. Для этой реакции изомеризации необходимы уридиндифосфат-глюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уридилтрансфераза:
галактозо-1-Ф +АДФ Затем галактозо-1-фосфат превращается в глюкозо-1-фосфат. Для этой реакции изомеризации необходимы уридиндифосфат-глюкоза (УДФ-глюкоза) и фермент галактозо-1-фосфат-уридилтрансфераза:
Галактозо-1-фосфат + УДФ-глюкозо  УДФ-галактоза + глюкозо-1-фосфат
УДФ-галактоза + глюкозо-1-фосфат
Глюкозо-1-фосфат подключается к гликолизу, а УДФ-галактоза превращается в УДФ-глюкозу с помощью УДФ-глюкозо-эпимеразы.
Пентозофосфатный (апотамический) путь окисления глюкозы.
Большая часть глюкозы расщепляется в тканях по гликолитическому пути с образованием пирувата. В свою очередь большая часть пирувата окисляется через цикл лимонной кислоты. Главный смысл расщепления глюкозы в процессе гликолиза заключается в обеспечении клетки энергией в форме АТФ. Наряду с этим существуют, однако, и другие пути катаболизма глюкозы, имеющие специальное назначение. На этих путях вырабатываются особые продукты, в d нуждается клетка.
Пентозофосфатный или фосфоглюконатный путь является источником в организме специальных продуктов:
Значение:
1. НАДФН, d используется как источник восстановительных эквивалентов в процессах биосинтеза жирных кислот, стероидов.
2. Рибозо-5-фосфата (пентозы), d используется для синтеза нуклеиновых кислот.

3. Образование АТФ.
По другому вторичному пути катаболизма глюкозы в животных тканях образуются два специализированных продукта: D-глюконат, важная роль которого связана с обезвреживанием и выведением из организма чужеродных органических веществ, и L-аскорбиновая кислота (витамин С).
Реакции пентозофосфатного пути протекают в цитозоле.
Взаимосвязь пентозного пути и гликолиза.

Обмен гликогена.
Глюкоза как моносахарид свободно диффундирует через мембрану печеночных клеток, она не может служить резервом углеводородов в печени. Так как фосфатные эфиры глюкозы и фруктозы не столь легко проникают через мембраны, фосфорилирование этих сахаров создает как бы ловушку для них, эффективно изолируя реакции гликолиза и фосфоглюконатного пути в пределах внутриклеточного отсека. Тем не менее фосфаты сахаров не могут накапливаться в больших количествах в печени, так как благодаря осмосу увеличение их запасов будет сопровождаться накоплением больших количеств воды.
В печени происходит превращение избытка углеводов в нерастворимый полимер – гликоген. Эта резервная форма глюкозы может составлять одну десятую всей массы печени. При голодании запас гликогена почти полностью истощается.
Обмен гликогена включает в себя 2 процесса: гликогенез или синтез гликогена и гликогенолиз или распад гликогена.
Гликогенез – синтез гликогена – это анаболический процесс, требующий затраты энергии в форме как АТФ, так и уридинтрифосфата (УТФ). Исходным источником для синтеза гликогена является глю, d под действием глюкокиназы превращается в глю-6-фосфат.
Глю-6-ф занимает ключевое положение как общий промежуточный продукт ряда процессов углеводного обмена: он способен к обратимому превращению в пируват путем гликолиза или глюконеогенеза, а также к необратимому – в пентозы в ходе фосфоглюконатного пути. Глю-6-ф может обратимо превращаться в гликоген.
Затем глю-6-ф превращается в глю-1-ф. В процессе активации глю-1-ф участвуют уридиннуклеотиды. В ходе этого процесса два концевых фосфорных остатка УДФ освобождаются в виде неорганического пирофосфата, остаток УМФ соединяется с глю-1-ф, образуя УДФ-глюкозу.
Источником глю при синтезе гликогена является УДФ-глю, d образуется из глюкозо-1-ф и УТФ:
Глю-1-ф + УТФ  УДФ=глю + Н4Р2О7
УДФ=глю + Н4Р2О7
На следующей стадии происходит перенос остатка глю с УДФ-глю на затравку гликогена с помощью гликогенсинтетазы:
УДФ-глю + (глю)n  УДФ +(глю)n+1
УДФ +(глю)n+1
Гликогенсинтетаза катализирует образование только  -1,4-гликозидных связей. «Ветвящий» фермент образует
-1,4-гликозидных связей. «Ветвящий» фермент образует  -1-6 гликозидные S (точки ветвления).
-1-6 гликозидные S (точки ветвления).
Гликогенолиз – распад гликогена идет путем фосфоролиза.
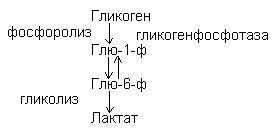
Биосинтез углеводов.
Гликолиз, пентозофосфатный путь, гликгенолиз – это катаболические пути, которые сходятся в цикле лимонной кислоты, чтобы передать свои богатые энергией электроны в дыхательную цепь. Перемещаясь по дыхательной цепи к кислороду, эти электроны поставляют энергию для синтеза АТФ. Теперь нам предстоит рассмотреть анаболические пути. На этих путях химическая энергия в форме АТФ и НАДФН используется для синтеза клеточных компонентов из простых предшественников.
Организационные принципы биосинтеза.
1. Пути биосинтеза и пути расщепления тех или иных биомолекул, как правило, не идентичны. Эти пути могут включать какую-нибудь общую обратимую реакцию или даже несколько таких реакций, но у них всегда имеется хотя бы одна ферментативная стадия, по которым они различаются.
2. Биосинтетические пути и соответствующие им катаболические пути контролируется разными регуляторными ферментами. Обычно регуляция соответствующих биосинтетических и катаболитических путей осуществляется координированным образом, реципрокно, так что стимулирование биосинтетического пути сопровождается подавлением катаболитического пути и наоборот. Кроме того, биосинтетические пути регулируются обычно на одном из первых этапов. Это избавляет клетку от непроизводительных трат: она не расходует предшественники на синтез тех промежуточных продуктов, которые ей не понадобятся.
3. Требующие затраты энергии биосинтетические процессы обязательно сопряжены с поставляющем энергию расщеплением АТФ, вследствие чего весь процесс в целом является практически необратимым, точно также как в целом необратим катаболизм. Таким образом, общее количество АТФ (или НАДН), используемое на данном биосинтетическом пути, всегда превосходит то минимальное количество свободной энергии, которое требуется для превращения предшественника в биосинтетический продукт.
Центральным биосинтетическим путем является образование глюкозы из неуглеводных предшественников. У всех высших животных и человека биосинтез глюкозы абсолютно необходимый процесс. Глюкоза крови служит единственным или главным источником энергии для нервной системы (в том числе и для мозга), а также для почек, семенников, эритроцитов и для всех тканей эмбриона. У человека один только мозг потребляет 120 г глюкозы в сутки.
Образование глюкозы из неуглеводных предшественников называется глюконеогенезом (образование нового сахара).
В процессе глюконеогенеза глюкоза синтезируется из лактата, пирувата, глицерола, и большинства аминокислот, из промежуточных продуктов цикла лимонной кислоты.
Глюконеогенез протекает в печени и значительно менее интенсивно – корковом веществе почек.
При гликолизе глю превращается в пируват, при глюконеогенезе пируват превращается в глюкозу. Глюконеогенез это не обращение гликолиза, т.к. в гликолизе есть 3 необратимые стадии, катализируемые гексокиназой, фосфофруктокиназой и пируваткиназой.
Пути глюконеогенеза обходят эти 3 необратимые реакции гликолиза при помощи следующих новых этапов:
1. Фосфоенолпируват ббразуется из пирувата через оксалоацетат.
Первый этап в обходной последовательности реакций катализируется митохондриальной пируваткарбоксилазой. Этот биотинзависимый фермент катализирует образование оксалоацетата из пирувата:
Пируват + СО2+АТФ  оксалоацетат+АДФ+Рн
оксалоацетат+АДФ+Рн
Пируваткарбоксилаза – регуляторный фермент; в отсутствии ацетил-КоА который служит для нее положительным регулятором, она почти полностью лишена активности.
Оксалоацетат, образующийся в митохондриях из пирувата обратомо восстанавливается за счет НАДН с образованием малата:
Митох. НАДН+Н+ + Оксалоацетат  НАД+малат
НАД+малат
Малат из митохондрий поступает в цитозоль. В цитозоле малат под действием цитозольной НАД-зависимой малатдегидрогеназы превращается в оксалоацетат:
Цитозоль Малат + НАД+  Оксалоацетат+ НАДН+Н+
Оксалоацетат+ НАДН+Н+
Дальше оксалоацетат под действием фосфоенолпируваткарбоксикиназы превращается в фосфоенолпируват:
Оксолоацетат+ГТФ  ФЭП+СО2 +ГДФ
ФЭП+СО2 +ГДФ
Донором фосфата в этой реакции служит ГТФ – гуанозинтрифосфат.
2. Вторая реакция гликолиза, которая не может использоваться для глюконеогенеза – это реакция фосфорилирования фру-6-ф, катализируемая фосфофруктокиназой.
В глюконеогенезе действует обходной путь с участием фруктозодифасфатазы, которая катализирует необратимый гидролиз фру-1,6-дф с образованием фру-6-ф
Фру-1,6-дф  фру-6-ф
фру-6-ф
Фруктозодифосфотаза – регуляторный фермент, нуждается в ионах Mg2+ . Ингибируется АМФ, активируется АТФ.
3. Третьей обходной реакции в синтезе глюкозы является дефосфорилирование глю-6-ф с образованием глю.
Дефосфорилирование осуществляется под действием глюкозы-6-фосфатазы:
Глю-6-ф  глю
глю
Глюконеогенез требует значительных затрат энергии. Стадии глюконеогенеза, требующие затрат энергии:
Пир + СО2 + АТФ  оксалоацетат + АДФ + Фн
оксалоацетат + АДФ + Фн
Оксалоацетат + ГТФ  ФЕП + СО2 + ГДФ
ФЕП + СО2 + ГДФ
3ФГК  1,3ФГК
1,3ФГК
На каждую молекулу глю потребуется 6 высокоэнергетических фосфатных групп – 4 от АТФ и 2 от ГТФ.
Кроме того, для восстановительных этапов требуется 2 молекулы НАДН:
1,3 ДФГК + НАДН + Н+  3ФГА + НАД+
3ФГА + НАД+
Суммарная реакция:
2Пир + 4 АТФ + 2 ГТФ + 2 НАДН + 2 Н+ + 4 Н2О  Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн
Глю + 2 НАД+ + 4 АДФ + 2 ГДФ + 6 Рн
Главную роль из метаболитов ЦТК, используемых в глюконеогенезе играют: цитрат, изоцитрат,  -кетоглутарат, сукцинат, фумарат, малат.
-кетоглутарат, сукцинат, фумарат, малат.
Важно отметить, что в норме ацетил-КоА не используется как предшественник глю, так как он не может превратиться в пируват.
В глюкозу могут превращаться глюкогенные аминокислоты: аланин, глутамат, аспартат, которые превращаются соответственно в пируват, оксалоацетат и  -кетоглутарат:
-кетоглутарат:
Глукогенные аминокислоты
Превращаются в пир: ала, сер, цис, гли
Превращаются в оксалоацетат: асп, асн
Превращаются в сукцинил-КоА: вал, тре, мет
Превращаются в  -кетоглутарат: глу, глн, про, арг, гис.
-кетоглутарат: глу, глн, про, арг, гис.
Поставляют атомы углерода для синтеза глю и кетоновых тел: фен,тир, изолей, лиз, три
Синтез глю из малых молекул предшественников идет в период после восстановления после мышечной нагрузки, например после бега на сто метров. В этом случая в качестве источника энергии служит гли, который окисляется с образованием лак и выделением АТФ. Т.к. кислорода в тканях не хватает, лактат не может подвергаться дальнейшим превращениям и поступает в кровь.
Закончивший стометровку спринтер в начале дышит тяжело, но постепенно его дыхание выравнивается и становится нормальным. К этому периоду возвращается к норме и содержание лак. За время восстановления (до 30 мин) лактат удаляется из крови в печень и превращается в процессе гликонеогенеза в глю крови. Глю крови возвращается в мышцы:

Алкоголь тормозит глюконеогенез.
Потребление больших количеств алкоголя резко тормозит глюконеогенез в печени, вследствие чего понижается содержание глю в крови, т.е. возникает гипогликемия. Это особенно сказывается после тяжелой физической нагрузки и на голодный желудок, уровень глю может понизиться до 40 и даже 30% от нормы. Гипергликемия не благоприятно сказывается на функции мозга. Она особенно опасна для тех областей мозга, которые контролируют температуру тела. Температура тела может понизиься на 20С. Старый обычай, предписывающий давать спасенным на море или в пустыне голодным или обессилившим людям водку, физиологически неоправдан и даже опасен; в таких случаях следует давать глю.
Окислительное декарбоксилирование пирувата.
Протекает в митохондриальном матриксе и связывает гликолиз с циклом трикарбоновых кислот.
Превращение пирувата в ацетил-КоА является необратимым процессом и катализируется пируватдегидрогеназным комплексом. Пируватдегидрогеназный комплекс состоит из трех ферментов и содержит пять коферментов: НАД, ФАД, ТПФ, амид липоевой кислоты, СоА. Этот процесс включает 4 реакции, суммарное уравнение записывается так:

Цикл трикарбоновых кислот.
Цикл начинается с конденсации оксалоацетата (ЩУК) с ацетил –КоА с образованием цитрата и КоА. Реакция катализируется цитратсинтетазой. Далее цитрат изомеризуется в изоцитрат, через стадию образования цис-аконитата. Изоцитрат под действием изоцитратдегидногеназы превращается в  -кетоглуторат (2-оксоглутарат). Коферментом изоцитратдегидрогеназы является НАД. Дальше
-кетоглуторат (2-оксоглутарат). Коферментом изоцитратдегидрогеназы является НАД. Дальше  -кетоглутарат под действием
-кетоглутарат под действием  -кетоглутаратдегидрогеназного комплекса, содержащего НАД, ФАД, КоА, ТПФ и амид липоевой кислоты в качестве коферментов, превращается в сукцинил-КоА. На этом этапе происходит окислительное декарбоксилирование. В сукцинил-КоА имеется связь богатая энергией. При гидролизе сукцинил-КоА образуется около 8 ккал/моль, что сравнимо с величиной энергии, необходимой для синтеза АТФ (~7,3 ккал/моль).
-кетоглутаратдегидрогеназного комплекса, содержащего НАД, ФАД, КоА, ТПФ и амид липоевой кислоты в качестве коферментов, превращается в сукцинил-КоА. На этом этапе происходит окислительное декарбоксилирование. В сукцинил-КоА имеется связь богатая энергией. При гидролизе сукцинил-КоА образуется около 8 ккал/моль, что сравнимо с величиной энергии, необходимой для синтеза АТФ (~7,3 ккал/моль).
Расщепление тиоэфирной связи сукцинил-КоА сопряжено с фосфорилированием гуанозиндифосфата (ГДФ). Это реакция субстратного фосфорилирования, дающая 1моль АТФ. Это единственная реакция ЦТК, приводящая к образованию высокоэнергетической фосфатной связи. С циклом Кребса сопряжено окислительное фосфорилирование, где образование АТФ сопряжено с окислением НАД или ФАД под действием кислорода.
Затем сукцинат под действием сукцинатдегидрогеназы, содержащей ФАД в качестве кофермента превращается в фумарат. На следующей стадии фумарат подвергается реакции гидратации с образованием малата (яблочной кислоты). Малат под действием НАД-зависимой малатдегидрогеназы превращается в оксалоацетат. Следовательно, в цикле происходит регенерация оксалоацетата, что обеспечивает функционирование ЦТК.
3 НАДН и ФАДН2, образующиеся в цикле трикабоновых кислот, окисляются в дыхательной цепи (или в цепи переноса электронов). Генерирование АТФ происходит при транспорте электронов от этих переносчиков на О2. На каждую молекулу НАДН в митохондриях образуется 3 АТФ, а на молекулу ФАДН2 – 2 молекулы АТФ. Следовательно, в процессе окислительного фосфорилирования образуется 11 АТФ.
Молекулярный кислород непосредственно не участвует в цикле трикарбоновых кислот. Однако цикл функционирует лишь в аэробных условиях поскольку НАД+ и ФАД в митохондрии могут генерироваться только при переносе электронов на молекулярный кислород.
Значение ЦТК
1. * Цикл Кребса – основной путь расщепления обеспечивающий генерирование АТФ.
2. Амфиболическая – двойственная функция.
Катаболическая – распад ацетильных остатков
Анаболическая – субстраты цикла Кребса используются для синтеза.
3. Энергетическая функция – 1 АТФ
4. Водороддонорная функция – регенератор водорода для дыхательной цепи.
* Интегративная функция – объединение обмена углеводов, липидов и белков.


Патология обмена углеводов.
Нарушения обмена глюкозы проявляются в виде гипергликемии, глюкозурии и гипогликемии. Особую форму представляют нарушениями энергетического обмена при гипоксических состояниях.
Гипергликемия характеризуется повышением уровня глюкозы свыше 6 ммоль/л. Различают физиологические и патологические гипергликемии. К физиологическим гипергликемиям относятся алиментарные, возникающие при одномоментном приеме больших количеств углеводов, и нейтрогенные, например, при стрессовых ситуациях в результате выброса в кровь больших количеств адреналина. Физиологические гипергликемии носят транзиторный характер и быстро проходят.
Патологические гипергликемии обусловлены нарушением оптимального соотношения между секрецией гормонов гипо- и гипергликемического действия. Наиболее распространенное причина патологической гипергликемии – сахарный диабет, связанный с недостатком секреции инсулина поджелудочной железой. Кроме сахарного диабета гипергликемия сопутствует также заболеваниям гипофиза, сопровождающимся повышенной секрецией соматотропного гормона и АКТГ (акромегалия, опухоли гипофиза), опухолями мозгового слоя надпочечников, при которых усилено образование катехоламинов и коркового слоя надпочечников с усиленной продукцией глюкокортикоидов, гиперфункции щитовидной железы, некоторым болезням печени (инфекционный гепатит, цирроз печени).
Сахарный диабет – связан с недостаточностью инсулина, вырабатываемого  -клетками поджелудочной железы. Развитию сахарного диабета способствует избыточное потребление углеводов и жиров, малоподвижный образ жизни, стрессовые ситуации.
-клетками поджелудочной железы. Развитию сахарного диабета способствует избыточное потребление углеводов и жиров, малоподвижный образ жизни, стрессовые ситуации.
В основе сахарного диабета лежат следующие молекулярные дефекты:
1. Нарушение превращения проинсулина в инсулин в результате мутаций, затрагивающих аминокислотные остатки в участке соединения А-цепи (или В-цепи) с С-пептидом в проинсулине. У таких больных в крови высокое содержание проинсулина, лишенного гормональной активности.
2. Нарушение молекулярной структуры инсулина. Замена фен на лей сопровождается снижением гормональной активности в 10 раз.
3. Дефект рецепторов инсулина. У ряда больных секретируется нормальный инсулин, но нарушено его связывание с клетками-мишенями в результате дефекта рецепторов инсулина в плазматических мембранах.
4. Нарушение сопряжения рецепторов инсулина. У ряда больных секретируется нормальный инсулин, клетки-мишени содержат обычное количество рецепторов, но отсутствует сопряжение между инсулин-рецепторным комплексом и следующим компонентом в цепи передачи гормонального сигнала.
Важнейшими биохимическими признаками сахарного диабета являются:
1. Гипергликемия. В результате недостатка инсулина нарушается проникновение глюкозы в ткани и глюкоза накапливается в крови. В ответ на дефицит глюкозы в клетках печени усиливается распад гликогена и выход свободной глюкозы в кровь, что усугубляет гипергликемию. Возникает возможность развитие гипергликемической комы.
2. Глюкозурия и полиурия. Когда содержание глюкозы в крови превышает способность почечных канальцев к реабсорбции глюкозы она выделяется с мочой. Вместе с глюкозой выделяется много воды и больной испытывает голод и жажду.
3. Кетонемия и кетоурия. Вследствие дефицита глюкозы в тканях клетки начинают использовать в качестве энергии жиры. При  -окислении жирных кислот образуется Ацетил-КоА, который не сгорает с ЦТК полностью и из него синтезируются кетоновые тела: ацетоуксустная,
-окислении жирных кислот образуется Ацетил-КоА, который не сгорает с ЦТК полностью и из него синтезируются кетоновые тела: ацетоуксустная,  -оксимасляная кислоты и ацетон. Увеличение концентрации кетоновых тел в крови – кетонемия и выведение кетоновых тел с мочой – кетонурия.
-оксимасляная кислоты и ацетон. Увеличение концентрации кетоновых тел в крови – кетонемия и выведение кетоновых тел с мочой – кетонурия.
4. Нарушение кислотно-щелочного равновесия с развитием кетоацидоза.
Кетоновые тела сдвигают рН крови и тканевой жидкости в кислую сторону. Вначале буферные системы компенсируют сдвиг рН – компенсированный ацидоз. При тяжелых состояниях может возникнуть некомпенсированный ацидоз.
Методы диагностики сахарного диабета.
1. Определение глюкозы крови натощак.
2. Метод сахарной нагрузки (тест толерантности к глюкозе).
3. Диагностика неотложных состояний – определение глюкозы и ацетона в моче с помощью диагностических бумажных полосок – глюкотест и кетотест.
Метод сахарной нагрузки.
У больного берут кровь натощак, затем дают выпить сироп, содержащий 50г глюкозы в 200-250 мл воды. Далее через 30, 60, 150’ берут кровь и проводят определение глюкозы. У здорового человека (1) исходное содержание сахара в крови нормальное (< 5ммоль/л). После приема глюкозы в течении часа содержание глюкозы умеренно возрастает. В ответ на гипергликемию усиливается секреция инсулина, глюкоза переходит в ткани и ее содержание через 3 часа снижается до N и даже ниже.
У больного скрытым сахарным диабетом (2) содержание глюкозы на верхней границе нормы (5,7 ммоль/л). После нагрузки подъем сахара в крови более выражен и к 3 часу не достигает N из-за недостатка инсулина.
У больного явным сахарным диабетом (3) натощак определяется гипергликемия (9 ммоль/л). К 1 часу уровень глю достигает 15 ммоль/л и к 3 часу снижение незначительное, вследствие инсулинной недостаточности. Клинические симптомы: повышенный аппетит, чувство жажды, которое сопровождается полиурией. Поздние симптомы: мышечная слабость, судороги при физических нагрузках, полиневриты – т.к. нарушается использование глюкозы нервными клетками.
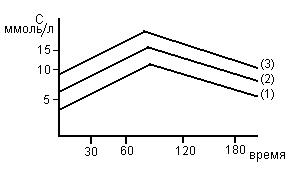
Особенности обмена глюкозы в клетках опухали.
В клетках опухоли отмечается повышенная активность гексокиназы, что приводит к быстрому поглощению и окислению глюкозы. Опухолевая клетка является насосом, который выкачивает глюкозу из кровотока. В условиях быстро растущей опухоли система кровеносных сосудов отстает от роста опухоли и в таких клетках протекает анаэробный гликолиз, который и дает энергию для роста клеток. Выход энергии при анаэробном гликолизе составляет 2 моль АТФ и поэтому процесс должен идти с большой скоростью, чтобы обеспечить клетки опухоли энергией. Вследствие быстрого окисления глюкозы возникает гипогликемия. Возникновение гипогликемии вызывает ускорение глюконеогенеза и глюкоза начинает синтезироваться из аминокислот. Следствием синтеза глюкозы из аминокислот является падение веса у больных и развивается раковая кахексия.
1. Мембранная гексокиназа – работает как насос.
2. Гипогликемия.
3. Анаэробный гликолиз.
4. «Принудительный» глюконеогенез.
5. Раковая кахексия.
Гликогенозы.
Гликогенозы – наследственные заболевания, характеризующиеся избыточным отложением гликогена.
| Виды гликогенозов
| |
| Печеночные | Мышечные |
|
Смешанные | |
Гликогеноз I типа (болезнь Гирке) характеризуется дефектом фермента глюкозо-6-фосфатазы.
Признаки гликогеноза: низкий уровень глюкозы натощак в крови, в тяжелых случаях судороги, замедление роста в результате подавления выработки инсулина. Накопление гликогена из-за большого количества глюкозо-6-фосфата и активации гликогенсинтетазы. Увеличение печени, гибель гепатоцитов, низкий рост, ацидоз (лактат, пирват).
Гликогеноз VI типа (болезнь Херса).
Дефект фосфорилазы. Накопление гликогена, характерны симптомы I типа, но менее выражены (глюкоза в кровь поступает).
Мышечные гликогенозы
Гликогеноз V типа – дефект или отсутствие фосфорилазы в мышцах. Мышечные судороги при физической нагрузке, мышечноя слабость, отсутствие гипогликемии. Синтез АТФ увеличивается за счет окисления жирных кислот.
Гликогеноз VII типа – дефект только фосфофруктосинтетазы. Переносят только умеренные физические нагрузки. Развивается гемолитическая анемия.
Гликогеноз III типа (болезнь Кори) – дефект или отсутствие гликоген-6-глбконогидролазы. Увеличение содержания гликогена в печени. Гликоген состоит из коротких цепей.
Гликогеноз IV (болезнь Андерсона) – недостаток «ветвящего» фермента. Накопление гликогена с аномально длинными цепями. Развивается цирроз печени.
Агликогеноз – дефект гликогенсинтетазы. Отсутствие гликогена или его очень мало, судороги, гипогликемия.
Гемолитические анемии.
Гликолиз в эритроцитах и транспорт кислорода связаны участием в обеих процессах 2,3-дифосфоглицерата. 2,3-дифосфоглицерат снижает сродство гемоглобина к кислороду и облегчает освобождение О2 в тканях.
1. При дефекте гексокиназы снижается концентрация промежуточных продуктов гликолиза, в том числе снижается концентрация 2,3-дифосфоглицерата. В таких эритроцитах гемоглобин обладает очень высоким сродством с О2. Наступает гемолиз эритроцитов, когда гемоглобин плохо обдает О2.
2. При дефекте пируваткиназы нарушается энергетический обмен и мембрана не получает энергию, необходимую для ионного обмена и наряду с этим образуется избыток 2,3-дифосфоглицерата и связь с О2 становится слабой, сродство гемоглобина к О2 становится низким.
Глю  Глю-6-ф
Глю-6-ф  Фру-6-ф
Фру-6-ф  Фру-1,6-дф
Фру-1,6-дф  3ФГА
3ФГА 

 1,3-ДФГК
1,3-ДФГК  3-ФГК
3-ФГК  2-ФГК
2-ФГК  ФЭП
ФЭП  Пир
Пир  Лак
Лак
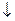
2,3-ДФГК
2,3-ДФГК снижает сродство Hb к О2
Недостаточность глюкозо-6-фосфотдегидрогеназы – причина лекарственной гемолитической анемии.
У ряда больных малярией применение противомалярийного препарата памахина сопровождается гемолитической анемией. Через 30 лет после начала применения препарата была выяснена причина анемии. Было установлено, что возникновение анемии связано с недостаточностью глюкозо-6-фосфатдегидрогеназы в эритроцитах. В результате недостаточности фермента нарушается образование НАДФН в пентозофосфатном пути. Главная роль НАДФН в эритроцитах состоит в восстановлении дисульфидной формы глутатиона в сульфгидрильную форму.
Г-S-S-Г + НАДФН + Н+  Г-SH +НАДФ+
Г-SH +НАДФ+
Восстановленная форма глутатиона обеспечивает обезвреживание перекиси и органических перекисей:
2 Г-SH + R-O-OH  Г-S-S-Г + Н2О + ROH
Г-S-S-Г + Н2О + ROH
Клетки со сниженным содержанием восстановленного глутатиона обладают повышенной чувствительностью к гемолизу. Возможно, что в отсутствие восстановленного глутатиона памахин и ряд других лекарственных препаратов, вызывают изменения поверхности мембраны эритроцитов за счет образования токсических перекисей.
Недостаточность глюкозо-6-фосфатдегидрогеназы в эритроцитах, по-видимому, обуславливает устойчивость к тропической малярии, т.к. для роста возбудителя необходим нормально функционирующий пентозный путь и восстановленный глутатион. Дефект фермента распространен в тех странах, где распространена малярия. Такая наследуемая недостаточность фермента может быть относительно безвредной, до тех пор, пока не вводятся определенные лекарства.
Особенности обмена углеводов в различных органах и тканях.
1. Обмен углеводов в печени.
Одной из важнейших функций печени в процессах обмена веществ является ее участие в поддержании постоянного уровня глюкозы в крови (глюкостатическая функция): глюкоза, поступающая в избытке, превращается в резервную форму, которая используется в период, когда пища поступает в ограниченном количестве.
Энергетические потребности самой печени, как и других тканей организма, удовлетворяется за счет внутриклеточного катаболизма поступающей глюкозы. В печени катаболизм глюкозы представлен 2 процессами: 1) гликолитический путь превращения 1 моль глюкозы в 2 моль лактата с образованием 2 моль АТФ и 2) фосфоглюконатный путь превращения 1 моль глюкозы в 6 моль СО2 с образованием 12 моль НАДФ.Н. Оба процесса протекают в анаэробных условиях, обе ферментативные системы содержатся в растворимой части цитоплазмы, оба пути требуют предварительного фосфорилирования глюкозы.
Гликолиз обеспечивает энергией клеточные реакции фосфорилирования, синтез белка; пентозофосфатный путь служит источником энергии восстановления для синтеза жирных кислот, стероидов.
При аэробных условиях происходит сочетание гликолиза, протекающего в цитоплазме и цикла лимонной кислоты с окислительным фосфорилированием в митохондриях достигается максимальноый выход энергии в 38 АТФ на 1 моль глюкозы. Фосфотриозы, образующиеся в процессе гликолиза, могут быть использованы для синтеза  -глицерофосфата, необходимого для синтеза жиров. Пируват, который образуется при гликолизе, может быть использован для синтеза аланина, аспартата и других соединений, через стадию образования оксалоацетата. В печени реакции гликолиза могут протекать в обратном направлении и тогда происходит синтез глюкозы путем глюконеогенеза. В пентозофосфотном пути образуются пентозы, необходимые для синтеза НК. В отличие от гликолиза фосфоглюконатный путь необратим и здесь окисляется 1/3 глюкозы, 2/3 глюкозы окисляются по гликолитическому пути.
-глицерофосфата, необходимого для синтеза жиров. Пируват, который образуется при гликолизе, может быть использован для синтеза аланина, аспартата и других соединений, через стадию образования оксалоацетата. В печени реакции гликолиза могут протекать в обратном направлении и тогда происходит синтез глюкозы путем глюконеогенеза. В пентозофосфотном пути образуются пентозы, необходимые для синтеза НК. В отличие от гликолиза фосфоглюконатный путь необратим и здесь окисляется 1/3 глюкозы, 2/3 глюкозы окисляются по гликолитическому пути.
В печени протекают гликогенез и гликогенолиз. Эти процессы взаимосвязаны и регулируются как внутри – так и внеклеточными соотношениями между поступлением и потреблением глюкозы.


Роль печени в обмене углеводов.
От ЖКТ
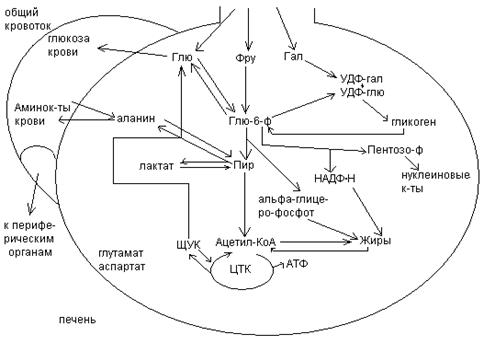
Обмен углеводов в мышцах.
Печень учитывает запросы других органов и тканей в отношении углеводного обмена. В мышцах углеводный обмен происходит в соответствии с принципом самообслуживания.
Цель мышечной клетки – наиболее эффективно использовать поступающую глюкозу для образования АТФ, необходимого для осуществления механической работы – сокращения. В состоянии покоя значительные количества глюкозы резервируются в форме гликогена. Цитоплазма мышечных клеток содержит в высоких концентрациях ферменты гликолиза, а изобилие митохондрий обеспечивает эффективный распад продуктов гликолиза через путь лимонной кислоты и цепь переноса электронов. Лишь в условиях крайнего утомления эти аэробные процессы е справляются с накоплением лактата.
В мышцах идет гликогенез, мышца осуществляет лишь немногие синтетические функции. Ключевые ферменты глюконеогенеза в мышцах отсутствуют, и глюконеогенез не идет. Для востановительных синтезов в мышце НАДФ.Н не требуется, и фосфоглюконатный путь почти не функционирует.
Обмен углеводов в мышцах обеспечивает создание тканевых запасов гликогена в состоянии покоя и использование этих запасов, а также поступающей глюкозы при напряженной работе; основные энергетические потребности всех типов мышц удовлетворяются главным образом за счет окисления продуктов обмена жиров. Ни медленно сокращающаяся гладкая мышечная ткань, ни сердечная мышца не потребляют глюкозу в значительной мере. Во время напряженной работы сердце обеспечивает себя лактатом для окисления.
Обмен углеводов в мышце.
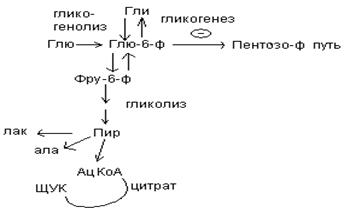
Фосфорилирование глюкозы в мышцах происходит под дейстием гексокиназы, в печени этот процесс катализируется глюкокиназой. Эти ферменты отличаются по Кm. Кm гексокиназы значительно ниже Кm глюкокиназы. Фермент мышц – гексокиназа участвует во внутриклеточной регуляции, т.е. этот фермент будет фосфорилировать глюкозу только до тех пор, пока глюкозо-6-ф используется в мышцах для гликолиза или образования гликогена.
Другое важнейшее различие между тканью печени и мышцы состоит в отсутствии в мышцах фермента глюкозо-6-фасфатазы.

Обмен углеводов в мозге.
По сравнению со всеми органами тела функций мозга в наибольшей степени зависит от обмена углеводов. Если в крови, поступающей к мозгу, концентрация глюкозы становится вдвое ниже нормальной, то в течение нескольких секунд наступает потеря сознания, а через несколько минут – смерть. Для того чтобы обеспечить освобождение достаточного количества энергии, катаболизм глюкозы должен осуществляться в соответствии с аэробными механизмами; об этом свидетельствует даже более высокая чувствительность мозга к гипоксии, чем гипогликемии. Метаболизм глюкозы в мозге обеспечивает синтез нейромедиаторов, аминокислот, липидов, компонентов нуклеиновых кислот. Фосфоглюконатный путь функционирует в небольшой мере, обеспечивая НАДФ.Н для некоторых из этих синтезов. Основной катаболизм глюкозы в ткани мозга протекает по гликолитическому пути.
Гексокиназа мозга имеет высокое сродство к глюкозе, что обеспечивает эффективное использование глюкозы мозгом. Активность ферментов гликолиза велика.
Высокая активность митохондриальных ферментов цикла лимонной кислоты предотвращает накопление лактата в тканях мозга; большая часть пирувата окисляется до Ац-КоА. Небольшая часть Ац-КоА используется для образования нейромедиатора ацетилхолина. Основное количество Ац-КоА подвергается окислению в цикле лимонной кислоты и дает энергию. Метаболизм цикла Кребса используется для синтеза аспартата и глутамата. Эти аминокислоты обеспечивают обезвреживание аммиака в тканях мозга.
Мозг содержит мало гликогена (0,1% от общего веса); этот запас расходуется очень быстро.
Обмен углеводов в ткани мозга.
в условиях длительного голодания мозг использует как источник энергии кетоновые тела. В крайних случаях такие аминокислоты как глутамат и аспартат превращаются в соответствующие кетокислоты, которые способны к окислению с образованием энергии.

Обмен углеводов в эритроцитах.
Эритроциты не содержат ядра, митохондрий. В эритроците не идут реакции цикла лимонной кислоты, в них нет ферментов дыхательной цепи. Парадоксальным является тот факт, что эритроцит, перенося кислород для тканей, сам его не использует и получает энергию за счет аэробных процессов.
Основным процессом в эритроцитах, который дает энергию, является анаэробный гликолиз. При расщеплении фру-6-фф образуется НАДН, необходимый для восстановления избытка метгемоглобина (окисленной формы гемоглобина, не связывающей О2).
Побочным продуктом гликолиза в эритроцитах является 2,3-дифосфоглицерат. 2,3-дифосфоглицерат связывается с гемоглобином, уменьшает его сродство к О2 и, облегчает освобождение кислорода в тканях.
Фосфоглюконатный путь в норме составляет лишь небольшую долю в катаболизме глюкозы. В условиях повышенной потребности в НАДФ.Н этот процесс активизируется. НАДФ.Н необходим для того, чтобы поддерживать внутриклеточный восстановитель, глутатион, в его восстановленной SH-форме. Воздействие агентов, ускоряющих окисление глутатиона в S-S-форму, активирует реакции пентофосфотного пути, которые обеспечивают образование восстановленных эквивалентов в форме НАДФ.Н.
Обмен углеводов в эритроцитах.

Регуляция обмена углеводов.
Соотношение между процессами катаболизма и анаболизма глюкозы в клетках печени находятся под контролем целого ряда факторов регуляции:
1. Концентрация метаболитов и глюкозы.
2. Воздействие гормонов.
Внутриклеточные рецепторы.
Субстраты и промежуточные продукты метаболических реакций играют важную роль в регуляции соотношения между гликолизом и глюконеогенезом.
Рассмотрим, как регулируется само вступление остатков глюкозы на путь гликолиза. Вовлечение глюкозных остатков в процесс гликолиза обеспечивает важная реакция и эта реакция контролируется регуляторным ферментом. Реакция катализируется гексокиназой и активность этого фермента ингибируется глюкозо-6-фосфатом. Когда концентрация глюкозо-6-фосфата в клетке сильно возрастает, т.е. когда он образуется быстрее, чем потребляется, наступает ингибирование – гексокиназа под действием глюкозо-6-фосфата выключается и дальнейшего фосфорилирования глюкозы не происходит до тех пор, пока избыток глюкозо-6-фосфата не будет использован.

 Глю
Глю  Глю-6-ф
Глю-6-ф
 В печени преобладает другой фермент – глюкокиназа, которая не ингибируется глюкозо-6-фосфатом. Поэтому в печени, способной хранить большие количества гликогена, избыточная глюкоза крови может фосфорилироваться в глюкозо-6-фосфат, который через глюкозо-1-фосфат превращается в гликоген.
В печени преобладает другой фермент – глюкокиназа, которая не ингибируется глюкозо-6-фосфатом. Поэтому в печени, способной хранить большие количества гликогена, избыточная глюкоза крови может фосфорилироваться в глюкозо-6-фосфат, который через глюкозо-1-фосфат превращается в гликоген.
Кроме гексокиназной реакции в гликолизе имеются еще два главных регулируемых этапа: это фосфофруктокиназная и пируваткиназная реакция.
В скелетных мышцах активность фосфофруктокиназы определяется концентрациями субстратов этого фермента (АТФ и фруктозо-6-фосфата) и его продуктов (АДФ и фруктозо-1,6-дифосфата), а также цитрат.
Главными отрицательными модуляторами фосфофруктокиназой являются АТФ и цитрат.
Главными положительными модуляторами являются АМФ и фруктозо-1,6-дифосфат.
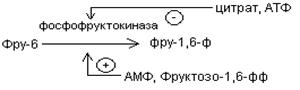
Третьим регулируемым этапом гликолиза является пируваткиназная реакция.

Активность пируваткиназы ингибируется АТФ и ацетил-КоА, а также жирные кислоты.
| Реакция | Фермент | Ингибитор | Активатор |
| Глю | Глю-6-ф | ||
| Фру-6-ф | АТФ, цитрат, ацил-КоА, кетоновые тела, НАДН+Н+ | Фру-1,6-дф, АДФ, НАД | |
| ФЕП | АТФ, ацетил-КоА, жирные к-ты, аланин | АДФ, Фн, НАД, фру-1,6-дф | |
| Пир | Ацил-КоА, Ацетил-КоА, Аланин | ||
| ЩУК | Ацил-КоА, Ацетил-КоА, Аланин | ||
Регуляция гликолиза.
Три стадии катаболизма углеводов обеспечивают получение энергии: гликолиз, цикл лимонной кислоты и окислительное фосфорилирование.
При уменьшении содержания АТФ и Рн, это приводит к возрастанию скорости переноса электронов и окислительного фосфорилирования. Одновременно повышается скорость окисления пирувата через цикл лимонной кислоты, т.е. усиливается приток электронов в дыхательную цепь. Это приводит к увеличению скорости гликолиза, тем самым обеспечивается образование пирувата. Затем наступает момент, когда отношение АТФ/АДФ+Рн возвращается к обычному высокому уровню. Теперь перенос электронов и окислительное фосфорилирование замедляются. Цикл лимонной кислоты замедляется, т.к. АТФ и цитрат являются ингибитором фосфофруктокиназы и пируваткиназы.
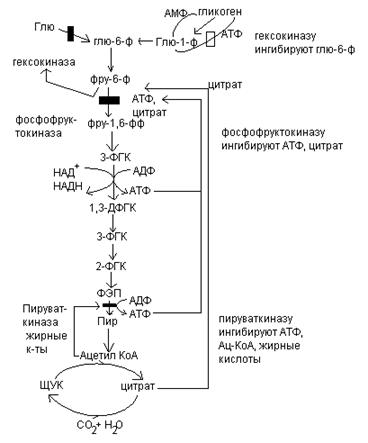
Регуляция пируватдегидрогеназного комплекса.
Превращение пирувата в Ацетил-КоА происходит при участии пируватдегидрогеназного комплекса, содержащего 5 коферментов: НАД, ФАД, НSКоА, ТДФ, липоевую кислоту. В основе процесса лежит реакция окислительного декарбоксилированя.
Образование ацетил-КоА из пирувата – это ключевой необратимый этап метаболизма, потому что животные неспособны к превращению ацетил-КоА в глюкозу.
Окислительной декарбоксилирование пирувата в ацетил-КоА создает возможность превращения атомов глюкозы по 2 путям: 1) окисление до СО2 в ЦТК с одновременным регенерированием энергии; 2) включение в липиды. Это позволяет считать, что активность пируватдегидрогеназного комплекса должна строго регулироваться.
Активность ПДК (пируватдегидрогеназного комплекса) регулируется 3 путями:
1. Ингибирование продуктами реакции. Ацетил-КоА и НАДН ингибируют превращение

2. Регуляция нуклеотидами по принципу обратной связи.
Пируватдегидрогеназный комплекс ингибируется ГТФ и активируется АМФ.
Активность комплекса снижается, когда клетка богата легкодоступной энергией.

3. Регуляция путем ковалентной модификации. Комплекс теряет ферментативную активность, когда специфический остаток серина пируватдегидрогеназного комплекса фосфорилируется АТФ. Фосфорилирование усиливается при высоких соотношениях АТФ\АДФ, ацетил-КоА\СоА, НАДН\НАД+ и ингибируется пируватом.
Регуляция ЦТК.
Скорость функционирования ЦТК зависит от потребности клетки в АТФ. Важной регуляторной реакцией цикла является синтез цитрата из ацетил-КоА и оксалоацетата под действием цитратсинтетазы. АТФ – аллостерический ингибитор цитратсинтетазы. 1) Ац-КоА + ЩУК  цитрат
цитрат
Вторая регуляторная реакция – это реакция, катализируемая изоцитрат-дегидрогеназой. Фермент аллостерически активируется АДФ, НАДН ингибирует изоцитрат-дегидрогеназу:
2) Изоцитрат 
 -оксоглутарат
-оксоглутарат
3) Третьей регуляторной реакцией является реакция, катализируемая  -кетоглутаратдегидрогеназой:
-кетоглутаратдегидрогеназой:
 -кетоглутарат
-кетоглутарат  сукцинил-КоА
сукцинил-КоА
оксоглутарат
Регуляция цикла лимонной кислоты.
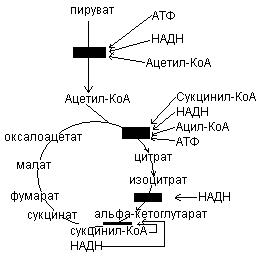
Активация пируваткарбоксилазы.
Активность пируваткарбоксилазы зависит от присутствия ацетил-КоА.
Пир может превращаться в ацетил-КоА, а также подвергаться карбоксилированию с образование оксалоацетата или ЩУК. Высокое содержание ацетил-КоА приводит к образованию количества оксалоацетата. Если имеет место избыток АТФ, то оксалоацетат потребляется в процессе глюконеогенеза:
Ацетил-КоА  ЩУК
ЩУК 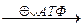 ФЕП
ФЕП  Глю
Глю
В условиях недостатка АТФ оксалоацетат включается в ЦТК, конденсируясь с ацетил-КоА.


Дата добавления: 2023-01-08; просмотров: 49; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

 Фру-1,6-дф
Фру-1,6-дф Пир
Пир ЩУК
ЩУК ФЭП
ФЭП