ЭТАПЫ ОБМЕНА БЕЛКОВ. ПЕРЕВАРИВАНИЕ БЕЛКОВ
Обмен белков
ПЛАН
Введение……………………………………………………………………...3
1.Биологическая роль белков………………………………………..….4
2. Источники поступления белков………………………………………9
3. Этапы обмена белков. Переваривание белков……………………...10
Заключение………………………………………………………………….18
Список литературы …………………………………………………………19
ВВЕДЕНИЕ
Одним из важнейших компонентов пищи является белок.
Белки – сложные высокомолекулярные органические соединения, состоящие из аминокислот. Для нормальной жизнедеятельности организма и его высокой работоспособности необходимо, чтобы в пища содержала достаточное количество белка высокого качества.
Качество пищевого белка определяется его биологической ценностью и усвояемостью. Биологическая ценность зависит от содержания и соотношения входящих в состав белков незаменимых аминокислот и отражает степень соответствия аминокислотного состава белка потребностям организма. Усвояемость белка определяется количеством белка (в %), усвоенным организмом из различных пищевых продуктов. Усвояемость белка продуктов животного происхождения – более 90%, растительного происхождения – около 70%. Таким образом – белок продуктов животного происхождения обладает более высоким качеством по сравнению с продуктами растительного происхождения, т.к. в нем содержатся все незаменимые аминокислоты и он лучше усваивается.
Особенно большое значение имеет достаточное содержание белка для растущего организма, т.к. белку принадлежит основная пластическая роль. Именно белковая часть рациона является источником роста, восстановления и обновления протоплазмы клеток и тканей.
БИОЛОГИЧЕСКАЯ РОЛЬ БЕЛКОВ
Белки (протеины) – это сложные высокомолекулярные азотсодержащие соединения, состоящие из аминокислот. Набор и последовательность аминокислот в белке характеризуют как его биохимическую специфичность, так и ценность в питании. Из нескольких десятков известных в настоящее время аминокислот в составе пищевых продуктов содержится 20.
Аминокислоты, из которых состоят белки, делят на заменимые и незаменимые.Незаменимые аминокислоты обязательно должны поступать с пищей в необходимых количествах и в определенных соотношениях. Заменимые аминокислоты могут претерпевать в организме взаимопревращения или образовываться из незаменимых в результате различных биохимических превращений (реакции переаминирования, синтез из небелковых соединений с использованием аммиака в качестве источника азота). К незаменимым аминокислотам относятся аргинин, валин, гистидин, изолейцин, лейцин, лизин, метионин, триптофан, фенилаланин, треонин (причем аргинин и гистидин считаются незаменимыми для детей в возрасте до 3 лет). Заменимые аминокислоты: аланин, аспарагин, аспарагиновая кислота, глицин, глутаминовая кислота, глутамин, серин, цистин, тирозин, пролин.
Белки организма человека выполняют жизненно важные функции: пластическую, энергетическую, каталитическую, регуляторную, защитную, транспортную, рецепторную.
1. Пластическая функция - основная функция белка в организме. Белки являются незаменимым строительным материалом, обеспечивают рост и развитие организма. Все клеточные мембраны и мембраны субклеточных структур содержат белок, роль которого многообразна.
2. Другая важная функция белков – каталитическая. В основе всех жизненных процессов лежат тысячи химических реакций, биологическая эффективность которых осуществляется благодаря присутствию особых биологических катализаторов – ферментов, представляющих собой специфические белки.
3. Регуляторная функция белков связана с синтезом гормонов, которые имеют белковую природу. Гормоны - это биологически активные вещества, которые в ничтожно малых количествах оказывают выраженное влияние на обмен веществ.
4. Велика роль белков в транспорте веществ в организме. Имея различные функциональные группы, белки связывают и переносят с током крови многие соединения. Это, прежде всего, гемоглобин, переносящий кислород из легких к клеткам. Белки сыворотки крови – альбумины – способствуют переносу жирных кислот, а липопротеид переносит липиды.
4. Многие белки обладают сократительной функцией. Это, прежде всего, актин и миозин, входящие в состав мышечного волокна высших организмов.
5. Запасная функция. Белки образуют комплексы с другими нутриентами и это свидетельствует еще об одной функции белка – запасной. Депонируется, т.е. откладывается про запас, например, железо в селезенке в виде комплекса с белком ферритином. При постоянном распаде гемоглобина железо не выводится из организма, а сохраняется в виде ферритина. По мере необходимости для синтеза нового гемоглобина железо берется из этого своеобразного депо.
7. Защитная функция. Участвуют в образовании антител.
8. Энергетическая. 1г – 4 ккал
9. Рецепторная функция. Известно, что многие гормоны, активно влияющие на обмен веществ, не проникают в клетку, а связываются со специфическими белками, находящимися на поверхности клеточных мембран. Этот белок-рецептор одним концом контактирует с гормоном, а другим – с ферментом на внутренней мембране. После связывания с гормоном конфигурация рецепторного белка изменяется, что переводит фермент внутри клетки в активное состояние. Это способствует передаче гормонального влияния внутрь клетки.
Потребность в белке зависит от возраста, пола, характера трудовой деятельности, климатических и национальных особенностей и др. Наиболее тщательно изучены и подробно разработаны данные о минимальной потребности человека в белке. Для этой цели используется метод определения азотистого баланса. При определенном минимальном поступлении белка с пищей устанавливается азотистое равновесие, т.е. количество экскретируемого различными путями азота становится равным его поступлению с пищей. Если количество белка в составе пищевого рациона недостаточно, то устанавливается состояние отрицательного азотистого баланса, свидетельствующее о том, что расход тканевых белков превышает поступление их с пищевым рационом.
Согласно физиологическим нормам питания, действующим в нашей стране, общее количество белка в рационах питания детей должно составлять удвоенное количество по сравнению с обеспечивающим азотистый баланс или азотистое равновесие, а для взрослого населения -1,5 количество. Для дошкольников - 53- 69 г, для школьников - 77-98 г, для взрослого населения: у женщин - 58-87 г и у мужчин - 65-117 г (в зависимости от их профессиональной деятельности).
В целом за счет белков должно обеспечиваться 14% калорийности рациона.
Наряду с общим количеством белка нормируется и количество белков животного происхождения, т.к. они являются полноценными белками, т.е. содержат все незаменимые аминокислоты - валин, гистидин, изолейцин, лейцин, лизин, метионин, триптофан, треонин и фенилаланин. Белки животного происхождения должны составлять не менее 60% для детей и не менее 55% - для взрослых.
Среди незаменимых аминокислот наибольшее значение для организма человека имеют триптофан, лизни и метионин. Оптимальным соотношением этих аминокислот в суточном рационе питания является 1:3:3, что соответствует их соотношению в женском молоке и усредненному аминокислотному составу тела человека. Если эти аминокислоты поступают в ином соотношении, то синтез белка в организме человека идет на уровне той аминокислоты, которой меньше всего, а оставшиеся неиспользованными аминокислоты выводятся из организма.
Биологическая роль трех наиболее дефицитных незаменимых аминокислот:
1. Метионин участвует в жировом обмене (регулирует обмен жиров-фосфатидов), являясь одним из лучших литотропных веществ, предупреждающих ожирение печени. Метионин является лучшим донатором метальных групп для синтеза холина - этого антисклеротического фактора. Метионин предохраняет от тяжелых поражений при лучевом воздействии и от действия бактериальных токсинов. Способствует более полному проявлению действия витамина В12, фолиевой кислоты и т.д.
Хорошим источником метионина является молочный белок "казеин", который содержит до 3% метионина. Много его содержится в белках трески, яиц, мяса, т. е. в белках животных продуктов.
В природе самое высокое содержание серосодержащих аминокислот (метионин+цистин) в зернах подсолнуха.
2. Лизин - тесным образом связан с кроветворением. При его недостатке уменьшается число эритроцитов и количество Нв.
Кроме того, при его недостатке отмечается нарушение кальцификации костей, истощение мышц. Лизин необходим для роста молодых организмов.
Основным источником лизина является молочный белок. Творог содержит его 1,5%. Имеется также в мясе животных.
3. Триптофан является аминокислотой, необходимой для синтеза в организме никотиновой кислоты (РР), гемоглобина, образования сывороточных белков. Ростовый фактор. Чем меньше возраст, тем выше потребность в триптофане (1,0).
Но триптофан набрать в достаточном количестве довольно трудно, т.к. в 100 г мяса, яиц его содержится только 0,2 г.
В молоке триптофан находится в альбумине, который при нагревании свыше 70 С денатурируется и выпадает в осадок на стенке посуды, следовательно, теряется и триптофан. Поэтому важно так обрабатывать молоко, чтобы не было потери альбуминов. Лучше всего, конечно, употреблять сырое молоко от здоровой коровы.
Продукты - источники полноценного белка (в %):
мясо - 16-22
рыба - 14-20
птица - 16-24
яйца - 12,5
яичный порошок - 52
молоко - 3,4
творог тощий - 17,5
творог жирный - 13
сыры разные - 18-25
Менее полноценными по аминокислотному составу являются белки из продуктов растительного происхождения. Но неполноценность аминокислотного состава растительных белков компенсируется при питании смешанной пищей и особенно за счет рационального подбора различных продуктов растительного и животного происхождения.
Кроме того, среди растительных продуктов есть бобовые, содержащие большое количество полноценных белков (в %):
горох - 19,8
фасоль - 19,6
чечевица - 20,4
мука гороховая - 22,0
мука соевая обезжиренная - 41,4
Белки этих продуктов имеют в достаточном количестве особенно ценные аминокислоты, такие как триптофан, лизни, метионин, а соя содержит этих аминокислот даже больше, чем мясо, а метионина в ней столько же, сколько и в твороге.
Недостаточное поступление белка в организм сказывается на функции всех систем: ферментной, эндокринной, иммунной, кроветворной, нервно-рефлекторной, детоксицирующей. При недостаточном поступлении белков с пищей нарушаются обменные процессы витаминов и минеральных веществ.
При длительном недостаточном поступлении белков с пищей у детей развивается заболевание, носящее название болезни Квашиоркор, что в переводе с языка жителей Ганы означает "болезнь ребенка, отнятого от груди". Такое заболевание распространено в развивающихся странах Индокитая, Африки и Южной Америки. По мере роста ребенка, если сохраняется белковый дефицит, болезнь Квашиоркор переходит в заболевание взрослого - алиментарную дистрофию или алиментарный маразм. Эти заболевания являются необратимыми и приводят к смерти таких больных уже в юношеском возрасте.
При избыточном поступлении в организм белка в кишечнике усиливаются процессы гниения с образованием таких токсичных соединений как индол, скатол. Нарушается ряд обменных процессов с накоплением в организме пуриновых соединений, уратов, что может способствовать развитию подагры, МКБ. В процессе обмена белков образуются соединения, обладающие возбуждающим действием на ЦНС – в питании детей рекомендуется использовать основное количество мясных продуктов в первую половину дня (Сетко Н.П., Сетко А.Г., Фатеева Т.А., Володина Е.А., Тришина С.П., Чистякова Е.С.; под общ. Ред. Н.П. Сетко. 2011).
Белки организма обновляются полностью в среднем за 80 суток, колебание в разных тканях составляет от 10 до 180 суток. Интенсивность обновления белка в ткани можно оценить по коэффициенту изнашивания Рубнера. Это минимальный распад белка ткани в состоянии покоя на килограмм массы тела в сутки при отсутствии белков в пище и поступлении достаточного количества других веществ. В норме коэффициент изнашивания составляет 0,028-0,075 граммов азота на килограмм массы тела в сутки. Этот коэффициент позволяет определить белковый минимум - 40 г в сутки. Однако белковый оптимум составляет около 100 г белка в сутки, т.к. белки используются не только для восстановления разрушенных тканей, но и для энергетических и иных целей.
Потребность в белке зависит от возраста, пола, характера трудовой деятельности, климатических и национальных особенностей и других факторов. Согласно физиологическим нормам питания, общее количество белка в рационах детей должно составлять удвоенное количество по сравнению с минимумом, обеспечивающим азотистое равновесие, а для взрослого населения – полуторное количество. Для детей от года до 7 лет – 36-54 г, для школьников - 63-87 г; для взрослого населения: у женщин - 58-87 г и у мужчин - 65-117 г (в зависимости от их профессиональной деятельности).
Качество пищевого белка определяется его биологической ценностью и усвояемостью. Биологическая ценность зависит от содержания и соотношения входящих в состав белков незаменимых аминокислот и отражает степень соответствия аминокислотного состава белка потребностям организма. Усвояемость белка определяется количеством белка (в %), усвоенным организмом из различных пищевых продуктов. Усвояемость белка продуктов животного происхождения – более 90%, растительного происхождения – около 70%. Таким образом – белок продуктов животного происхождения обладает более высоким качеством по сравнению с продуктами растительного происхождения, т.к. в нем содержатся все незаменимые аминокислоты и он лучше усваивается. Поэтому наряду с общим количеством белка нормируется и количество белков животного происхождения, т.к. они являются полноценными белками, т.е. содержат все незаменимые аминокислоты. Белки животного происхождения в суточном пищевом рационе должны составлять от общего количества белка не менее 60% для детей и не менее 55% - для взрослых.
Менее полноценными по аминокислотному составу являются белки из продуктов растительного происхождения. Но неполноценность аминокислотного состава растительных белков компенсируется при питании смешанной пищей и, особенно за счет рационального подбора различных продуктов растительного и животного происхождения. Кроме того, среди продуктов растительного происхождения есть бобовые и соевые, содержащие большое количество полноценных белков. Белки этих продуктов имеют в достаточном количестве особенно ценные аминокислоты, такие, как триптофан, лизин, метионин, а соя содержит этих аминокислот даже больше, чем мясо, а метионина в ней столько же, сколько и в твороге. Продукты, содержащие белки животного и растительного происхождения, приведены в приложении 2. Наиболее быстро перевариваются белки молока и рыбы, затем мяса, хлеба и круп. Тепловая обработка продуктов ускоряет перевариваемость белков, хотя длительная тепловая обработка может ухудшить их усвоение.
Одним из наиболее доступных методов изучения биологической ценности белка является расчет аминокислотного скора. Он заключается в вычислении процентного содержания каждой незаменимой аминокислоты в исследуемом белке (продукте) по отношению к количеству этой же аминокислоты в белке, принимаемом в качестве стандартного, по формуле
Аи.б.
Са = ---------- 100,
Ас.б.
где Са - аминокислотный скор, %; Аи.б., Ас.б. - любая незаменимая аминокислота в 1 г соответственно исследуемого и стандартного белка, мг.
В качестве стандартного белка для новорожденных используется белок грудного молока, для более старших детей и взрослых - белки яйца, молока (казеин) или эталонный белок. Аминокислота, скор которой минимален, считается лимитирующей биологическую ценность белка.
ИСТОЧНИКИ ПОСТУПЛЕНИЯ БЕЛКОВ
Недостаточное поступление белка сказывается на функции всех систем организма: ферментной, эндокринной, иммунной, кроветворной, нервно-рефлекторной, детоксицирующей. При недостаточном поступлении белков с пищей нарушаются обменные процессы витаминов и минеральных веществ. При длительном недостаточном поступлении белков с пищей у детей 1 – 5 лет может развиться заболевание, носящее название болезни Квашиоркор, что в переводе с языка жителей Ганы означает «болезнь ребенка, отнятого от груди». Квашиоркор бывает и у грудных детей, находящихся на бедном белком искусственном вскармливании, реже – у взрослых.
При избыточном поступлении в организм белка в кишечнике усиливаются процессы гниения с образованием таких токсичных соединений как индол, скатол. Нарушается ряд обменных процессов с накоплением в организме пуриновых соединений, уратов, что может способствовать развитию подагры, мочекаменной болезни.
В связи с непрерывно увеличивающейся численностью населения земного шара возникает необходимость поиска путей решения проблемы обеспечения населения полноценным белком. Главным путем увеличения белковых ресурсов останется традиционный, связанный с повышением продуктивности сельскохозяйственного производства (в том числе за счет селекции и биотехнологических приемов, основанных на генно-инженерных методах) и снижением потерь при переработке и обороте продовольственного сырья и пищевых продуктов. Разрабатываются технологии получения нетрадиционных и новых источников белка. Под нетрадиционными и новыми источниками белка, перспективными для использования в питании, подразумевают протеин-содержащие продукты, являющиеся или отходами пищевого и кормового производства и малоутилизируемым пищевым сырьем, или совершенно новые ресурсы для получения белка.
К нетрадиционным источникам белка относятся:
· вторичные белоксодержащие продукты - обрат, молочная сыворотка, казеинаты, кровь и органы убойных животных, продукты переработки бобовых (соевые белковые продукты);
· отходы и побочные продукты пищевого и кормового производства - бобовые культуры, отходы мельничных производств, шрот из семян подсолнечника, льна, хлопчатника, арахиса, сои, сафлора и некоторых других масличных культур, кукурузных зародышей, томатов, винограда;
· малоутилизируемое и не используемое ранее пищевое сырье - некоторые виды рыб и морепродуктов, биомасса зеленых растений, шрот из семян рапса и других крестоцветных, некоторые ткани и органы убойных животных.
Новыми источниками белка являются одноклеточные и многоклеточные водоросли, мицелий грибов, дрожжи, а также белки и аминокислоты микробиологического и химического синтеза.
Все потенциальные источники белка должны рассматриваться в качестве носителей как известных, так и новых токсических, аллергенных и антиалиментарных веществ (Рагузин А.В., Сетко Н.П., Ширшов О.В., Фатеева Т.А 2001).
ЭТАПЫ ОБМЕНА БЕЛКОВ. ПЕРЕВАРИВАНИЕ БЕЛКОВ
Этапы обмена белков:
1) гидролиз в ЖКТ;
2) всасывание;
3) транспорт кровью;
4) химические превращения в клетках;
5) выведение.
Белки, поступившие в организм с пищей, в желудочно-кишечном тракте (ЖКТ) расщепляются до аминокислот при действии группы протеолитиче-ских ферментов — пептидгидролаз по современной номенклатуре; широко известно их тривиальное название — протеазы, или протеиназы. Эти ферменты катализируют гидролитическое расщепление пептидной связи в белках, представляющее собой экзэргонический процесс, при котором АС имеет отрицательное значение и полностью сдвигает равновесие реакции в сторону образования продуктов реакции. Пептидгидролазы относятся по классификации ферментов к классу гидролаз, их шифр КФ 3.4.1—3.4.4.
Протеолитические ферменты животных и человека изучены достаточно хорошо, в меньшей степени исследованы растительные протеазы.
Для протеолитических ферментов характерен ряд общих свойств и особенностей.
Ферменты, расщепляющие белки, обладают относительной субстратной специфичностью, которая определяется:
· длиной полипептидной цепи;
· в структурой радикалов аминокислотных остатков, образующих гидроли-зуемую пептидную связь;
· положением связи в полипептиде.
Внутренние пептидные связи расщепляются эндопептидазами, концевые - экзопептидазами:
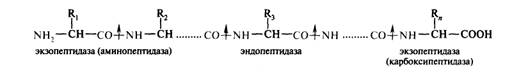
|
Известно, что скорость гидролиза протеазами денатурированных белков выше, чем нативных, поскольку при денатурации белков (например, в желудке под действием соляной кислоты при рН ~ 1,5—2,0) становятся доступными для протеолиза внутренние участки полипептидной цепи, ранее плотно упакованные в компактную глобулу.

|
Рис. 1. Схема последовательной деградации пищевых белков в желудочно-кишечном тракте
Все протеолитические ферменты синтезируются в виде неактивных предшественников, называемых зимогенами или проферментами, и таким образом клетки защищены от контакта с активной формой фермента и автолиза. Превращение зимогена в активный фермент происходит путем необратимой ковалентнои модификации зимогена за счет локального протеолиза, т. е. разрыва одной или нескольких пептидных связей и отщепления ограниченного числа аминокислотных остатков. Это вызывает конформационные изменения в полипептиде, достаточные для формирования пространственной структуры активного центра фермента.
Общая схема деградации белков пищи протеолитическими ферментами в пищеварительном тракте представлена на рис. 24.2.
Расщепление пищевых белков начинается с действия протеолитиче-ского фермента желудка — пепсина. Специализированные (периетальные) клетки эпителия желудка секретиру-ют соляную кислоту, создавая в желудке кислую среду (рН ~ 1,5—2,0). Этот фактор имеет важное значение в переваривании белков: денатурирует белки пищи, оказывает бактерицидное действие, убивая попадающие с пищей микроорганизмы, является инициирующим фактором активации пепсиногена и превращения его в активную форму. Пепсиноген превращается в пепсин после отщепления от него 42 аминокислотных остатков, вначале под действием соляной кислоты (медленно), а затем аутокаталитически (очень быстро). Молекулярная масса пепсиногена 40,4 кВа, пепсина — 32,7 Ша. Пепсин является эндонуклеазой, и его действие приводит к накоплению смеси пептидов; наиболее активно он гидролизует пептидные связи, МН-группа которых принадлежит ароматическим аминокислотам — тирозину, фенилаланину, триптофану. В слизистой желудка человека выделен также про-теолитический фермент гастриксин, сходный по свойствам с пепсином.
Секреция соляной кислоты активируется гистамином и гормонами гаст-ринами, их образование угнетается гормоном слизистой двенадцатиперстной кишки — секретином и гормоном гипофиза — соматостатином.
Дальнейшее переваривание высокомолекулярных пептидов и белков, не расщепленных пепсином, происходит тремя эндопептидазами, вырабатываемыми поджелудочной железой в виде предшественников — трипсиногена, хи-мотрипсиногена и проэластазы.
Процесс превращения трипсиногена в трипсин происходит под действием фермента, вырабатываемого в клетках слизистой оболочки кишечника — энте-ропептидазы, а затем аутокаталитически под влиянием трипсина.
Трипсин обладает сравнительно узкой субстратной специфичностью, разрывая пептидные связи, в образовании которых участвуют карбоксильные группы лизина и аргинина, т. е. основных аминокислот.
В поджелудочной железе синтезируется ряд химотрипсинов из двух предшественников — химотрипсиногена А и химотрип-синогена В. Активируются зимогены в кишечнике под действием активного трипсина и хймотрипсина.
Химотрипсин обладает более широкой субстратной специфичностью, чем трипсин. Он катализирует гидролиз не только пептидов, но и эфиров, амидов и других ацилпроизводных, хотя наибольшую активность он проявляет по отношению к пептидным связям, в образовании которых принимают участие карбоксильные группы ароматических аминокислот — фенилаланина, тирозина и триптофана.
В поджелудочной железе синтезируется еще одна эндопептидаза — элас-таза. Название фермент получил от субстрата эластина, который он гидролизует. Эластин богат глицином и аланином, содержится в соединительной ткани. Эластаза обладает широким спектром действия, гидролизуя субстраты, не расщепляемые трипсином и химотрипсином.

|
Рис. 2. Активация протеиназ в кишечнике
В переваривании нативных белков и продуктов их гидролиза в тонком кишечнике активное участие принимают экзопептидазы. Карбоксипептидазы синтезируются в неактивном состоянии в поджелудочной железе и активируются трипсином в кишечнике. Карбоксипептидаза А гидролизует пептидные связи С-концевых аминокислот, образованные преимущественно ароматическими аминокислотами (фенилаланин, тирозин, триптофан), а карбоксипеп-тидаза В — связи, в образовании которых участвуют С-концевые лизин и аргинин.
Аминопептидазы вырабатываются в клетках слизистой оболочки кишечника (энтероцитах) сразу в активной форме. Из кишечного сока выделены два типа аминопептидаз, различающиеся по субстратной специфичности — ала-нинаминопептидаза и лейцинаминопептидаза, первая из которых гидролизует пептидную связь, образованную ТУ-концевым аланином, а вторая способна гидролизовать практически любую пептидную связь, образованную ТУ-конце-вой аминокислотой.
Процесс переваривания пептидов, их расщепление до свободных аминокислот в тонком кишечнике завершают три- и дипептидазы.
При избыточном потреблении животных жиров и ряде патологий в нижних отделах кишечника возможно развитие гнилостных и бродильных процессов. При действии микрофлоры кишечника происходят превращения аминокислот, получившие название гниения белков в кишечнике. Так, в процессе глубокого распада серосодержащих аминокислот (цистина, цистеина и метиони-на) в кишечнике образуются сероводород и меркаптан. Диаминокислоты, в частности орнитин и лизин, подвергаются процессу де-карбоксилирования с образованием диаминов, иногда называемых трупными ядами, поскольку они образуются также при гнилостном разложении трупов. Из орнитина образуется путресцин, а из лизина — кадаверин:
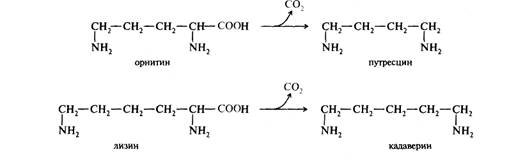
Следует отметить, что сравнительно недавно в животных тканях был открыт фермент, катализирующий декарбоксилирование орнитина.
Полиамины, в том числе и диамин путресцин, содержатся практически во всех тканях и входят в основном в состав ядерного хроматина. Известно их участие в регуляции клеточного деления, однако молекулярные механизмы их действия остаются не до конца выясненными.
Из фенилаланина, тирозина и триптофана при бактериальном декарбок-силировании образуются соответствующие биогенные амины: фенилэтил-амин, и-гидроксифенилэтиламин (или тирамин) и индолилэтиламин (трипт-амин); при постепенном разрушении боковых цепей циклических аминокислот, в частности тирозина и триптофана, образуются ядовитые продукты обмена: соответственно крезол и фенол, скатол и индол
Индол и скатол обезвреживаются в печени, предварительно окисляясь соответственно в индоксил и скатоксил, выводятся из организма в виде парных соединений, вступая в реакцию конъюгации с З-фосфоаденозил-5-фосфо-сульфатом (ФАФС) или уридиндифосфатглюкуроновой кислотой (УДФГК).
В качестве примера приведена реакция детоксикации индола, которая заканчивается образованием животного индикана, выводимого с мочой (В.П. Комов, В.П. Шведова, 2004).
После денатурации вызванной соляной кислотой желудочного сока, белок подвергается полостному гидролизу в тонкой кишке, в результате чего получаются олигопептиды. Получение олигопептидов невозможно без участия ферментов поджелудочной железы – трипсина и химотрипсина. Олигопептиды являются субстратом для пристеночного гидролиза в тонкой кишке, конечными продуктами которого являются аминокислоты. Процесс пристеночного гидролиза сопряжен с всасыванием конечных продуктов, т. е. локализация гидролиза и всасывания одна и также. Всасывание аминокислот осуществляется активно. Поступившие в кровь аминокислоты по системе воротной вены поступают в печень. В печени синтезируются два вида белков:
- белки, необходимые для жизнедеятельности самих клеток (ферменты, структурные);
- белки, экспортируемые в плазму крови, где они и проявляют свои функции.
В гепатоцитах преобладает синтез экспортируемых в плазму белков, особенно альбуминов. Концентрация альбумина в норме колеблется от 38 до 50 г/л. Альбумины плазмы крови синтезируются только в гепатоцитах, другие плазменные белки синтезируются и в других органах. За сутки в печени обновляется около 9 % собственных белков и до 25% всех альбуминов плазмы (12 – 25 г/сут).
Альбумины имеют наименьшую молекулярную массу из всех плазменных белков и форму, обеспечивающую наименьшее увеличение вязкости крови по сравнению с глобулинами и особенно фибриногеном. Альбумины обладают большой гидрофильностью и связанная в гидратных оболочках альбумина вода не способна покидать кровяное русло. Связывание альбумином воды плазмы и Na+ определяет их роль в регуляции онкотического давления (75 – 80% от общего онкотического давления). Таким образом, выраженная гипоальбуминемия ведёт к понижению онкотического давления. Онкотическое давление играет роль в обеспечении фильтрации и реабсорбции воды и растворенных в ней веществ. Так как стенка капилляров непроницаема для белков, то онкотическое давление препятствует фильтрации. Следовательно, при гипоальбуминемии происходит увеличение фильтрации и развивается отек тканей, уменьшается объем циркулирующей крови. Отёк тканей создаёт условия для сдавливания просвета капилляров, что ещё больше нарушает микроциркуляцию в жизненно важных органах: мозг, почки, сердце, скелетные мышцы. Это ведёт к снижению мышечной работоспособности, быстрой утомляемости, мышечной слабости и так далее.
Особо следует выделить транспортную функцию альбуминов. Молекулы альбумина присоединяют и транспортируют свободные жирные кислоты, желчные кислоты, избыток стероидных и тиреоидных гормонов, ионы кальция, токсины, многочисленные лекарственные вещества. Присоединяясь к альбуминам эти вещества изменяют свои физико – химические свойства (например, становятся растворимыми в воде) и теряют свои биологические свойства (инактивация гормонов, обезвреживание токсинов и лекарств). Поэтому у грудных детей при гипотрофии и пожилых людей при истощении нередко появляются признаки передозировки лекарств и токсический эффект.
Кроме альбумина в гепатоцитах синтезируются белки, выполняющие специфические функции. Это прокоагулянтные белки (фибриноген, протромбин, проакцелерин (V), конвертин (VII), фактор Стюарта (X)), белки – переносчики, (трансферрин, гаптоглобины), а также ферменты и их ингибиторы. Трансферрин транспортирует свободное (негеминовое) железо, поступающее из кишечника, и не фильтруется. По этой причине молоко практически не содержит железо. В клетках ретикуло – эндотелиальной системы (селезёнка, печень, красный костный мозг) железо входит в состав белка ферритина.
Для синтеза многообразных белков и использования аминокислот в энергетических целях в печени аминокислоты подвергаются переаминированию и дезаминированию. Переаминирование – это перенос аминогруппы, в результате этой реакции из одной аминокислоты можно получить другую, исключение составляют восемь аминокислот получивших название незаменимых, чье присутствие в пище является обязательным условием для синтеза белков. Дезаминирование является начальным этапом включения аминокислот в глюконеогенез. Из печени в кровь печеночной вены поступают белки плазмы и аминокислоты. Аминокислоты, поступая в ткани организма, используются на синтез белков или подвергаются дезаминированию. Одновременно с синтезом белков в тканях идет распад белковых соединений. При распаде образуются азотистые соединения, обладающие токсичным эффектом. В печени происходит превращение азотсодержащих токсинов в мочевину, которая выводится из организма с мочой и потом.
Регуляция белкового обмена,как и регуляция обмена веществ в целом, преимущественно гуморальная. Следует отметить группу гормонов, оказывающих анаболический эффект, т. е. увеличение синтеза белка. Выраженным анаболическим эффектом обладают СТГ (стимулирует процессы транскрипции и трансляции), инсулин (белковосберегающая функция инсулина за счет угнетения глюконеогенеза), половые гормоны, особенно андрогены. Следует отметить двоякое влияние глюкокортикоидов на синтез белков. В печени они увеличивают синтез белков, а в мышцах и лимфоидных образованиях наоборот угнетают. Следствием последнего является снижение иммунитета при применении глюкокортикоидов с лечебной целью. При высокой концентрации глюкокортикоидов из-за снижения синтеза белков возможно истончение кожи и явления остеопороза.
Дата добавления: 2018-02-15; просмотров: 3037; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
