В возбужденном состоянии
СТРОЕНИЕ АТОМА
Решение типовых задач
Пример 1.1. Дано значение одного из четырех квантовых чи-сел, например, n = 4. Составьте таблицу значений четырех квантовых чисел: n, l, ml,ms. Приведите характеристику каждого квантового числа и его возможные значения.
Р е ш е н и е
Главное квантовое число n определяет энергию и размеры электронных орбиталей. Ввиду того, что n определяет основную характеристику электрона в атоме – квантованность его энергии, эта величина получила название главного квантового числа. Главное квантовое число характеризует энергетический уровень, чем больше n, тем выше энергия квантового состояния. Главное квантовое число принимает значения 1, 2, 3, … ∞.
Орбитальное квантовое число l характеризует форму орбитали, а также энергетические подуровни в электронной оболочке атома. Орбитальное квантовое число зависит от главного и принимает набор целочисленных значений: 0, 1, 2, 3, …до (n – 1).
Для указания подуровней и соответствующих им орбиталей используют буквенные обозначения: s, p, d, f …
Согласно квантовомеханическим расчетам s-орбитали имеют форму сферы, р-орбитали – форму гантели, d- и f-орбитали более сложные формы.
Следует учесть, что чем выше номер энергетического уровня, тем большим набором форм орбиталей он характеризуется. Например:
| Главное квантовое число, n | Орбитальное квантовое число, l | Обозначение орбитали |
| 1 | 0 | 1s |
| 2 | 0, 1 | 2s, 2p |
| 3 | 0, 1, 2 | 3s, 3p, 3d |
| 4 | 0, 1, 2, 3 | 4s, 4p, 4d, 4f |
|
|
|
Таким образом, для электрона первого энергетического уровня (n = 1) возможна только одна форма орбитали, для второго (n = 2) возможны две формы орбиталей и т.д.
В зависимости от формы, орбитали одного уровня отличаются по энергии, т.е. каждый энергетический уровень делится на подуровни: 1-й уровень содержит один подуровень, 2-й – два, 3-й – три, 4-й – четыре.
В примере n = 4, следовательно, четвертый энергетический уровень содержит четыре подуровня, а именно 4s, 4p, 4d, 4f, и орбитальное квантовое число принимает значения 0; 1; 2; 3.
Магнитное квантовое число ml характеризует расположение (ориентацию) орбитали в пространстве вокруг ядра под действием магнитных полей ядра, других электронов и внешнего магнитного поля. Магнитное квантовое число зависит от l и принимает набор значений от –l, включая 0, до +l.
Таким образом, энергетический подуровень включает то число атомных орбиталей, сколько значений ml отвечает конкретному значению ln.
Следовательно, s-состоянию отвечает одна орбиталь, р-состоянию – три, d-состоянию – пять, f-состоянию – семь орбиталей.
|
|
|
Например, для l = 2 возможные значения ml будут: -2; –1; 0; +1; +2, т.е. на данном подуровне (d-подуровень) существует пять орбиталей.
Спиновое квантовое число или спин ms характеризует собственный момент количества движения электрона, связанное с вращением вокруг своей оси. Спиновое квантовое число имеет только два значения: +1/2 и –1/2. Положительное и отрицательное значения ms связаны с направлением движения электрона по часовой или против часовой стрелки. Электроны с разными спинами обычно обозначаются противоположно направленными стрелками.
При данном n = 4 запишем значения всех квантовых чисел в виде табл. 1.1.
Т а б л и ц а 1.1
| n | l | me | ms |
| 4 | 0 | 0 | +1/2; -1/2 |
| 1 | -1; 0; +1 | +1/2; -1/2 | |
| 2 | -2;-1;0;+1;+2 | +1/2; -1/2 | |
| 3 | -3;-2;-1;0;+1;+2;+3 | +1/2; -1/2 |
Пример 1.2.Для вольфраманапишите распределение элек-тронов в нормальном и возбужденном состоянии. Укажите валентные электроны. Определите число протонов и нейтронов у  .
.
Р е ш е н и е
Распределение электронов для атома W в нормальном состоянии напишем согласно правилу Клечковского, т. е. с учетом энергии каждого уровня и подуровня:
|
|
|
1s22s22p63s23p64s23d104p65s24d105p66s24f145d4 .
Для проявления возбужденного состояния нарисуем электронную формулу валентного слоя:


 нормальное состояние
нормальное состояние
6s









5d
При возбуждении атома электроны переходят в более высокое энергетическое состояние в пределах внешнего уровня:





 возбужденное состояние
возбужденное состояние
 6p
6p

 6s
6s
 |
5d
Протон (р) – это частица, имеющая массу 1,67·10-27 кг и положительный заряд.
|
|
|
Нейтрон (n) – незаряженная частица, обладающая массой 1,67·10-27 кг.
Число протонов в ядре характеризует его заряд (z) и принадлежность атома данному химическому элементу, соответствует порядковому номеру элемента. Его пишут слева внизу у символа элемента.
Сумму протонов (z) и нейтронов (n), содержащихся в ядре атома, называют массовым числом (А), А = z + n. Массовое число обычно пишут слева вверху у символа элемента.
Следовательно, у атома вольфрама  имеется 74 протона и 110 нейтронов.
имеется 74 протона и 110 нейтронов.
Пример 1.3.Напишите распределение электронов для 80Hg и 56Ва. Определите, к каким периоду, группе, семейству они относятся, укажите их валентные электроны. Объясните, в чем сходство и различие элементов с учетом следующих параметров: возможные степени окисления, радиус атома, энергия ионизации, относительная электроотрицательность, восстановительная и окислительная способности.
Р е ш е н и е
Напишем распределение электронов:
для 56Ва 1s22s22p63s23p64s23d104p65s24d105p66s2
для 80Hg 1s22s22p63s23p64s23d104p65s24d105p66s24f145d10.
Выпишем отдельно валентные электроны:
для 56Ва это 6s2, для ртути 80Hg – 5d106s2.
Оба элемента находятся в шестом периоде и во II группе, но барий в главной подгруппе, а ртуть – в побочной. Поскольку у Ва последним заполняется s-подуровень, этот элемент относится к s-се-мейству. У ртути (Hg) идет заполнение d-подуровня, следовательно, это ds-элемент.
Валентный слой Ва, содержащий 2 электрона, представим графически:


 в нормальном состоянии
в нормальном состоянии
6s ,
в возбужденном состоянии





 6p
6p
6s .
Теоретически возможные степени окисления бария будут 0 и +1; +2.
У ртути валентный слой содержит 12 электронов:
в нормальном состоянии:



6s














 ;
;
5d
в возбужденном состоянии:




6р


6s















5d .
Возможные степени окисления ртути будут 0; +1; +2.
Воспользуемся табличными данными и приведем значения радиуса атома, энергии ионизации и электроотрицательности элементов.
| Ва | Hg | |
| rат, нм | 0,221 | 0,160 |
| I1, кДж/моль | 502,8 | 1007,1 |
| ОЭО | 0,9 | 1,9 |
Видно, что радиус атома Ва значительно больше радиуса атома Hg. Энергия ионизации и относительная электроотрицательность у атома Ва практически в два раза меньше, чем у атома Hg. Это свидетельствует о том, что восстановительная способность атома Ва выше, чем у атома Hg.
Оба элемента относятся к металлам и являются восста-новителями. Как сильный восстановитель барий энергично взаимо-действует с большинством неметаллов уже при комнатной температуре. Взаимодействие с водой, даже на холоде, сопровождается образованием гидроксида Ва.
Ртуть плохо окисляется на воздухе, но при нагревании взаимодействует с серой и галогенами, растворяется в HNO3, горячей концентрированной H2SO4, царской водке и не растворима в HCl и разбавленной H2SO4. Ртуть образует комплексные ионы, для которых характерно координационное число 4. Ртуть и ее соединения очень ядовиты.
Сходные признаки и различия указанных элементов могут быть представлены в виде таблицы.
Пример 1.4. Объясните, что характеризуют и как изменяются радиус атома, энергия ионизации, восстановительная способность, сродство к электрону, электроотрицательность: а) по периоду слева направо, б) по группе сверху вниз?
а) 73Та – 81Тl; б) 31Ga – 81Tl.
Р е ш е н и е
Радиус атома орбитальный – теоретически рассчитанное положение главного максимума плотности внешних электронных облаков. Практически приходится пользоваться эффективным. Эффективный радиус – 1/2 расстояния между ядрами атомов химически связанных элементов.
В периодах атомные радиусы по мере увеличения заряда ядра, в общем, уменьшаются, так как при одинаковом числе электронных слоев возрастает заряд ядра, а следовательно, притяжение им электронов.
В пределах каждой подгруппы элементов, как правило, радиусы атомов увеличиваются сверху вниз, так как возрастает число электронных уровней.
Энергией ионизации называется количество энергии I, необ-ходимое для отрыва электрона от атома или иона: Э0 + I = Э+ +  .
.
По периоду энергия ионизации немонотонно возрастает. Резкие максимумы соответствуют атомам благородных газов, которые обладают наиболее устойчивой электронной конфигурацией s2p6.
В пределах одной группы с увеличением порядкового номера энергия ионизации обычно убывает, что связано с увеличением расстояния внешнего электронного уровня от ядра.
Энергия ионизации является мерой восстановительной способ-ности атома.
Сродством к электрону называется энергетический эффект F процесса присоединения электрона к атому: Э0+  = Э- ± F.
= Э- ± F.
В периодах сродство к электрону и окислительные свойства элементов возрастают, в группах, как правило, уменьшаются.
Понятие электроотрицательности (ОЭО) позволяет оценить способность атома данного элемента к оттягиванию на себя электронной плотности по сравнению с другими элементами соединения. Эта способность зависит от энергии ионизации атома и его сродства к электрону. Согласно Малликену, электроотрица-тельность атома может быть выражена как полусумма его энергии ионизации и сродства к электрону: ОЭО = 1/2 (I + F). В периодах наблюдается общая тенденция роста величины электроотрица-тельности, а в группах – ее падение.
Задачи
1.1. Дано значение одного из четырех квантовых чисел. Составьте таблицу значений четырех квантовых чисел: n, l, me,ms. Приведите характеристику каждого квантового числа и его возможные значения.
Т а б л и ц а 1.2
| Вариант | Значения | Вариант | Значения |
| 1 | n = 2 | 1’ | l = 2 |
| 2 | n = 3 | 2’ | n = 1 |
| 3 | n = 4 | 3’ | n = 3 |
| 4 | n = 5 | 4’ | n = 4 |
| 5 | n = 6 | 5’ | n = 5 |
| 6 | n = 7 | 6’ | n = 6 |
| 7 | l = 0 | 7’ | n = 7 |
| 8 | l = 1 | 8’ | l = 0 |
| 9 | l = 3 | 9’ | l = 1 |
| 10 | m = 0 | 10’ | l = 3 |
| 11 | m = 1 | 11’ | m = 0 |
| 12 | m = 2 | 12’ | m = 1 |
| 13 | m = 3 | 13’ | m = 2 |
| 14 | n = 1 | 14’ | m = 3 |
| 15 | l = 2 | 15’ | n = 2 |
1.2. Для элемента напишите распределение электронов в нормальном и возбужденном состоянии. Укажите валентные электроны. Определите число протонов и нейтронов у данного атома.
Т а б л и ц а 1.3
| Вариант | Элемент | Вариант | Элемент |
| 1 | 32Ge | 1’ | 40Zr |
| 2 | 51Sb | 2’ | 53I |
| 3 | 33As | 3’ | 55Cs |
| 4 | 31Ga | 4’ | 43Tc |
| 5 | 26Fe | 5’ | 56Ba |
| 6 | 34Se | 6’ | 46Pd |
| 7 | 42Mo | 7’ | 30Zn |
| 8 | 35Br | 8’ | 47Ag |
| 9 | 52Te | 9’ | 48Cd |
| 10 | 38Sr | 10’ | 57La |
| 11 | 44Ru | 11’ | 58Ce |
| 12 | 50Sn | 12’ | 59Pr |
| 13 | 49In | 13’ | 60Nd |
| 14 | 41Nb | 14’ | 61Pm |
| 15 | 45Rh | 15’ | 62Sm |
1.3. Напишите распределение электронов для элементов своего варианта. Определите, к каким периоду, группе, семейству они относятся, укажите их валентные электроны. Объясните, в чем сходство и различие элементов с учетом следующих параметров: возможные степени окисления, радиус атома, энергия ионизации, относительная электроотрицательность, восстановительная и окислительная способности.
Т а б л и ц а 1.4
| Вариант | Элементы | Вариант | Элементы | ||||
| 1 | 9F | 85At | 1’ | 17Cl | 85At | ||
| 2 | 20Ca | 30Zn | 2’ | 19K | 29Cu | ||
| 3 | 21Sc | 31Ga | 3’ | 23V | 33As | ||
| 4 | 22Ti | 32Ge | 4’ | 39Y | 49In | ||
| 5 | 57La | 81Tl | 5’ | 44Ru | 52Te | ||
| 6 | 72Hf | 82Pb | 6’ | 20Ca | 27Co | ||
| 7 | 73Ta | 83Bi | 7’ | 20Ca | 28Ni | ||
| Окончание табл. 1.4 | |||||||
| 8 | 41Nb | 51Sb | 8’ | 74W | 84Po | ||
| 9 | 42Mo | 52Te | 9’ | 76Os | 84Po | ||
| 10 | 40Zr | 50Sn | 10’ | 77Ir | 85At | ||
| 11 | 24Cr | 34Se | 11’ | 78Pt | 84Po | ||
| 12 | 25Mn | 35Br | 12’ | 37Rb | 47Ag | ||
| 13 | 43Tc | 52Te | 13’ | 55Cs | 79Au | ||
| 14 | 26Fe | 36Kr | 14’ | 38Sr | 48Cd | ||
| 15 | 75Re | 85At | 15’ | 41Nb | 50Sn | ||
1.4. Объясните, что характеризуют и как изменяются радиус атома, энергия ионизации, восстановительная способность, сродство к электрону, электроотрицательность а) по периоду слева направо (табл. 1.5); б) по группе сверху вниз (табл. 1.6).
Т а б л и ц а 1.5
| Вариант | Элементы | Вариант | Элементы |
| 1 | 87Fr - 108Hs | 1' | 88Ra - 109Mt |
| 2 | 55Cs - 86Rn | 2' | 56Ba - 85At |
| 3 | 37Rb - 54Xe | 3' | 38Sr - 52Te |
| 4 | 19K - 36Kr | 4' | 20Ca - 35Br |
| 5 | 11Na - 18Ar | 5' | 12Mg - 18Ar |
| 6 | 3Li - 10Ne | 6' | 4Be - 9F |
| 7 | 38Sr - 53I | 7' | 22Ti - 34Sе |
| 8 | 21Sc - 35Br | 8' | 40Zr - 53I |
| 9 | 12Mg - 17Cl | 9' | 72Hf - 85At |
| 10 | 74W - 84Po | 10' | 26Fe - 35Br |
| 11 | 46Pd - 53I | 11' | 44Ru - 53I |
| 12 | 58Ce - 71Lu | 12' | 13Al - 17Cl |
| 13 | 90Th - 103Lr | 13' | 76Os - 84Po |
| 14 | 37Rb - 53I | 14' | 20Ca - 33As |
| 15 | 25Mn - 36Kr | 15' | 37Rb - 52Te |
Т а б л и ц а 1.6
| Вариант | Элементы | Вариант | Элементы |
| 1 | 23V - 73Ta | 1' | 41Nb - 104Db |
| 2 | 26Fe - 76Os | 2' | 39Y - 89Ac |
| 3 | 29Cu - 79Au | 3' | 11Na - 55Cs |
|
Окончание табл. 1.6 | |||
| 4 | 3Li - 87Fr | 4' | 17Cl - 85At |
| 5 | 6C - 82Pb | 5' | 6C - 50Sn |
| 6 | 8O - 84Po | 6' | 27Co - 77Ir |
| 7 | 24Cr - 74W | 7' | 19K - 87Fr |
| 8 | 9F - 85At | 8' | 12Mg - 56Ba |
| 9 | 21Sc - 57La | 9' | 9F - 53I |
| 10 | 28Ni - 78Pt | 10' | 40Zr - 72Нf |
| 11 | 23V - 73Ta | 11' | 20Ca - 88Ra |
| 12 | 4Be - 88Ra | 12' | 13Al - 81Tl |
| 13 | 22Ti - 72Hf | 13' | 14Si - 50Sn |
| 14 | 25Mn - 75Re | 14' | 3Li – 37Rb |
| 15 | 30Zn - 80Hg | 15' | 7N - 51Sb |
ХИМИЧЕСКАЯ СВЯЗЬ
Решение типовых задач
Пример 2.1.Напишите электронную формулу Cr в устойчивых степенях окисления. Приведите примеры соединений хрома в этих степенях окисления.
Р е ш е н и е
Для хрома характерны следующие степени окисления: 0, +2, +3, +6.
Электронные формулы хрома в этих степенях окисления следующие:
Cr0 1s22s22p63s23p64s13d5,
Cr+2 1s22s22p63s23p63d4,
Cr+3 1s22s22p63s23p63d3,
Cr+6 1s22s22p63s23p6.
Нулевая степень окисления хрома проявляется в простом веществе, а также в карбониле [Cr0(CO)6].
Степень окисления +2 хром имеет в гидроксиде Cr(OH)2, солях типа CrCl2 и др.
Примером соединения хрома в степени окисления +3 может служить оксид Cr2O3. Эта степень окисления наиболее характерна для хрома.
Степень окисления +6 проявляется в оксиде CrO3, хроматах типа K2CrO4 и др.
Пример 2.2. С позиций метода валентных связей (ВС) покажи-те образование молекулы ВН3.Какие орбитали соединяющихся атомов участвуют в образовании связей? Какие и сколько s- или p-связей содержит молекула? Сколько связей в молекуле?
Какова пространственная структура молекулы? Каков тип гибридизации центрального атома в указанном соединении (если есть)? Отметьте полярность связей и полярность молекулы в целом.
Р е ш е н и е
Бор и водород имеют следующие электронные формулы:

| |
1s
5В: 1s22s22p1
 |
2р
 |
2s
В невозбужденном состоянии атом бора имеет один неспаренный электрон. Для образования трех связей необходимо распаривание 2s-электронов с переходом одного из них на 2р-орбиталь:
5В*: 1s22s12p2
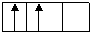 |
2р

| |
Для образования трех одинаковых связей В–Н необходима гибридизация одного 2s и двух 2р-орбиталей – sp2-гибридизация с образованием трех гибридных орбиталей, расположенных в одной плоскости под углом 120о относительно друг друга:

Образованные гибридные орбитали перекрываются с s-орбиталями атома водорода с образованием трех s-связей:

Молекула ВН3 имеет плоское треугольное строение.
Для определения полярности связей В-Н необходимо сравнить значения ОЭО атомов В и Н; ОЭО(В) = 2,0; ОЭО(Н) = 2,1. Поскольку электроотрицательность водорода больше, то связь В–Н будет полярной. Однако в целом молекула ВН3 не обладает полярностью, так как полярность связей В–Н, направленных к вершинам правильного треугольника, взаимно компенсируется.
Таким образом, в образовании молекулы ВН3 принимают участие s-орбитали атома Н и sp2-гибридные орбитали бора. Молекула ВН3 не полярна, хотя содержит три полярные s-связи, имеет плоскую треугольную структуру. Атом В находится в состоянии sp2-гибридизации.
Пример 2.3. Используя значения относительной электроотри-цательности атомов, расположите соединения HF, HCl, HBr, HI в порядке возрастания ионности связи. К какому из соединяющихся атомов смещено электронное облако и почему?
Р е ш е н и е
О степени ионности связи можно судить на основе разности относительных электроотрицательностей атомов:
ОЭО: Н – 2,1; F – 4; Cl – 3,0; Br – 2,8; I – 2,5.
Связь: HF HCl HBr HI
DОЭО: 1,9 0,9 0,7 0,4
Следовательно, в порядке возрастания ионности связей указанные молекулы можно расположить в ряд: HI – HBr – HCl – HF; электронная плотность при образовании химической связи смещается к более электроотрицательному атому. Поэтому в HF электронная плотность смещена к F; в HCl – к Cl; в HBr – к Br; в HI – к I.
Пример 2.4. В указанном комплексном соединении определите степени окисления всех составляющих, укажите комплексообра-зователь, лиганды, ионы внешней и внутренней сфер и координационное число, заряд комплексообразователя.
Запишите уравнение диссоциации данного комплексного соединения. Назовите это соединение.
Р е ш е н и е
Решение рассмотрим на примере 2-х комплексных соединений: Na[Co(SCN)4(H2O)2] и [Fe(NH3)5(NO2)]Cl2.
Сначала проанализируем состав комплексного соединения. В комплексном соединении содержится сложный комплексный ион, который показан в квадратных скобках. Комплексный ион состоит из комплексообразователя и лигандов. Комплексообразователь записывается первым в квадратной скобке, а далее следуют лиганды. Лигандами могут быть как заряженные частицы: I  , Cl
, Cl  , F
, F  , NO
, NO  , NO
, NO  , OH
, OH  , CN
, CN  , SCN
, SCN  , так и нейтральные молекулы: Н2О, NH3. Количество лигандов вокруг комплексообразователя называется его координационным числом.
, так и нейтральные молекулы: Н2О, NH3. Количество лигандов вокруг комплексообразователя называется его координационным числом.
Комплексообразователь и лиганды связаны прочной ковалентной связью донорно-акцепторного типа. Комплексный ион является ионом внутренней сферы. Снаружи располагаются ионы внешней сферы. Ионы внешней и внутренней сферы связаны ионной связью.
Если сложный комплексный ион заряжен отрицательно, т.е. является анионом, то ион внешней сферы записывается слева, и комплекс называется анионным. Если комплексный ион заряжен положительно, т.е. представляет из себя катионный комплекс, то ион внешней сферы записывается справа. В некоторых соединениях ионы внешней сферы отсутствуют, тогда внутренняя сфера имеет нулевой заряд, такие комплексы называются нейтральными.
Учитывая степень окисления комплексных ионов (в первом соединении – [Co(SCN)4(H2O)2]1-, а во втором – [Fe(NH3)5NO2]2+), определяем, что первое соединение содержит анионный, а второе – катионный комплекс. Вокруг комплексообразователя Со3+ расположены лиганды: (SCN) 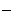 и (Н2О)0, их число равно 6, а вокруг Fe3+ – лиганды (NH3)0 и (NO2)–, их число также равно 6. Ионами внешней сферы в указанных соединениях являются ионы Na+ и Cl
и (Н2О)0, их число равно 6, а вокруг Fe3+ – лиганды (NH3)0 и (NO2)–, их число также равно 6. Ионами внешней сферы в указанных соединениях являются ионы Na+ и Cl 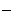 соответственно. Исходя из вышесказанного, данные комплексные соединения могут быть представлены следующими схемами (рис. 2.1, 2.2).
соответственно. Исходя из вышесказанного, данные комплексные соединения могут быть представлены следующими схемами (рис. 2.1, 2.2).
Дата добавления: 2018-02-18; просмотров: 3128; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
