Взаимодействие кислоты с породами призабойной зоны пласта
Расчет тепловых эффектов реакции
Количество выделенной или поглощенной в результате реакции теплоты называют тепловым эффектом процесса. Так как тепловой эффект реакции зависит от температуры и давления, то условились его приводить для стандартных условий: температура 25 °С (298 или точнее 298,15 К) и давление Р = 101 325 Па 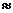 101,3 кПа. В термохимических уравнениях также указывается состояние веществ: кристаллическое (к), жидкое (ж), газообразное (г), растворенное (р) и др. Тепловой эффект принято обозначать ΔН, выражать в килоджоулях (кДж) и относить к тому количеству вещества (молей), которое определено уравнением реакции. Знаки тепловых эффектов считаются положительными у эндотермических процессов (теплота поглощается, ΔН > 0) и отрицательными у экзотермических процессов (теплота выделяется, ΔН < 0).
101,3 кПа. В термохимических уравнениях также указывается состояние веществ: кристаллическое (к), жидкое (ж), газообразное (г), растворенное (р) и др. Тепловой эффект принято обозначать ΔН, выражать в килоджоулях (кДж) и относить к тому количеству вещества (молей), которое определено уравнением реакции. Знаки тепловых эффектов считаются положительными у эндотермических процессов (теплота поглощается, ΔН > 0) и отрицательными у экзотермических процессов (теплота выделяется, ΔН < 0).
Смысл теплового эффекта реакции ΔН заключается в том, что каждое вещество обладает определенной энтальпией (энергосодержанием). Энтальпия является мерой энергии, накапливаемой веществом при его образовании (обозначается энтальпия латинской буквой Н). Тепловой эффект реакции при постоянном давлении ΔН представляет собой разность энтальпий конечных продуктов реакции (обозначается Нкон) и исходных реагирующих веществ (обозначается Нисх), т.е.
ΔН = Нкон - Нисх (7.33)
|
|
|
Если все конечные продукты реакции и исходные вещества находятся в стандартных состояниях (Т = 298 К, Р = 101,3 кПа), то ΔН называют стандартной энтальпией процесса и обозначают ΔН°298 ими только с верхним индексом ΔН0.
Приводим расчет теплового эффекта на примере взаимодействия соляной кислоты с известняком:
СаСО3(кр) + 2НСl(Ж) = СаС12(кр) + Н20(ж) + СO2(г). (7.34)
Термодинамические величины для простых веществ и неорганических соединений [254] следующие.
Исходные вещества:
ΔН°298 (СаСО3)= - 1206,87 кДж/моль;
ΔН°298 (HCl)= - 92,311 кДж/моль.
Конечные продукты:
ΔН°298 (CaCl2)= - 795 кДж/моль;
ΔН°298 (Н2O)= - 285,838 кДж/моль;
ΔН°298 (СO2)= - 393,511 кДж/моль.
Отсюда ΔН°298 = - 1474,349 + 1391,492= -82,857;
ΔН°298 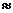 - 82,9 кДж/моль (ΔН < 0).
- 82,9 кДж/моль (ΔН < 0).
Так как АН°298 < 0, то реакция является экзотермической, т.е. протекает с выделением тепла.
В таблице 7.1 приведены рассчитанные тепловые эффекты.
Таблица 7.1
Значения тепловых эффектов химических реакций
| Химическая реакция | Тепловой эффект, кДж/моль |
| 2HCl + СаСО3 ↔ СаС12 +Н20 + СO2; | -82,9 |
| 4HCl + СаМg(СО3)2 ↔ СаС12 + МgС12 + 2Н2O + 2СO2 | -105,9 |
| СаС03 + 2HF ↔ CaF2 + Н20 + С02 | -149,85 |
| 4HCl + СаМg(СO3)2 ↔ СаС12 + МgС12 + Н20 + 2СO2 | -283,2 |
|
|
|
Как следует из таблицы, все эти реакции проходят с выделением тепла.
Расчет изобарно-изотермического потенциала
Изобарно-изотермический потенциал Z, применяющейся при рассмотрении процессов, происходящих при постоянной температуре и давлении, проще называют изобарным потенциалом, свободной энергией Гиббса или свободной энтальпией. Он определяется уравнением:
Z = H - TS, (7.35)
где H - энтальпия системы (тепловая функция Гиббса);
S - энтропия системы.
Изменение Z для процессов, происходящих при постоянной температуре, определяется соотношением
ΔZ = ΔH -TΔS. (7.36)
Изменение изобарного потенциала при стандартных состояниях связано с константой равновесия. Наиболее просто константа равновесия связана с изменением изобарно-изотермического потенциала, когда концентрации (точнее, активности) каждого из веществ (например, в реакции А + В ↔ С + D) равны единице.
Изменение потенциала, отвечающее условиям Р = 0,1 МПа (1 атм), t = 25 °С, называется стандартным. Оно обозначается ΔZ° (или ΔG°) и связано с константой равновесия:
|
|
|
ΔZ° = -R·T·lnK·(Kc или Kр), (7.37)
где R - газовая постоянная,
Т - абсолютная температура,
К – константа равновесия.
Индекс (с) указывает на то, что состав равновесной смеси выражен через мольные концентрации соответствующих веществ, (р) означает, что константа равновесия выражена через развесные парциальные давления.
Константа равновесия может быть определена измерением концентраций (са, сb, сс и cd) в равновесном состоянии. Кроме того, справочные данные по величинам ΔZ° реакций образования для большого числа веществ во многих случаях позволяют рассчитать по ним ΔZ° интересующей реакции и, следовательно, константу равновесия, Не производя эксперимента.
Основные термодинамические функции - внутренняя энергия, энтропия, изохорный и изобарный потенциалы, энтальпия и другие отражают в совокупности влияние всех особенностей внутреннего строения вещества и условий его существования. Поэтому, используя изобарный потенциал реакции (т.е. разность значений изобарно-изотермических потенциалов между продуктами и реагентами), можно количественно вычислить направление и глубину протекания той или иной химической реакции:
|
|
|
когда ΔZ (ΔG) < 0 или ΔZ (ΔG) << 0, т.е. имеет отрицательное значение, и при, том большое, то при всех условиях реакция возможна только в прямом направлении - слева направо;
если ΔZ (ΔG) > 0 или ΔZ (ΔG) >> 0, т.е. положительна и велика, реакция неосуществима или возможна только в обратном направлении - справа налево;
когда ΔZ (ZG) = 0, система находится в равновесии.
Для подавляющего большинства реакций можно считать «порогом» реакционной способности веществ значение ΔZ (или ΔG) 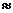 10 ккал/моль.
10 ккал/моль.
Иначе говоря, если ΔZ (или ΔG) < - 10 ккал/моль или, наоборот, ΔZ0 (или ΔG) > -10 ккал/моль, то в первом случае процесс принципиально осуществим, а во втором нет, причем не только в стандартных условиях, но и в любых реальных.
Приведен расчет изобарно-изотермического потенциала на примере взаимодействия соляной кислоты с известняком:
СаСО3 + 2HCl = CaCl2 + Н2O + СO2, (7.38)
ΔZ° 298 = ΔZ° 298 прод - ΔZ° 298 исх (7.39)
Термодинамические величины для простых веществ и неорганических соединений [254] следующие.
Исходные вещества:
ΔZ° 298 (СаСО3) = -1128,75 кДж/моль;
ΔZ° 298 (HCl) = -95,265 кДж/моль.
Конечные продукты:
ΔZ° 298 (CaCl2) = -750,2 кДж/моль;
ΔZ° 298 (H2O) = -237,19 кДж/моль;
ΔZ° 298 (CO2) = -394,38 кДж/моль.
Отсюда ΔZ° 298 = (ΔZ° 298 CaCl2 + ΔZ° 298 H2O + ΔZ° 298 CO2) -( ΔZ° 298 CaCO3 + 2ΔZ° 298 HCl).
ΔZ° 298 = -443,51 кДж/моль.
Вывод: если ΔZ< 0, т.е. имеет большое отрицательное значение то при всех условиях реакция возможна только в прямом направлении – слева направо.
Через соотношение ΔZ = ΔН - ТΔS можем рассчитать критическую температуру, выше которой процесс невозможен. Нам известны из этого соотношения: изобарно-изотермическиий потенциал (ΔZ), а также энтальпия (ΔН), рассчитанные ранее для данной реакции. Следует рассчитать энтропию (ΔS), являющуюся мерой связанной энергии дли системы. По данным [254] находим S для каждого вещества.
Исходные вещества:
S°298 (CaCО3) = 92,8 Дж/(моль·К);
S°298 (HCl) = 186,677 Дж/(мольК).
Конечные продукты:
S°298 (CaCl2) = 113,8 Дж/(моль·К);
S°298 (H2O) = 69,94 Дж/(моль·К);
S°298 (СO2) = 213,65 Дж/(моль·К).
Рассчитываем ΔS°298 = (S°298 CaCl2 + S°298 H2O + S°298 CO2) - (S°298 CaCO3 + +2S°298 HCl);
S°298 = -118 Дж/(моль·К) = -0,118 кДж/(моль·К).
Теперь рассчитываем температуру:
ΔZ = ΔН - ТΔS;
ΔZ =-82,9+ 0,1187Т.
При ΔZ = 0 система находится в равновесии, поэтому
8,9 + 0,1187Т = 0;
Т = 702,5 К.
Таким образом, данная реакция протекает слева направо с образованием хлористого кальция (CaCl2) до температуры 703 К.
В табл. 7.2 приведены изобарно-изотермические потенциалы для основных реакций.
Таблица 7.2
Значение изобарно-изотермических потенциалов химических реакций
| Химическая реакция | Изобарно- изотермический | Температура протекания реакции, К |
| 2HCl + СаСO3 ↔ CaCl2 +Н2O + СO2; | -443,5 | 703 |
| 4HCl + СаМg(СO3)2 ↔ CaCl + MgCl + +2Н2O + 2СO2 | -3,71 | 786 |
| СаСO3 + 2HF ↔ CaF2 + Н2O + СO2 | -123,3 | 1 714 |
| 4HCl + СаМg(СO3)2 ↔ CaCl2 + MgCl2 + + Н2O + 2СO2 | -235,2 | 1 781 |
Из таблицы следует, что все рассмотренные реакции протекают слева направо во всем диапазоне температур, имеющихся в пластовых условиях [256].
Дата добавления: 2018-02-18; просмотров: 356; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
