Расчеты и анализ результатов опыта
Белорусский государственный университет
информатики и радиоэлектроники
Кафедра химии
Отчет по лабораторной работе № 1
«Кинетика физико-химических процессов.
Химическое равновесие»
| Выполнил(а): Студент(ка) 1-го курса Группы №__________________ ФИО ______________________ ___________________________ ___________________________ | Проверила: _________________ |
Минск
2012
Цель работы: изучить влияние различных факторов на скорость и равновесие физико-химических процессов.
Экспериментальная часть
1. Зависимость скорости реакции от концентрации реагирующих веществ
Ход и данные опыта
Для наблюдения зависимости скорости реакции от концентрации реагирующих веществ используем реакцию взаимодействия раствора иодата калия KIO3 (раствор А) с раствором сульфита натрия Na2SO3 (раствор Б) в присутствии серной кислоты и крахмала (индикатора на свободный йод):

или в ионной форме
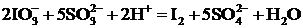 .
.
Реакция проводится при постоянной температуре (комнатной), постоянной концентрации иодата калия и переменной концентрации сульфита натрия.
Приготовим раствор Б различных концентраций в соответствии с табл.1. Поместим в одну пробирку 20 капель раствора А, в другую-20 капель раствора Б. Сольем содержимое пробирок и отметим время появления признака реакции (синей окраски).Затем в аналогичном порядке выполним остальные варианты опытов и данные внесем в табл. 1. Вычислим относительную скорость реакции (1/t, с-1) и занесем в табл. 1.
|
|
|
| Таблица 1. | |||||
| Номер стакана | Объём, мл | Относительная концентрация раствора Б (нормальность) | Время | Относительная скорость реакции V = 1/t, с-1 | |
| Раствор Б | Дистил. вода | ||||
| 1 | 10 | 0 | 0,02 | ||
| 2 | 10 | 5 | 0,0133 | ||
| 3 | 10 | 10 | 0,01 | ||
| 4 | 10 | 15 | 0,008 | ||
| 5 | 10 | 20 | 0,0066 | ||
Расчеты и анализ результатов опыта
1. Начертим график зависимости скорости реакции от концентрации реагирующих веществ, откладывая по оси абсцисс относительную концентрацию раствора сульфита натрия, по оси ординат – относительную скорость реакции.
| Место для графика |
Рисунок 1. ____________________________________________________
__________________________________________________________________
2. Объясните, почему при повышении концентрации сульфита натрия изменяется (увеличивается или уменьшается) скорость исследуемой реакции? С чем это связано? _____________________________________________
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
3. Какой кинетический закон устанавливает зависимость скорости реакции от концентрации реагирующих веществ? Запишите его выражение для исследуемой реакции. Подтверждает ли полученный в опыте результат выполнение этого закона для исследуемой реакции?_______________________
|
|
|
_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
1.3. Вывод (о влиянии концентрации веществ на скорость реакции).
____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Зависимость скорости реакции от температуры
Ход и данные опыта
Для изучения зависимости скорости реакции от температуры использовали реакцию окисления щавелевой кислоты (H2C2O4) перманганатом калия (KMnO4) в присутствии серной кислоты. Уравнение реакции имеет вид
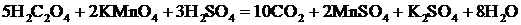
или в ионной форме
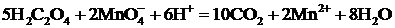 .
.
Реакция проводилась при постоянной концентрации реагирующих веществ и переменной температуре (табл. 2.).
Поместим в 4 пробирки по 20 капель раствора щавелевой кислоты, в другие 4 пробирки поместим по 20 капель KMnO4 и 20 капель концентрированной H2SO4. Нагреем содержимое пробирок до температур, указанных в табл.2, сольем их и отметим время обесцвечивания растворов. Запишем в таблицу данные опыта. Относительную скорость реакции определим как 1/τ и результаты внесем в табл. 2.
|
|
|
| Таблица 2. | |||
| Номер опыта | Температура t, °C | Время от начала реакции до конца, τ, с | Относительная скорость реакции V = 1/t, с-1 |
| 1 | 30 | ||
| 2 | 40 | ||
| 3 | 50 | ||
| 4 | 60 | ||
Расчеты и анализ результатов опыта
1. Запишем правило Вант-Гоффа. ________________________________
Рассчитаем температурный коэффициент в интервалах: 30 – 40 °С ( 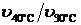 ),
),  (
(  ),
),  (
( 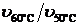 ), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?
), вычислим его среднее значение (γср). Выполняется ли для исследуемой реакции правило Вант‑Гоффа? От каких факторов зависит численное значение γ ?
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
2. Построим график зависимости скорости реакции от температуры, отложив по оси абсцисс температуру, по оси ординат – относительную скорость.
|
|
|
| Место для графика |
Рисунок 2. ___________________________________________________
__________________________________________________________________
Какой вид имеет полученная зависимость?________________________
__________________________________________________________________
3. Объясните, почему при увеличении температуры увеличивается скорость исследуемой реакции. Как это связано с изменением числа активных частиц ?___________________________________________________________
____________________________________________________________________________________________________________________________________Запишите уравнение Аррениуса_______________________________________
__________________________________________________________________
2.3. Вывод (о влиянии температуры на скорость реакции).____________
________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Дата добавления: 2018-02-18; просмотров: 400; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
