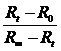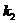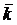Фотометрическое изучение кинетики разложения комплексного иона триоксалата марганца
Фотометрическое измерение применимо для исследования скорости химических реакций в тех случаях, когда исходное вещество окрашено иначе, чем смесь продуктов реакции.
Так распад комплексного иона 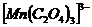 , окрашенного в коричневый цвет, протекает по уравнению:
, окрашенного в коричневый цвет, протекает по уравнению:
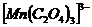 g
g 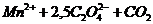 .
.
Продукты распада бесцветны.
Механизм сложен, но зависимость скорости реакции от времени подчиняется уравнению первого порядка.
Оптическая плотность окрашенного раствора пропорциональна концентрации, поэтому константу скорости при данной температуре можно рассчитать по уравнению:
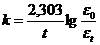 ,
,
где 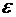 - оптическая плотность раствора в начальный момент и в момент времени
- оптическая плотность раствора в начальный момент и в момент времени  .
.
Цель работы: Определить порядок реакции, константу скорости, период полураспада и энергию активации разложения комплексного иона триоксалата марганца.
Исходные растворы: 0,01 М  ;
;
0,1 М 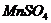 ;
;
0,1 М  .
.
Измерение оптической плотности ведется на колориметре фотоэлектронном КФК-2 с синим светофильтром.
Методика измерений по инструкции к прибору.
Ход работы.
1. Приготовить прибор.
2. Смешать растворы 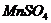 и
и  в соотношении 1 : 7.
в соотношении 1 : 7.
3. Прибавить к 4-м частям бесцветной смеси одну часть раствора  . Быстро образуется коричневая комплексная соль.
. Быстро образуется коричневая комплексная соль.
4. Поместить комплексную соль в 10 мм кювету и начать измерения.
За начало опыта принять первое измерение (включить секундомер). Измерять через 1, 2 и 4 мин. Закончить измерения, когда оптическая плотность снизится до 0,1.
Во избежание нагрева раствора держать закрытыми шторки на пути лучей между измерениями.
Результаты оформить в виде таблицы.
| Время | 
| 
| 
|
Построить график в координатах  – t.
– t.
Повторить опыт при t + 10°, или t - 10° и рассчитать энергию активации (см. предыдущую работу).
Кондуктометрический метод изучения кинетики взаимодействия этилацетата с гидроксильными ионами.
Теоретические основы.
Омыление этилацетата в щелочных водных растворах протекает по уравнению
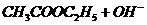 ž
ž 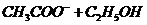
Реакция протекает с измеримой скоростью при обычной температуре и может быть изучена методом измерения электропроводности раствора.
В начале реакции проводниками электрического тока являются ионы 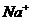 и
и 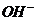 , а по окончании – ионы
, а по окончании – ионы  и
и 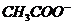 , т.е. более подвижные ионы
, т.е. более подвижные ионы 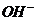 заменяются менее подвижными
заменяются менее подвижными 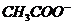 сопротивление
сопротивление  раствора растет.
раствора растет.
Реакция протекает бимолекулярно в разбавленном водном растворе практически до конца.
Для реакций второго порядка
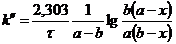 (3.1),
(3.1),
где 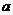 - начальная концентрация первого вещества,
- начальная концентрация первого вещества,  - начальная концентрация второго вещества,
- начальная концентрация второго вещества,  - количество вещества, вступившее в реакцию к моменту времени
- количество вещества, вступившее в реакцию к моменту времени  от начала опыта.
от начала опыта.
Если начальные концентрации одинаковы, т.е. 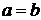 , то после интегрирования уравнение принимает более простой вид:
, то после интегрирования уравнение принимает более простой вид:
 (3.2).
(3.2).
Уравнение для удельной теплопроводности  смеси электролитов имеет вид:
смеси электролитов имеет вид:
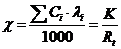 (3.3),
(3.3),
где 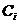 - концентрация
- концентрация  -го иона,
-го иона,  - подвижность
- подвижность  -го иона,
-го иона,  -
-  сосуда,
сосуда, 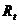 - измеренное сопротивление раствора.
- измеренное сопротивление раствора.
Электропроводность 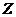 раствора, равная
раствора, равная 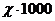 , связана с концентрацией уравнением
, связана с концентрацией уравнением
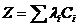 (3.4)
(3.4)
Применяя уравнение (3.4) для реакционной смеси, получим одновременно три уравнения.
Первое – для начала реакции, когда в растворе присутствуют только ионы 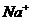 и
и 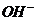 . В этом случае электропроводность
. В этом случае электропроводность  соответствует электропроводности
соответствует электропроводности 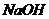 начальной концентрации:
начальной концентрации:
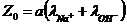 .
.
Второе уравнение для конца реакции, когда в растворе присутствуют только ионы 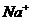 и
и 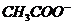 ; здесь
; здесь
 .
.
Третье уравнение для электропроводности раствора ко времени  , когда в растворе находятся все три иона.
, когда в растворе находятся все три иона.
 .
.
Величину  для разбавленных растворов можно выразить через
для разбавленных растворов можно выразить через  ,
,  и
и  :
:
 ;
;
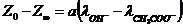 , откуда
, откуда
 (3.5).
(3.5).
Заменяя 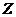 измеренными значениями сопротивления
измеренными значениями сопротивления  ,
,  ,
, 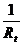 и
и  , получим уравнение для реакции второго порядка:
, получим уравнение для реакции второго порядка:
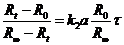 или
или
 (3.6).
(3.6).
Экспериментальная часть.
Цель работы: Определение порядка реакции, константы скорости, энергии активации и предэкспоненциального множителя при омылении этилацетата едким натром.
Приборы и реактивы: электролитическая ячейка для проведения кондуктометрических измерений, реохордный мост.
Растворы: 100 мл 0,01 н  и 100 мл 0,05 н
и 100 мл 0,05 н 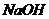 , 0,2 М
, 0,2 М 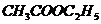 (1,762 г / 100 мл).
(1,762 г / 100 мл).
Ход работы.
j В чистый сосуд для измерения электропроводности ввести 2 мл 0,05 н 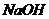 + 8 мл
+ 8 мл  . Вставить промытые, сухие электроды и после термостатирования (15 мин) при 25°С измерить
. Вставить промытые, сухие электроды и после термостатирования (15 мин) при 25°С измерить 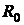 .
.
k Измерить 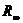 0,01 М
0,01 М  .
.
l В сухой сосуд влить из бюретки 4 мл 0,05 н 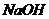 , 15 мл
, 15 мл  , вставить электроды, термостатировать 15 мин. Затем добавить 1 мл 0,2 М этилацетата, перемешать и отметить по секундомеру момент смешивания растворов как время начала реакции.
, вставить электроды, термостатировать 15 мин. Затем добавить 1 мл 0,2 М этилацетата, перемешать и отметить по секундомеру момент смешивания растворов как время начала реакции.
m Измерять 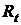 через 1, 2, 4, 6, 10, 15, 20 мин после смешивания.
через 1, 2, 4, 6, 10, 15, 20 мин после смешивания.
n Результаты записать в таблицу по форме:
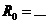 ,
, 
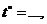
| Время |
|
|
|
| |
| по часам | от начала опыта  , мин , мин
| ||||
o Повторить эксперимент при другой температуре.
p Обработать результаты эксперимента:
a) Рассчитать константу скорости по уравнению (3.6).
b) Рассчитать константу скорости графически по кривой зависимости 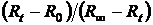 от времени
от времени  .
.
c) Энергию активации 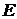 и предэкспоненциальный множитель
и предэкспоненциальный множитель 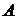 найти графически по длине отрезка
найти графически по длине отрезка  и углу
и углу 
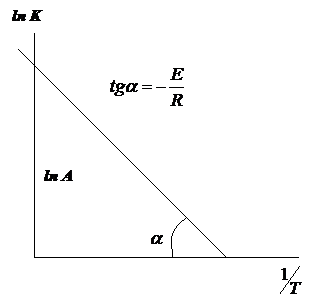 |
Уравнение Аррениуса:
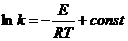 или
или 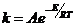 .
.
Дата добавления: 2018-02-18; просмотров: 3915; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!

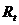 , Ом
, Ом