Ионы металлов - стабилизаторы молекулы субстрата
Для некоторых ферментов субстратом служит комплекс превращаемого вещества с ионом металла. Например, для большинства киназ в качестве одного из субстратов выступает не молекула АТФ, а комплекс Mg2+-ATФ. В этом случае ион Mg2+ не взаимодействует непосредственно с ферментом, а участвует в стабилизации молекулы АТФ и нейтрализации отрицательного заряда субстрата, что облегчает его присоединение к активному центру фермента
Схематично роль кофактора при взаимодействии фермента и субстрата можно представить как комплекс E-S-Me, где Е - фермент, S - субстрат, Me - ион металла.
Ионы металла - стабилизаторы активного центра фермента
В некоторых случаях ионы металла служат "мостиком" между ферментом и субстратом. Они выполняют функцию стабилизаторов активного центра, облегчая присоединение к нему субстрата и протекание химической реакции. В ряде случаев ион металла может способствовать присоединению кофермента. Перечисленные выше функции выполняют такие металлы, как Mg2+, Mn2+, Zn2+, Co2+, Мо2+. В отсутствие металла эти ферменты активностью не обладают. Такие ферменты получили название "металлоэнзимы". Схематично данный процесс взаимодействия фермента, субстрата и металла можно представить следующим образом:
E-Me-S
2. Роль металлов в стабилизации третичной
и четвертичной структуры фермента
Ионы металлов обеспечивают сохранение вторичной, третичной, четвертичной структуры молекулы фермента. Такие ферменты в отсутствие ионов металлов способны к химическому катализу, однако они нестабильны. Их активность снижается и даже полностью исчезает при небольших изменениях рН, температуры и других незначительных изменениях внешнего окружения. Таким образом, ионы металлов выполняют функцию стабилизаторов оптимальной конформации белковой молекулы.
3. Роль металлов в ферментативном
катализе
Не менее важную роль отводят ионам металлов в осуществлении ферментативного катализа.
Участие в электрофильном катализе
Наиболее часто эту функцию выполняют ионы металлов с переменной валентностью, имеющие свободную d-орбиталь и выступающие в качестве электрофилов. В ходе электрофильного катализа ионы металлов часто участвуют в стабилизации промежуточных соединений.
Участие в окислительно-восстановительных реакциях
Ионы металлов с переменной валентностью могут также участвовать в переносе электронов. Например, в цитохромах (гемсодержащих белках) ион железа способен присоединять и отдавать один электрон:
Благодаря этому свойству цитохромы участвуют в окислительно-восстановительных реакциях.
4. Роль металлов в регуляции активности
ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы С, катализирующего реакции фосфорилирования белков . Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов .
Б. Коферменты
Как уже было сказано, для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (например, протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
- производные витаминов;
- гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
- нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
- убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
- фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
- S-аденозилметионин (SAM) - донор метильной группы;
- глутатион, участвующий в окислительно-восстановительных реакциях.
В. Мультисубстратные реакции
Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если кофермент не является простетической группой, его также можно рассматривать как ещё один субстрат. Следовательно, участников ферментативной реакции может быть несколько: непосредственно фермент, несколько субстратов и кофермент.
В этих случаях механизм ферментативной реакции, как правило, может идти по одному из двух путей: по механизму "пинг-понг" (механизму двойного замещения) или последовательному. Рассмотрим оба механизма.
1. Механизм "пинг-понг"
Схематично механизм "пинг-понг" может быть представлен следующим образом:
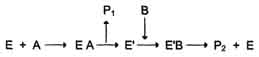
Субстрат А, взаимодействуя с ферментом (Е), превращается в продукт (Р1). Фермент остаётся в результате этого преобразования не в нативной форме, а в изменённой (Е') в результате модификации кофермента. Далее к активному центру Е' присоединяется субстрат В, подвергающийся преобразованию в продукт (Р2) с высвобождением нативной формы фермента (Е).
Последовательный механизм
В случае последовательного механизма для протекания ферментной реакции требуется одновременно взаимодействие двух субстратов. В этом случае возможно присоединение субстратов двумя различными путями:
· Механизм упорядоченного взаимодействия субстрата с активным центром фермента:
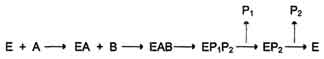
· Первым в активный центр фермента присоединяется субстрат А, облегчая присоединение субстрата В. После химической модификации также наблюдают определённый порядок высвобождения продуктов реакции.
· Механизм случайного взаимодействия субстрата с активным центром фермента:

Приоритетности за взаимодействие субстратов А и В в активном центре фермента нет (каждый субстрат имеет свой центр связывания в активном центре). Также нет строгой закономерности высвобождения продуктов реакции.
Примером последовательного упорядоченного механизма может быть реакция дегидрирования с участием коферментов NAD+, NADP+.
Оба кофермента функционируют как посредники переноса двух электронов и одного протона от донора к акцептору, другого протона - в среду .
Донор и акцептор не обязательно участвуют в одном метаболическом пути. Другими словами, восстановленная форма этих нуклеотидов действует как общий пул электронов, образованный в результате окислительных реакций, и может быть использована в различных восстановительных реакциях. Такие реакции называют сопряжёнными .
Дата добавления: 2018-02-18; просмотров: 1885; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
