Болезнь оживленного организма
Особенности сердечно-легочной реанимации у детей
Особенности сердечно-легочной реанимации у детей разных возрастов, рекомендованные Европейским советом по реанимации, были опубликованы в ноябре 2005 года в трех зарубежных журналах: Resuscitation, Circulation и Pediatrics.
Теперь рассмотрим неотложные мероприятия при наступлении клинической смерти.
Диагностировать клиническую смерть можно по следующим признакам:
отсутствует дыхание, отсутствует кровообращение (не определяется пульс на сонной артерии), отмечается расширение зрачков (нет их реакции на свет), сознание не определяется, рефлексы отсутствуют.
Если диагностирована клиническая смерть нужно:
Зафиксировать время, когда наступила клиническая смерть и время начала проведения реанимации;
Подать тревогу, позвать на помощь реанимационную бригаду (один человек не в состоянии оказать реанимацию качественно);
Оживление нужно начинать немедленно, не тратя время на аускультацию, измерение артериального давления и выяснения причин терминального состояния.
Последовательность реанимационных мероприятий у детей в общих чертах сходна с таковой у взрослых, но при проведении мероприятий по поддержанию жизни у детей (ABC) особое внимание уделяется пунктам А и В. Если реанимация взрослых основана на факте первичности сердечной недостаточности, то у ребенка остановка сердца это финал процесса постепенного угасания физиологических функций организма, инициированного, как правило, дыхательной недостаточностью. Первичная остановка сердца очень редка, фибрилляция желудочков и тахикардия являются ее причинами менее чем в 15% случаев. Многие дети имеют относительно длинную фазу предостановки, что и определяет необходимость ранней диагностики данной фазы.
|
|
|
Педиатрическая реанимация слагается из двух этапов.
Восстановление проходимости дыхательных путей (ДП) у пациентов с потерей сознания направлено на уменьшение обструкции, частой причиной которой является западение языка. Если тонус мышц нижней челюсти достаточный, то запрокидывание головы вызовет движение нижней челюсти вперед и откроет дыхательные пути.
При отсутствии достаточного тонуса, запрокидывание головы нужно сочетать с выдвижением вперед нижней челюсти.
Однако у детей грудного возраста существуют особенности выполнения этих манипуляций:
· не следует чрезмерно запрокидывать голову ребенка;
· не следует сжимать мягкие ткани подбородка, так как это может вызвать обструкцию дыхательных путей.
После освобождения дыхательных путей необходимо проверить, насколько эффективно дышит пациент: нужно присматриваться, прислушиваться, наблюдать за движениями его грудной клетки и живота. Часто восстановления проходимости дыхательных путей и ее поддержания бывает достаточно для того, чтобы пациент в последующем дышал эффективно.
|
|
|
Особенность проведения искусственной вентиляции легких у детей раннего возраста определяется тем, что маленький диаметр дыхательных путей ребенка обеспечивает большое сопротивление потоку вдыхаемого воздуха. Для минимизации повышения давления в воздухоносных путях и предупреждения перерастяжения желудка вдохи должны быть медленными, а частота дыхательных циклов определяется возрастом.
| ПОКАЗАТЕЛИ | До 1 месяца | До 1 года | 1 – 8 лет | Старше 8 лет | |||
| Начальные вдохи | 2 эффективных вдоха по 1 секунде каждый | 2 эффективных вдоха по 1-1,5 секунды каждый | 2 эффективных вдоха по 1-1,5 секунды каждый | 2 эффективных вдоха по 2 секунды каждый | |||
| Последующие вдохи в минуту | 20 | 15 | 10-15 | 10 | |||
| Устранение обструкции дыхательных путей | Похлопывание по спине (4раза), надавливание на грудную клетку (4 раза) в положении с опущенным головным концом | Прием Хаймлиха (6-10 раз), реже похлопывание по спине (4 раза) и надавливание на грудную клетку (4 раза)
| |||||
Достаточный объем каждого вдоха – это объем, обеспечивающий адекватные движения грудной клетки. Убедиться в адекватности дыхания, наличии кашля, движений, пульса. Если присутствуют признаки циркуляции – продолжить дыхательную поддержку, если циркуляции нет – начать непрямой массаж сердца. У детей до года, оказывающий помощь, своим ртом плотно и герметично захватывает нос и рот ребенка, у старших детей реанимирующий предварительно двумя пальцами зажимает нос пациента и своим ртом накрывает его рот.
В детской практике остановка сердца обычно вторична по отношению к обструкции дыхательных путей, которую чаще всего вызывают инородное тело, инфекция или аллергический процесс, приводящие к отеку дыхательных путей. Очень важна дифференциальная диагностика между обструкцией дыхательных путей, вызванной инородным телом, и инфекцией. На фоне инфекции действия по удалению инородного тела опасны, так как могут привести к ненужной задержке в транспортировке и лечении пациента. У пациентов без цианоза, с адекватной вентиляцией следует стимулировать кашель, нецелесообразно использовать искусственное дыхание. Методика устранения обструкции дыхательных путей, вызванной инородным телом, зависит от возраста ребенка. Очистку пальцем верхних дыхательных путей вслепую у детей не рекомендуют использовать, так как в этот момент можно протолкнуть инородное тело глубже. Если инородное тело видно, его можно удалить, используя зажим Келли или пинцет Меджила. Надавливание на живот не рекомендуют применять у детей до года, поскольку при этом существует угроза повреждения органов брюшной полости, особенно печени. Ребенку в этом возрасте можно оказать помощь, удерживая его на руке в позиции «всадника» с головой, опущенной ниже туловища.
|
|
|
Голову ребенка поддерживают рукой вокруг нижней челюсти и грудной клетки. По спине между лопатками быстро наносят четыре удара проксимальной частью ладони. Затем ребенка укладывают на спину так, чтобы голова пострадавшего была ниже туловища в течение всего приема и выполняют четыре надавливания на грудную клетку. Если ребенок слишком крупный, чтобы поместить его на предплечье, его помещают на бедре так, чтобы голова находилась ниже туловища. После очистки дыхательных путей и восстановления их свободной проходимости при отсутствии спонтанного дыхания начинают искусственную вентиляцию легких. У детей старшего возраста или взрослых при обструкции дыхательных путей инородным телом рекомендуют использовать прием Хеймлиха – серию субдиафрагмальных надавливаний.
Неотложная крикотиреотомия – один из вариантов поддержания проходимости дыхательных путей у больных, которым не удается интубировать трахею. Как только дыхательные пути освобождены и выполнено два пробных дыхательных движения, необходимо установить, была ли у ребенка только остановка дыхания или одновременно была и остановка сердца – определяют пульс на крупных артериях. У детей до года пульс оценивается на плечевой артерии, т. к. короткая и широкая шея младенца делает затруднительным быстрый поиск сонной артерии. У детей старшего возраста, как и у взрослых, пульс оценивается на сонной артерии.
Когда у ребенка определяется пульс, но нет эффективной вентиляции, проводится только искусственное дыхание. Отсутствие пульса является показанием к проведению искусственного кровообращения с помощью закрытого массажа сердца. Закрытый массаж сердца никогда не должен выполняться без искусственной вентиляции. Рекомендуемая область сдавления грудной клетки у новорожденных и грудных детей – на ширину пальца ниже пересечения межсосковой линии и грудины. У детей до года используют две методики выполнения закрытого массажа сердца: – расположение двух или трех пальцев на груди.
– охватывание грудной клетки ребенка с формированием ригидной поверхности из четырех пальцев на спине и использование больших пальцев для выполнения компрессий. Амплитуда компрессий составляет примерно 1/3-1/2 от переднезаднего размера грудной клетки ребенка.
ВОЗРАСТНЫЕ ПАРАМЕТРЫ ПРОВЕДЕНИЯ ЗАКРЫТОГО МАССАЖА У ДЕТЕЙ
| ПОКАЗАТЕЛИ | До 1 месяца | До 1 года | 1 – 8 лет | Старше 8 лет | |||||
| Область сдавления грудной клетки | Нижняя половина грудины на ширину пальца ниже пересечения межсосковой линии и грудины | Нижняя треть грудины | |||||||
| Метод компрессии | Метод обхватывания двумя пальцами или массаж двумя пальцами | Ладонной поверхностью одной руки | Ладонной поверхностью (участвуют две руки) | ||||||
| Частота компрессии | Приблизительно 120 в минуту | Не менее 100 в минуту | 100 в минуту | 100 в минуту | |||||
| Компрессии/вентиляция | 15/2---2 реаниматора, 30/1 --- 1 реаниматор | ||||||||
Если ребенок большой и три пальца не создают адекватной компрессии, то для проведения закрытого массажа сердца нужно использовать проксимальную часть ладонной поверхности кисти одной или двух рук. Скорость компрессий и соотношение их к дыханию зависит от возраста ребенка. Механические приборы для компрессии грудной клетки интенсивно использовались у взрослых, но не у детей в связи с очень большим количеством осложнений.
Прекардиальный удар никогда не следует применять в педиатрической практике. У старших детей и взрослых его рассматривают как необязательный прием, когда у пациента отсутствует пульс, а дефибриллятор быстро использовать невозможно.
Последовательность сердечно-легочной реанимации:
1. Начинается реанимация непрямым массажем сердца не зависимо от возраста. Особенно это касается, если проводит реанимацию один человек. Сразу рекомендуют 30 компрессий подряд до начала искусственной вентиляции.
Если реанимацию проводят люди без специальной подготовки, то делается только массаж сердца без попыток искусственного дыхания. Если реанимацию проводит команда реаниматологов, то закрытый массаж сердца делается одновременно с искусственным дыханием, избегая пауз (без остановок).
Сжатия грудной клетки должны быть быстрыми и жесткими, у детей до года на 2 см, 1-7 лет на 3 см, старше 10 лет на 4 см, у взрослых на 5 см. Частота сжатий у взрослых и детей до 100 раз в минуту.
У младенцев до одного года массаж сердца проводится двумя пальцами (указательным и безымянным), с 1-го года до 8-ми лет одной ладонью, старшим детям двумя ладонями. Место компрессии — нижняя треть грудины.
2. Восстановление проходимости дыхательных путей (airways).
Необходимо очистить дыхательные пути от слизи, выдвинуть нижнюю челюсть вперед и вверх, незначительно запрокинуть голову назад (при травме шейного отдела это делать противопоказано), под шею кладут валик.
3. Восстановление дыхания (breathing).
На догоспитальном этапе проводится ИВЛ методом “изо рта в рот и нос” — у детей до 1-го года, “изо рта в рот” — у детей старше 1 года.
Соотношение частоты дыхания к частоте толчков:
Если проводит реанимацию один спасатель, то соотношение 2:30;
Если проводят реанимацию несколько спасателей, то вдох делают каждые 6-8 секунд, не прерывая массаж сердца.
Существенно облегчает ИВЛ введение воздуховода или ларенгиальной маски.
На этапе врачебной помощи для ИВЛ используют ручной дыхательный аппарат (мешок Ambu) или наркозный аппарат.
Интубация трахеи должна быть с плавным переходом, дышим маской, а потом интубируем. Интубация проводится через рот (оротрахеальной способ), или через нос (назотрахеальный способ). Какому способу дать предпочтение зависит от заболевания и повреждений лицевого черепа.
4. Введение медикаментов.
Медикаменты вводятся на фоне продолжающихся закрытого массажа сердца и ИВЛ.
Путь введения желательно — внутривенный, при невозможности — эндотрахеальный или внутрикостный.
При эндотрахеальном введении доза препарата увеличивается в 2-3 раза, разводится препарат на физиологическом растворе до 5-ти мл и вводится в интубационную трубку через тонкий катетер.
Внутрикостно иглу вводят в большеберцовую кость в ее переднюю поверхность. Может использоваться игла для спинальной пункции с мандреном или костномозговая игла.
Внутрисердечное введения у детей сейчас не рекомендуют, из за возможных осложнений (гемиперикард, пневмоторакс).
При клинической смерти используют такие лекарственные средства:
Адреналина гидротартат 0,1% р-р в дозе 0,01мл/кг (0,01 мг/кг). Препарат можно вводить каждые 3 минуты. На практике разводят 1 мл адреналина физиологическим раствором
9 мл (получается общий объем 10 мл). Из получившего разведения вводят 0,1 мл/кг. Если отсутствует эффект после двукратного введения дозу увеличивают в десять раз
(0,1 мг/кг).
Раньше вводили 0,1% р-р атропина сульфата 0,01 мл/кг (0,01 мг/кг). Теперь его не рекомендуют при асистолии и электромех. диссоциации в связи с отсутствием терапевтического эффекта.
Введение гидрокарбоната натрия раньше было обязательным, в настоящее время только по показаниям (при гиперкалиемии или тяжелом метаболическом ацидозе).
Доза препарата 1 ммоль/кг массы.
Препараты кальция не рекомендуются. Назначаются только, когда остановка сердца вызвана передозировкой антагонистами кальция, при гипокальциемии или гиперкалиемии. Доза CaCl2 — 20 мг/кг
5. Дефибрилляция.
Хочется отметить, что у взрослых дефибрилляция относится к первоочередным мероприятиям и должна начинаться одновременно с закрытым массажем сердца.
У детей фибрилляция желудочков встречается около 15% от всех случаев остановок кровообращения и поэтому применяется реже. Но если фибрилляция диагностирована, то ее надо проводить как можно быстрее.
Различают механическую, медикаментозную, электрическую дефибриляции.
К механической дефибриляции относится прекардиальный удар (удар кулаком по грудине). Сейчас в педиатрической практике не используется.
Медикаментозная дефибриляция заключается в применении антиаритмичных препаратов – верапамила 0,1-0,3 мг/кг (не более 5 мг однократно), лидокаина (в дозе 1 мг/кг).
Электрическая дефибриляция является самым эффективным методом и важнейшим компонентом сердечно-легочной реанимации.
Рекомендуется проводить электрическую дефибриляцию сердца из трех разрядов
(2Дж/кг – 4 Дж/кг – 4 Дж/кг). Если нет эффекта, то на фоне продолжающихся реанимационных мероприятий можно проводить вторую серию разрядов снова начиная с 2Дж/кг.
Во время проведения дефибриляции нужно отключить ребенка от диагностической аппаратуры и респиратора. Электроды размещают — один справа от грудины ниже ключицы, другой левее и ниже левого соска. Обязательно между кожей и электродами должен быть солевой раствор или крем.
Реанимацию прекращают только после появления признаков биологической смерти.
СЕРДЕЧНОЛЕГОЧНАЯ И ЦЕРЕБРАЛЬНАЯ РЕАНИМАЦИЯ У ЛИЦ ПОЖИЛОГО И СТАРЧЕСКОГО ВОЗРАСТА
Исходы СЛР, конечно, значительно хуже у лиц пожилого и старческого возраста, чем у молодых. Это обусловлено целым рядом инволюционных изменений в организме, связанных с его старением. Так, отмечается развитие атрофии вещества мозга, что, в свою очередь, обусловливает снижение церебрального кровотока и коллатерального кровообращения в вилизиевом круге, а при высоком системном давлении — недостаточность ауторегуляции мозгового кровообращения. Снижение количества нейронов и, как следствие, снижение активности ЦНС.
Для пожилых лиц и стариков характерна выраженная ригидность грудной клетки, а также снижение податливости и эластичности легких, сужение и спадение бронхиол, расширение альвеол, потеря перегородок, уменьшение объема дыхания и легочного резерва.
Со стороны сердечнососудистой системы отмечается уменьшение массы миокарда и его сократительной способности, снижение сердечного индекса и сердечного резерва, за счет системного атеросклероза развитие систолической гипертензии, предрасположенность к ишемии.
Изменения функции почек в виде уменьшения массы и числа функционирующих клубочков, уменьшения клубочковой фильтрации, замедления канальцевой секреции, уменьшения общего содержания воды в организме, что приводит к клеточной дегидратации, уменьшению мышечной массы и перерождению ее в жировую.
К другим особенностям относят снижение уровня обменных процессов (на 1 % с каждым годом жизни после 30 лет), нарушение терморегуляции, сопутствующие болезни, часто с хроническим и атипичным течением, социальнопсихологическая дезадаптация. Остановка кровообращения чаще развивается постепенно как конечный этап сердечной недостаточности, в связи с чем легче очертить показания и противопоказания. Отмечается более высокая вероятность переломов ребер и грудины. В связи с этим во избежание переломов грудины не следует располагать ладони слишком близко к нижнему ее концу. Перед началом проведения реанимационных мероприятий необходимо удалить зубные протезы при их наличии. У пожилых людей длительность клинической смерти короче, так как необратимые изменения возникают быстрее. Сердечную деятельность можно восстановить, однако возникают необратимые изменения в ЦНС, в связи с чем в постреанимационном периоде они тяжелее возвращаются к нормальной жизни. Так, уровень выживаемости после проведения сердечнолегочной и церебральной реанимации в зависимости от возраста составляет: < 10 лет — 73,9 %, 11–70 лет — 28,5–30,2 %, > 70 лет — до 12,2 % [1].
СЕРДЕЧНОЛЕГОЧНАЯ И ЦЕРЕБРАЛЬНАЯ РЕАНИМАЦИЯ У БЕРЕМЕННЫХ
Во время беременности отмечаются существенные физиологические изменения. Со стороны сердечнососудистой системы характерно увеличение объема циркулирующей крови (ОЦК) на 50 % и сердечного выброса на 35–40 %, снижение сосудистого сопротивления за счет расслабления гладкой мускулатуры сосудов под влиянием гормонов беременности (эстрогена, прогестерона). При беременности более 20 недель в горизонтальном положении на спине сдавление маткой нижней полой вены и аорты ведет к снижению венозного возврата к сердцу и уменьшению сердечного выброса (опасность аортокавальной компрессии) [9].
Для беременных характерно повышение потребности в кислороде на 20–30 %, учащение дыхания вследствие смещения диафрагмы вверх с увеличением минутного объема вентиляции, умеренный дыхательный алкалоз (рH — 7,50; pСO2 — 27–31 мм рт.ст.). Уменьшение функциональной остаточной емкости (ФОЕ) легких на 10–15 %, а также уменьшение комплайенса грудной клетки, обусловленное ростом внутрибрюшного давления, что повышает риск развития отека легких, а смещение трахеи кпереди, в свою очередь, затрудняет интубацию. Для беременных характерна высокая частота трудной интубации трахеи, составляющая 1 : 250 случаев [10]. Сочетание повышенной потребности в О2 и сниженной функциональной остаточной емкости легких ведет к быстрой гипоксии в cлучае остановки дыхания [9].
Расслабление гладкой мускулатуры кишечника за счет увеличения уровня эстрогена и прогестерона замедляет подвижность кишечника и опорожнение желудка, а также расслабляет кардиальный сфинктер, обусловливая высокий риск аспирации желудочного содержимого, особенно во время проведения реанимации. Для беременных характерно уменьшение рН желудочного сока, что усиливает его повреждающее действие на легкие, формируя синдром Мендельсона [9].
Увеличение матки к lму триместру беременности вызывает смещение желудка, кишечника и легких, снижение артериального давления (АД) < 80 мм рт.ст. и обусловливает неадекватную перфузию матки вследствие снижения плацентарного кровотока и уменьшения эмбрионального кислородонасыщения, что может приводить к патологическому состоянию плода, эмбриональной асфиксии и внутриутробной смерти.
Причинами внезапной остановки кровообращения у беременных являются:
— наличие сопутствующих заболеваний сердечнососудистой системы (легочная гипертензия, кардиомиопатия, инфаркт миокарда, аневризма аорты с расслоением, острый коронарный синдром);
— тромбоэмболия;
— гипертония беременных;
— внематочная беременность;
— кровотечение (преждевременная отслойка плаценты, предлежание плаценты, разрыв матки);
— эмболия околоплодными водами;
— сепсис;
— причины, не связанные с беременностью (анафилаксия, отравление, травма).
Летальность у беременных по международным данным составляет 1 : 20 000 (Marelli A.J. et al., 2009) — 1 : 30 000 (Lewis G., 2007), при этом около 2/3 смертей, связанных с беременностью, происходят во время родов или в раннем послеродовом периоде [11].
Необходимо подчеркнуть, что до срока гестации 22–24 недели комплекс СЛЦР проводится согласно базовым рекомендациям у взрослых. После этого срока проведение комплекса СЛЦР осложняется вследствие анатомофизиологических особенностей, характерных для беременности, и имеет свои особенности [9].
Комплекс СЛР у беременных должен базироваться на следующих принципах [12]:
— базовые реанимационные мероприятия согласно универсальному алгоритму дальнейшего поддержания жизни (ALS);
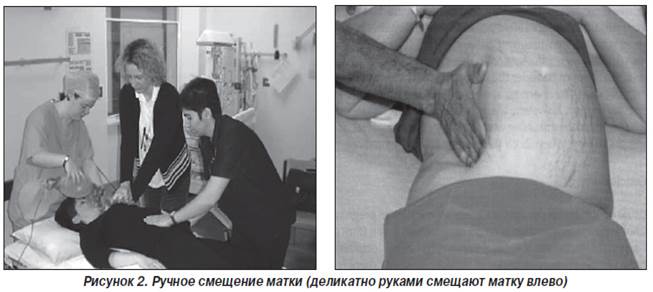
— перед проведением компрессии грудной клетки необходимо ручным методом сместить матку влево для уменьшения аортокавальной компрессии (рис. 2);
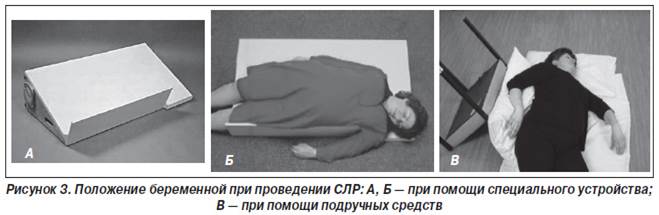
— либо расположить валик под правое бедро женщины, либо использовать импровизированное или специальное приспособление (рис. 3) для обеспечения наклона матки к левому бедру под углом 15–30;
— при проведении компрессии требуется усилий больше, чем обычно, изза сниженного комплайенса грудной клетки;
— немедленно вызвать в помощь врачаакушера и неонатолога;
— руки при проведении наружного массажа сердца следует располагать выше на грудине, чем в обычных условиях, в связи со смещением маткой диафрагмы и органов брюшной полости кверху.
Необходимо помнить, что успешная реанимация матери — залог выживания плода [9].
При проведении дефибрилляции необходимо убрать руки проводящего ручное смещение матки, удалить любое внутреннее устройство контроля жизнедеятельности плода, которое могло бы подвести к нему электричество. В случае рефрактерной к дефибрилляции фибрилляции желудочков после третьего неэффективного разряда дефибрилляции необходимо ввести адреналин, что повышает эффективность дефибрилляции и увеличивает плацентарный кровоток. При беременности нет ограничений в применении антиаритмических средств [12].
Согласно европейским и американским рекомендациям по СЛЦР, если в течение 4–5 минут реанимационные мероприятия безуспешны, необходимо рассмотреть возможность выполнения реанимационного кесарева сечения и извлечения плода в течение 60 секунд. При этом приоритет всегда отдается жизни матери. Данное очень важное положение необходимо всесторонне обсудить и ввести в нормативные приказы по оказанию медицинской помощи в Украине. Так, на фоне продолжения проведения СЛЦР необходимо решить следующие вопросы [12]:
— при сроке беременности < 20 недель реанимационное кесарево сечение не показано;
— при сроке беременности 20–23 недели — проведение экстренной гистеротомии без сохранения жизни ребенка;
— при сроке беременности 24–25 недель — проведение экстренной гистеротомии с сохранением жизни матери и ребенка;
При беременности более 22 недель извлечение плода в условиях проведения СЛР обеспечит уменьшение аутокавальной компрессии, что, в свою очередь, увеличит венозный возврат крови к сердцу и сердечный выброс, на 25–56 % увеличится ОЦК. Уменьшится сдавление легких диафрагмой, что позволит увеличить вентиляцию легких, а также повысится эффективность компрессии грудной клетки за счет уменьшения ее сопротивления [9].
При этом необходимо отметить, что, как показали результаты анализа, несмотря на то, что процедуры по спасению жизни матери первичны, у младенцев отмечался более высокий уровень выживаемости при извлечении их в течение 5 минут с момента остановки кровообращения у матери. Причем было показано, что раннее извлечение ребенка при остановке кровообращения у матери связано с улучшением исхода как для матери, так и для ребенка
болезнь оживленного организма
Понятие болезни оживленного организма это сама постреанимационная болезнь.
Постреанимационная болезнь.
Возникающие в постреанимационном периоде нарушения функций органов и тканей наслаиваются на проявления основной болезни, вызвавшей клиническую смерть. При этом постреанимационные нарушения нередко выражены более интенсивно, чем изменения, связанные с основным заболеванием. Такие расстройства проявляются преимущественным поражением той или иной физиологической системы в виде определенных синдромов.
1. Аноксическая энцефалопатия — повреждение головного мозга вследствие тяжелого кислородного голодания — одна из основных причин гибели больных в постреанимационном периоде. В основе этого поражения мозга лежат его отек и набухание, возникающие вследствие гипоксии, повышения проницаемости сосудов и выхода жидкости из сосудов в ткань мозга. Возникают распространенные ишемические повреждения головного мозга, заканчивающиеся гибелью нейронов и распадом волокон белого вещества. Эти нарушения развиваются преимущественно в коре большого мозга и мозжечке. Тяжелые повреждения коры приводят к резкому угнетению, а в дальнейшем и к выпадению ее функций — децеребрации, Это состояние называется "мозговой смертью", ибо необратимая децеребрация при работающем сердце означает гибель человека как социального существа, так как только функции головного мозга определяют психическую деятельность и индивидуальность человека. Наряду с этим децеребрация обычно заканчивается прекращением дыхания.
Если при сохраненной сердечной деятельности происходит остановка дыхания и длительное время используется искусственная вентиляция легких, могут развиваться еще более глубокие повреждения головного мозга — "респираторный мозг". Наблюдается смещение мозга в результате его деформации при отеке и набухании, образование очагов распада нервной ткани. Возможен также частичный некроз ткани мозга, чаще всего это симметричный некроз подкорковых образований. В крайне тяжелых случаях возникает некроз всего головного мозга. Вещество его приобретает характер бесструктурной полужидкой массы, заключенной в мозговые оболочки. Рефлекторная деятельность ЦНС отсутствует, нет собственного дыхания, исчезает биоэлектрическая активность мозга. Мозговой кровоток резко нарушен или полностью выключен, хотя сердечная деятельность может сохраняться длительное время. 13 конечном итоге наступает остановка сердца. Необратимая децеребрация, а тем более тотальный некроз головного мозга несовместимы с жизнью.
2. Сердечно-легочный синдром часто возникает после реанимации даже при отсутствии тяжёлых поражений головного мозга. Он проявляется несогласованностью функций сердца и лёгких. Поражения сердца в постреанимационном периоде связаны с белковой и жировой дистрофией миокарда, гибелью групп кардиомиоцитов. Эти расстройства возникают вследствие гипоксии миокарда и его перегрузки по причине нарушения кровообращения в малом круге. Гипоксия ткани лёгких в постреанимационном периоде обусловливает нарушение микроциркуляции, развитие тромбозов, ателектазов. На этом фоне вследствие длительного применения искусственной вентиляции легких в них нередко развиваются бронхопневмония, абсцессы и др. Закупорка мелких бронхов слизью и клеточным детритом, повреждение альвеолокапиллярных мембран, бронхопневмония приводят к недостаточности газообменной функции легких.
3. Печеночно-почечный синдромвозникает в постреанимационный период вместе с аноксической энцефалопатией и сердечно-легочным синдромом, усугубляя их течение. Недостаточность функции печени и почек развивается в результате расстройств кровообращения. Наблюдаются застой крови в системе воротной вены, диффузная белковая и жировая дистрофия гепатоцитов, очаги некроза в печени наряду с резким нарушением микроциркуляции. В почках возникают ишемия и очаги некроза. Особенно тяжелые расстройства функции почек наблюдаются при распаде большой массы скелетных мышц, который появляется при умирании и оживлении организма вследствие нарушения микроциркуляции и связанного с этим некроза мышц спины, плечевого пояса, ягодиц и бедер. Расплавление мышечных клеток (миолиз) приводит к появлению в плазме крови белка мышц — миоглобина и выделению его почками. В результате этого возникает закупорка канальцев этим белком, некротизированным эпителием канальцев и нарушается выделительная функция почек (миоглобинурийный нефроз). Недостаточность печени и почек способствует накоплению в крови токсичных продуктов обмена веществ, изменению КЩР и ионного равновесия, белкового состава крови, что усугубляет течение энцефалопатии и сердечно-легочной недостаточности.
4. Желудочно-кишечный синдром в постреанимационном периоде встречается реже, чем другие расстройства. Вследствие нарушения общего кровообращения, застоя крови в портальной системе и расстройств микроциркуляции в желудке и двенадцатиперстной кишке могут возникать кровоточащие эрозии и язвы. Возможно прободение язвы желудка или кишечника с развитием гнойного перитонита. В последние годы в постреанимационном периоде в тонкой кишке все чаще обнаруживаются обширные некрозы с геморрагическим пропитыванием, в основе которых лежит тромбоз венул, распространяющийся на крупные сосуды, вплоть до воротной вены.
В последние годы число осложнений реанимации и постреанимационного периода значительно снизилось. Это стало возможным в результате распространения опыта реаниматологов, проведения интенсивной терапии специалистами высокой квалификации, совершенствования реанимационных мероприятий.
Постреанимационная болезнь возникает у больного, перенесшего состояние клинической смерти и оживленного благодаря комплексу реанимационных мероприятий: характеризуется нарушением функций жизненно важных органов и систем организма. От 20% до 40% людей, переживших остановку сердца, реанимируют лишь 50% госпитализированных переживают постреанимационный период.
Цель работы - изучить патофизиологические аспекты болезней оживленного организма, причины их возникновения и механизмы развития. Был выполнен обзор научной медицинской литературы.
Основные повреждения организма происходят из-за ишемии всего тела дополнительно органы и ткани поражаются вследствие нарушения реперфузии.
Оба этих механизма усиливаются механическими повреждениями органов (вследствие аварии и при оказании первой помощи), а также заболеваниями, которые есть у пострадавшего.
Основные компоненты постреанимационного синдрома – это повреждение головного мозга, дисфункция миокарда, системная ишемия/нарушение реперфузии, тромбозы.
Постаноксическая энцефалопатия часто приводит к смерти на ранних стадиях заболевания. Области наибольшего повреждения головного мозга - выборочные субпопуляции нейронов в коре, гиппокампе, мозжечке, полосатом теле и таламусе. Дисфункция миокарда часто приводит к смерти на поздних стадиях заболевания. Системная ишемия, даже после восстановления кровотока, в связи с недостаточным метаболизмом, может привести к полиорганной недостаточности, которая, в итоге, может вызвать смерть пациента.
Постреанимационная болезнь – специфическое состояние организма, возникающее после успешных реанимационных мероприятий. Вызывается временной тотальной ишемией тканей и синдромом восстановления кровотока. Проявляется выраженным увеличением концентрации ферментов крови, гипоперфузией, уменьшением ОЦК, развитием диссеминированного внутрисосудистого свертывания, полиорганной недостаточностью. Диагностируется по наличию соответствующей симптоматики и остановки кровообращения в недавнем прошлом. Специфическое лечение включает гормоны, кардиотоники, инфузии солевых растворов и компонентов крови, противоишемические и ноотропные лекарственные средства.
Общие сведения
Впервые постреанимационная болезнь (ПРБ) как самостоятельная нозологическая единица была описана советским ученым, членом АМН В. А. Неговским в 1979 году. Труды других специалистов расширили и укрепили знания о патологии, тем самым упрочив в медицинском мире позиции реаниматологии как науки. Согласно статистической информации, более половины больных, перенесших сердечно-легочную смерть (СЛР), умирает от острой недостаточности кровообращения или изменений в головном мозге, вызванных глобальной ишемией. Выживаемость после успешных СЛР-мероприятий, по данным разных источников, составляет от 29 до 40%. Постреанимационная болезнь возникает в первые часы после восстановления перфузии, протекает 7-10 дней. Прогноз для жизни ухудшается пропорционально времени от остановки сердца до начала реанимационных мероприятий.
Причины
ПРБ развивается под действием нескольких патогенетических факторов, воздействующих на пациента, подвергшегося клинической смерти. Комплексное негативное влияние на ослабленный болезнью организм приводит к значительным изменениям в работе органов и ферментативных систем, что может послужить причиной гибели больного. К числу наиболее важных этиофакторов формирования ПРБ относятся:
· Тотальная ишемия. Длительное недостаточное поступление O2 потенцирует отмирание части клеток. В первую очередь происходит поражение головного мозга (постреанимационная энцефалопатия) как структуры, наиболее чувствительной к гипоксии. Наблюдается спазм сосудов, компенсаторная тахикардия, уменьшается сердечный выброс, что усугубляет кислородное голодание. Происходят изменения в тканях миокарда, скелетной мускулатуре. Начинаются процессы миолиза с выделением в кровь продуктов распада мышц.
· Синдром реперфузии. В условиях гипоксии ткани выходят на анаэробный режим гликолиза, клетки перенастраиваются на данный путь получения энергии. Резкое восстановление кровотока и поступление большого количества кислорода ведет к избыточному накоплению его токсичных форм, активации процессов апоптоза и некроза клеток.
· ДВС . Выявляется при шоковых состояниях, проявляется образованием в сосудистом русле микротромбов. Последние блокируют просвет капилляров, ухудшают микроциркуляцию в тканях, становятся причиной образования множественных мелких ишемических очагов. В дальнейшем это в сочетании с другими факторами провоцирует полиорганную недостаточности.
· Кровотечения. Возникают как отсроченный результат ДВС в момент, когда возможности системы гемостаза истощаются, концентрация факторов свертывания уменьшается. Состояние характеризуется практически полным отсутствием в плазме субстанций, ответственных за формирование тромба. Сопровождается развитием геморрагического синдрома.
· Метаболическая буря. После восстановления кровотока у больных отмечаются массивные изменения механизмов регуляции гомеостаза. Происходит закисливание внутренней среды со снижением pH ≤ 7,34, падает уровень электролитов, в том числе калия, кальция и прочих. При активном вливании натрия гидрокарбоната на этапе СЛР вместо ацидоза может определяться ятрогенный алкалоз. Выявляется уменьшение ОЦК за счет депонирования части крови в печени, скелетных мышцах, селезенке.
Патогенез
Патогенез основывается на изменениях, наступающих в результате остановки кровообращения. У больного развивается ОПН, вторичный септический шок, недостаточность дыхания и ССС, сбои в работе рецепторных структур. На вскрытии определяют дистрофические изменения в почках, в легких часто присутствуют признаки двухсторонней многоочаговой пневмонии. Здесь же выявляют большое количество миоглобина. В тканях обнаруживают кровоизлияния различной степени тяжести. Головной мозг может содержать отмершие участки, что свидетельствует о возникновении ишемического инсульта. При церебральной смерти (декортикация) отмечаются необратимые изменения ствола, шейных сегментов, коры больших полушарий.
Классификация
Постреанимационная болезнь систематизируется по стадиям, каждая из которых соответствует времени, прошедшему с момента восстановления кровотока. Согласно классификации Е.С. Златокрылиной от 1999 года, существует 5 основных этапов прогрессирования ПРБ. Все они характеризуются определенными трансформациями в состоянии пациента. Различают следующие фазы развития патологических изменений:
· Этап №1. Протекает на протяжении 6-8 часов со времени реанимационных мероприятий. Отмечается выраженное снижение тканевой перфузии (в 4-5 раз меньше нормы). Присутствуют явления циркуляторной гипоксии – состояния, возникающего при недостаточном давлении в капиллярах.
· Этап №2. Наступает к 10-12 часу болезни. Отмечается относительная стабилизация функций организма, временное улучшение состояния. Имеет место дефицит объема циркулирующей крови, тканевый кровоток снижен в 2-3 раза. Увеличиваются потери электролитов, преимущественно K+. Стадия имеет важное прогностическое значение, позволяет с высокой долей вероятности определить дальнейшее течение и исход патологического состояния.
· Этап №3. Наблюдается со вторых суток болезни. Замедляется фибринолитическая активность плазмы, формируется смешанная гипоксия, обусловленная изменением свойств гемоглобина и развитием респираторного дистресс-синдрома. Возникают первые признаки микротромбоза капиллярной сети внутренних органов. Нарушения носят функциональный характер, необратимые процессы отсутствуют.
· Этап №4. Переломный момент в течении болезни. Наступает к 3-4 дню. Может характеризоваться общим улучшением состояния или дальнейшим прогрессированием патологических изменений. При неблагоприятном исходе усиливаются явления катаболизма, возникает интерстициальный отек легких, гидрогенизация головного мозга. Начинается генерализованный воспалительный ответ, обнаруживаются признаки недостаточности внутренних органов.
· Этап №5. Манифестирует к 5-7 суткам. Диагностируются объемные септические процессы: пневмонии, сепсис, внутренние абсцессы. Антибактериальная терапия неэффективна. Причина инфекции – угнетение иммунитета из-за длительной гипоксии. Максимально проявляется энцефалопатия токсического происхождения, усугубляется полиорганная недостаточность, в крови накапливаются продукты обмена веществ. Гибель пациента наступает спустя 1-5 дней. Причиной смерти становится поражение нескольких жизненно важных систем, инфекционно-токсический шок, сепсис.
Дата добавления: 2021-06-02; просмотров: 109; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
