В) сумме показателей степеней при концентрациях, входящих в кинетическое уравнение скорости реакции;
г) числу молекул, участвующих в элементарном акте химической реакции
104. Закон действующих масс выражает зависимость:
а)константы скорости реакции от концентрации веществ,
б) скорости реакции от температуры,
В) скорости реакции от концентрации реагирующих веществ,
г) скорости реакции от энергии активации
105. Физический смысл константы скорости химической реакции заключается в том, что она равна скорости реакции, если концентрации реагирующих веществ:
а) равны между собой, но не равны единице; в) не равны между собой;
б) равны между собой и равны единице; г) не равны нулю.
106. Как скорость реакции, так и константа скорости зависят от:
а) температуры реакции; в) времени реакции;
б) концентрации реагирующих веществ; г) формы реакционного сосуда.
107. В каких единицах может выражаться скорость химической реакции:
а) моль ×л-1 ×с-1; б) л×моль-1; в) с×моль-1; г) моль×л-1×мин
108. За время, равное 10 с, концентрация вещества А изменилась от 3,10 до 3,05 моль/л. Среднее значение скорости реакции по веществу А равно:
а) 0,003 моль·л –1·с –1; в) 0,005 моль·л –1·с –1;
б) 0, 300 моль·л –1·с –1; г) 0,500 моль·л –1·с –1
109. Для реакции А(ТВ) + В(Ж) = АВ(ТВ) укажите кинетическое уравнение:
а) 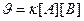 ; б)
; б) 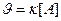 ; в)
; в) 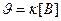 ; г)
; г) 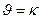
110. Уравнение 
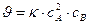 справедливо для реакции:
справедливо для реакции:
а) А2(г) + В(г) → D(г); в) 2А(тв) + В2(г) → D(г);
|
|
|
б) 2А(г) + В(тв) → D(г); г) 2А(г) + В(г) → D(г)
111. Укажите уравнение, используемое для расчета по молекулярности скорости прямой реакции в системе 4НС1(г)+О2(г) ↔ 2С12(г)+2Н2О(ж):
а) 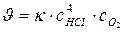 ; б)
; б) 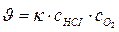 ; в)
; в) 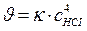 ;
; 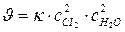
112. Укажите уравнение, используемое для расчета по молекулярности скорости прямой реакции в системе СО(г) + Сl2(г) ↔СОСl2(г);
а) 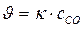 ; б)
; б) 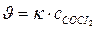 ; в)
; в) 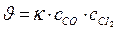 ; г)
; г) 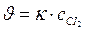
113. Скорость реакции 2СО(г) + О2(г) → 2СО2(г) при увеличении давления в системе в два раза:
а) увеличивается в 2 раза; в) увеличивается в 8 раз;
б) уменьшается в 2 раза; г) уменьшается в 8 раз
114. Скорость реакции не зависит от концентрации реагирующих веществ для реакций следующего порядка:
а) первого; б) нулевого; в) дробного; г) второго.
115. Константу скорости реакции первого порядка можно найти, построив график зависимости:
а) С = f ( t ); б) 1/С = f ( t ); в) ln С = f ( t ); г) С = f ( 1/t ).
116. Укажите кинетическое уравнение для реакции первого порядка:
а) 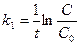 ; б)
; б) 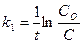 ; в)
; в) 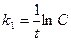 ;
; 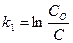
117. Период полупревращения это промежуток времени, в течение которого:
а) концентрация продукта реакции уменьшается в 2 раза;
Б) концентрация исходного вещества уменьшается в 2 раза;
в) концентрация продукта реакции в 2 раза превышает концентрацию исходного вещества;
|
|
|
г) концентрация исходного вещества в 2 раза превышает концентрацию продукта реакции.
118. Период полупревращения не зависит от начальной концентрации вещества для реакций следующего порядка:
а) первого; б) второго; в) дробного; г) третьего.
119. Укажите кинетическое уравнение для реакций второго порядка при равенстве концентраций исходных веществ:
а) 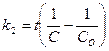 ; б)
; б) 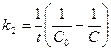 ; в)
; в) 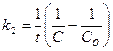 ; г)
; г) 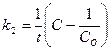
120. Константу скорости реакции второго порядка можно найти, построив график зависимости:
а) 1/С = f ( t ); б) С = f ( t ); в) ln С = f ( t ); г) С = f ( 1/t )
121. Период полупревращения для реакций второго порядка можно рассчитать по формуле:
а) 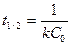 ; б)
; б) 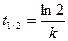 ; в)
; в) 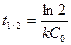 ; г)
; г) 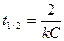
122. Разложение N2О5 является реакцией первого порядка, константа скорости которой равна 0,002 мин–1 при 3000С. Для разложения 80% N2О5 необходимо (ответ дать с точностью до целого):
а) 805 мин; б) 81 мин; в) 8 мин; г) 20 мин
123. Образование фосгена по уравнению СО + СI2 = СОСI2 является реакцией второго порядка, константа скорости которой 0,180 мин–1·(кмоль/м3). Чему равна концентрация фосгена через 1 час, если начальная концентрация его 0,5 кмоль/м3 (ответ дать с точностью до сотых):
а) 0, 41 кмоль/м3; б) 0, 46 кмоль/м3; в) 0,48кмоль/м3; г) 0,43 кмоль/м3
|
|
|
124. Превращение органического вещества (реакция первого порядка) при 600С прошло за 10 мин на 75,2%. Константа скорости данной реакции равна (ответ дать с точностью до сотых):
а) 0,17 с –1; б) 0,02 с –1; в) 0,14 с –1; г) 0,01 с –1
125. В некоторой реакции первого порядка половина вещества распадается за 100с. Для разложения 0,8 части первоначального количества необходимо (ответ дать с точностью до целого):
а) 233 с; б) 180 с; в) 420 с; г) 350 с
126. За какой промежуток времени инвертируется 50% раствора сахара концентрацией 0,3 моль/дм3 (реакция второго порядка; константа скорости реакции данной реакции 0,055 дм3·моль–1·мин–1)) (ответ дать с точностью до целого):
а) 15 мин; б) 18 мин; в) 12 мин; г) 13 мин
127. Период полупревращения органического вещества (реакция первого порядка; константа скорости реакции 0,14 мин–1) равен (ответ дать с точностью до целого):
а) 3 минуты; б) 8 минут; в)1 минута; г) 5 минут
128. Скорость реакции при повышении температуры на 200С (температурный коэффициент скорости реакции равен 3):
а) увеличивается в 3 раза; в) уменьшается в 3 раза;
б) увеличивается в 9 раз; г) увеличивается в 6 раз
129. При 1300С реакция заканчивается за 60 секунд (температурный коэффициент равен 2). Время (в секундах) окончания реакции при 1500С составит:
|
|
|
а) 15; б) 30; в) 20; г) 240
130. При 1300С реакция заканчивается за 60 секунд (температурный коэффициент равен 2). Время (в секундах) окончания реакции при 1100С составит:
а) 200; б) 120; в) 15; г) 240
131. Температурный коэффициент скорости реакции равен 2. При повышении температуры от 10 до 30°С скорость реакции, протекающей в газовой фазе, увеличится в:
а) 2 раза; б) 4 раза; в) 8 раз; г) 24 раза
132. Чему равен температурный коэффициент, если при нагревании реакционной смеси на 200С скорость реакции увеличилась в 9 раз:
а) 2; б) 3; в) 4; г) 5
133. При увеличении температуры на 300С скорость реакции возрастает в 8 раз. Температурный коэффициент реакции равен:
а) 1; б) 2; в) 3; г) 4
134. Как изменится скорость реакции при охлаждении реакционной смеси на 200С, если температурный коэффициент g равен 3:
а) уменьшится в 3 раза; в) увеличится в 3 раза;
б) уменьшится в 9 раз; г) увеличится в 9 раз.
135. Математическая запись уравнения Аррениуса выглядит следующим образом:
а) К(Т) = А·е ЕRT; б) К(T) = A· eE/RT; в) К( T) = A· e – E/ RT; г) К(T) = A· e –ERT
136. С каким значением энергии активации химическая реакция протекает медленнее:
а) 30 кДж/моль; б) 100 кДж/моль; в) 90 кДж/моль; г) 40 кДж/моль.
137. При каком температурном коэффициенте энергия активации наибольшая:
а) 1; б) 2; в) 3; г) 4
138. Энергию активации можно найти, рассчитав константу скорости реакции при двух различных температурах и построив график зависимости:
а) ln К = f ( Т ) ; б) К = f ( Т ) ; в) ln К = f (lnТ ) ; г) ln К = f ( 1/Т ).
139. К вторичным фотохимическим реакциям относятся все реакции в ряду:
а) гидратация, сенсибилизация, диссоциация;
б) фосфоресценция, дезактивация, гидратация;
Дата добавления: 2021-04-05; просмотров: 428; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
