Вычисление работы адиабатического расширения воздуха.
УГТУ-УПИ им. С. М. Кирова
кафедра физики
Отчёт
по лабораторной работе № 7
Определение отношения теплоёмкости газа при постоянном давлении к теплоёмкости при постоянном объёме.
Студент: Штин Алексей
Группа: Р-160
Дата: 20.05.21
г. Екатеринбург ã 1995
Некоторые сведения из теории.
Теплоемкостью тела называется физическая величина, числено равная количеству тепла, которое необходимо сообщить телу, чтобы повысить его температуру на 1 кельвин.
Теплоемкость единицы массы называется удельной теплоемкостью, а теплоемкость одного моля вещества - молярной теплоемкостью. Таким образом,
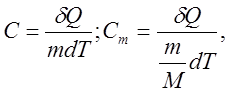 где C и Cm - удельная и молярная теплоемкости;
где C и Cm - удельная и молярная теплоемкости;
dQ - количество тепла, сообщенного телу;
dT - приращение температуры;
m - масса тела;
M - малярная масса.
Величина теплоемкости вещества в общем случае зависит от условий нагревания и температуры.
Выражение для молярной теплоемкости идеального газа при постоянном давлении имеет вид:
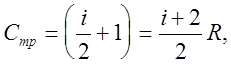 где i - число степеней свободы молекул газа;
где i - число степеней свободы молекул газа;
R - универсальная газовая постоянная.
Молярная теплоемкость равна
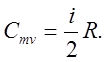 Из выражений следует, что отношение теплоемкости Cmp к теплоемкости Cmv равно
Из выражений следует, что отношение теплоемкости Cmp к теплоемкости Cmv равно
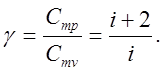
Величину g называют коэффициентом Пуассона или показателем адиабаты.
Целью настоящей работы является определение g воздуха весьма простым экспериментальным методом Клемана-Дезорма.
Метод Клемана-Дезорма.
|
|
|
|
Рис. A |
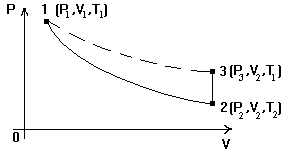
Метод Клемана-Дезорма по определению g базируется на измерении давления газа, заключенного в одном и том же сосуде и последовательно проходящего через три состояния: из первого во второй газ переходит адиабатически, из второго в третье - изохорически (рис. 1).
Расчетная формула для определения g имеет вид: 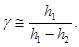
где h - высота столба жидкости.
Работа при адиабатическом процессе.
В данной работе также определяется работа при адиабатическом расширении газа на участке кривой 1-2 (рис. 1).
Адиабатическим называется процесс, происходящий баз теплообмена с окружающей средой.
Расчетная формула работы при адиабатическом расширении газа в рассматриваемом случае имеет вид:
| 1 |
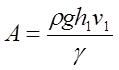
где V1 - первоначальный объем газа, который хотя и меньше объема баллона V2, но на небольшую величину. Поэтому при расчете работы за величину V1 принимают объем баллона. Величина r - плотность жидкости (воды) в манометре.
Описание установки. Порядок выполнения работы.
|
Рис. B |
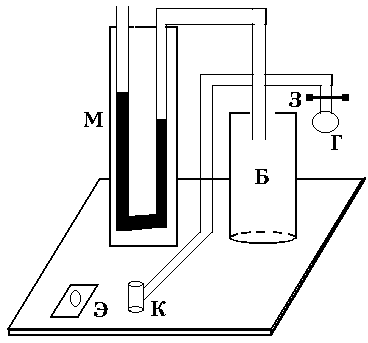
Установка (рис. 2) состоит из стеклянного баллона Б, U-образного манометра М, резиновой груши Г с зажимом Мора З и электроклапана К, который позволяет одновременно соединить баллон с атмосферой и электросекундомером. Одно колено житкостного (водяного) U-образного манометра открыто, а другое соединено с баллоном, поэтому когда баллон соединен с атмосферой, уровни жидкости в обоих коленах одинаковы. Резиновая груша служит для нагнетания воздуха в баллон.
|
|
|
Порядок выполнения работы
1. Прежде всего необходимо проверить, нет ли утечки воздуха из баллона. Для этого с помощью резиновой груши медленно нагнетают в баллон воздух до давления больше атмосферного. Давление измеряется по разности уровней в коленах манометра.
Так как при этом воздух в баллоне несколько нагревается, то следует подождать 5-6 минут, пока установится тепловое равновесие. После этого, если показания манометра не изменяются (нет утечки воздуха), записывают значение h1, соответствующее состоянию 1.
2. Затем нажимают клапан К, соединяя баллон с атмосферой; воздух при этом выходит из баллона со слабым свистом, и как только он прекратится, клапан закрывают.
Предполагается, что этот процесс соответствует адиабате 1-2 на рис. 1. Давление воздуха в баллоне к моменту закрытия клапана (состояние 2) равно внешнему атмосферному. Через некоторое время после закрытия клапана газ по изохоре перейдет в состояние 3 и, казалось бы, изменив состояние h2 по манометру, можно по формуле рассчитать g. Однако описанный способ является довольно грубым, что сказывается на точности определения g.
|
|
|
На самом деле это не так. Поэтому, учитывая неадиабатичность и, главное, неравновесность процесса между состояниями 1 и 2, мы получаем не значение h2, которое необходимо для расчета g, а некоторое другое значение h’2; при этом значение h’2 будет тем меньше, чем больше время t, в течение которого из баллона выпускается воздух. В предельном случае при большой выдержке t температуры вне и внутри баллона могут сравняться; и после закрытия клапана давление в баллоне не изменится, то есть h’2 будет равно 0.
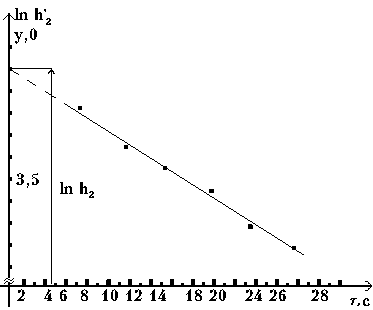
Установлено, что между h2 и h’2 достаточно хорошо выполняется следующая зависимость:
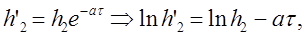
где a - константа, зависящяя от параметров установки и условий опыта;
t - время, в течение которого выпускается из баллона воздух (открыт клапан).
Эта формула позволяет по экспериментальным значениям h’2, полученным из опыта, определить h2, а затем и более точно рассчитать g.
|
Рис. C |
На рис. 3 представлен график зависимости из которого видно, что, повторив опыт несколько раз, (при одной и той-же величине h1) с различным временем, можно путем экстраполяции определить h2.
|
|
|
Таким образом, второй этап опыта (пункт 2) следует проверить в следующем порядке:
а) соединить баллон при помощи клапана К (на клапан нажимать резко и до упора) с атмосферой на 5 секунд, после чего клапан закрыть. Время определяется по секундометру;
б) выждать, пока давление перестанет меняться (2-3 минуты), и сделать отсчет разности уровней манометра h’2;
в) операции а) и б) повторить со временем t соединения баллона с атмосферой: 5, 9, 13, 17, 21, 25 с. При этом максимальное время t должно быть выбрано так, чтобы соответствующая ему разность уровней h’2 была значительно больше погрешности манометра.
Необходимо следить за тем, чтобы начальное превышение давления h1 в баллоне перед открытием клапана в каждом опыте было одно и то же. C этой целью исходное давление достигается осторожным нагнетанием воздуха в баллон грушей Г до тех пор, пока в монометре уровень жидкости не достигнет красной метки.
Вычисление работы адиабатического расширения воздуха.
Работа газа вычисляется по формуле (1). Значение показателя адиабаты * берется из эксперимента. Все величины, входящие в формулу (1) нужно выразить в СИ.
Дата добавления: 2021-06-02; просмотров: 194; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!