Расчеты по уравнениям реакций
Тема 26. Расчеты массовой доли химического соединения в смеси
Основные формулы и соотношения
Массовая доля вещества в растворе
 (1)
(1)
где: w – массовая доля вещества в %;
mвещества – масса вещества, г;
mраствора – масса раствора, г, в которой содержится mвещества.
Если не умножать на 100 %, то w – массовая доля вещества в долях единицы:
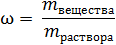 (2)
(2)
Пример: найти массу нитрата серебра, которая содержится в 255 г 25 %-ного раствора.
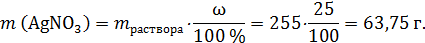
В задачах очень часто встречается не масса раствора, а плотность и объем раствора, тогда:
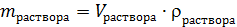
(3)
где: Vраствора – объем раствора, мл;
rраствора – плотность раствора, г/мл.
Пример: найти массу хлороводорода, которая содержится в 250 мл хлороводородной кислоты (плотностью 1,1 г/мл) с массовой долей 20 %.
Хлороводородная кислота – раствор хлороводорода в воде. Масса раствора:
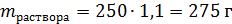
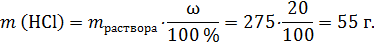
Здесь отметим, что не следует массу вещества рассчитывать сразу по общей формуле:

это
во-первых: не наглядно;
во-вторых: трудно проверять эксперту;
в-третьих: в 90 % случаев в ходе решения задачи понадобится масса раствора.
Понятие «растворимость»
Растворимость – это способность вещества растворяться в воде или другом растворителе. Растворимость зависит как от природы вещества и растворителя, так и от температуры. Например, при температуре 10°С растворимость KNO3 составляет 20 г соли на 100 г воды, а при температуре 50°С – уже 85 г соли на 100 г воды. Поэтому, говоря о растворимости, всегда приводят значение температуры.
|
|
|
Обычно (в том числе и в заданиях ЕГЭ) растворимость вещества – максимальное количество грамм этого вещества, которое при указанной температуре растворяется в 100 г растворителя (обычно воды). Больше вещества при данной температуре раствориться не может, т.е. растворимость показывает максимальную концентрацию вещества в растворе при данной температуре – концентрацию насыщенного раствора.
Рассмотрим на примере KNO3: возьмем 100 г воды и добавим к ней 100 г этой соли. При 10°С растворится только 20 г соли, 80 г не растворится, останется в виде кристаллов, масса раствора составит 20 + 100 = 120 г, а массовая доля соли в растворе составит
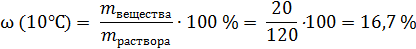
Это – массовая доля (в процентах) соли в насыщенном растворе при 10°С.
Если нагреть этот раствор с осадком до 50°С (растворимость при 50°С составляет 85 г соли на 100 г воды), то еще 65 г кристаллов соли растворится:
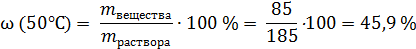
Это – массовая доля (в процентах) соли в насыщенном растворе при 50°С.
|
|
|
Если теперь охладить раствор до 10°С, из раствора выделится 65 г соли.
Задачи с термином «растворимость» появились в ЕГЭ в 2019 году, приведем примеры:
Пример: при комнатной температуре приготовили 216 г насыщенного раствора хлорида натрия, растворимость которого составляет 36 г на 100 г воды. Какая масса соли содержится в приготовленном растворе?
При решении задач 34 и 35, в которых приводится текст решения, рекомендую использовать простой ход решения – не подставлять одни формулы в другие, решать последовательно и т.п.
Рассчитаем массовую долю соли в насыщенном растворе:

Масса соли в 216 г раствора составит:

Пример: растворимость безводного сульфата меди при некоторой температуре составляет 72 г на 100 г воды. Какую массу медного купороса (CuSO4×5H2O) нужно добавить к 100 мл воды для получения насыщенного раствора.
Довольно часто в ЕГЭ в расчетных задачах приводят кристаллогидраты. Надо понимать, что при введении кристаллогидрата, одновременно с солью вводится и вода.
Сначала рассчитаем массовую долю сульфата меди в насыщенном растворе:
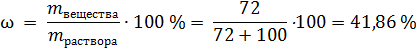
Рассчитаем молярные массы:
M(CuSO4) = 64 + 32 + 4×16 = 160 г/моль
M(CuSO4×5H2O) = 160 + 5×18 = 250 г/моль
|
|
|
Рассчитаем массовую долю безводного сульфата в купоросе:

т.е. добавляя 100 г купороса к воде мы добавляем 64 г безводной соли и, одновременно, 36 г воды, а добавляя x г купороса – 0,64× x безводной соли.
Рассчитаем массу купороса x, которую нужно добавить к 100 мл (100 г) воды, для получения насыщенного раствора, т.е. раствора с w = 41,86 %. Составим уравнение:

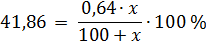


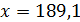
Ответ: к 100 мл воды нужно добавить 189,1 г CuSO4×5H2O.
Пример: 300 г горячего 40%-го раствора соли охладили до комнатной температуры. Насыщенный при комнатной температуре раствор содержит 25 % соли. Найти массу безводной соли, которая выпала в осадок (выкристаллизовалась) при охлаждении.
В исходном горячем растворе содержалось:
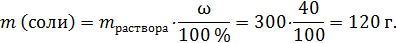
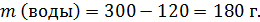
В охлажденном растворе 180 г воды – это 75 % от массы раствора, т.е. масса охлажденного раствора:
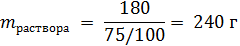
В осадок выпадет 300 – 240 = 60 г соли.
Расчеты по уравнениям реакций
Основа любого расчета в химии – стехиометрические законы.
Вещества вступают в реакцию в количествах, пропорциональных коэффициентам реакции.
Стехиометрические коэффициенты (коэффициенты уравнений) показывают количественные соотношения между всеми участниками реакции, выраженные в молях.
|
|
|
Поэтому именно моль – единица количества вещества – основная единица в химии, именно в моли чаще всего необходимо перевести массы и объемы веществ при решении задач. Напомним основные соотношения (подробнее – см. теорию к задачам 28, 29).
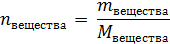
где: mвещества – масса вещества, г;
Мвещества – молярная масса вещества, г/моль.

где: Vгаза – объем газа, л;
22,4 – объем 1 моля при н.у., л/моль.
Рассмотрим реакцию
Zn + 2HCl = ZnCl2 + Н2
По уравнению реакции видно, что 1 моль цинка вступает в реакцию с 2 моль HCl. Если цинк и соляная кислота реагируют в количествах моль, строго соответствующих коэффициентам: т.е. n(Zn) : n(HCl) = 1 : 2, то говорят, что они реагируют в стехиометрических соотношениях. В этом случае количество продуктов можно считать по любому из веществ. Если соотношения веществ другие, то одно из них взято в избытке, оно останется после реакции. В этом случае количество продуктов нужно считать по другому веществу: взятому «в недостатке».
Перечислим основные сложные моменты:
– при образовании осадка: масса осадка полностью исключается из массы раствора, растворимостью осадка пренебрегают;
– при выделении газа: масса газа полностью исключается из массы раствора, растворимостью газа пренебрегают;
– при разделении раствора на 2 части, как правило, понимается две неравные части (если не указано обратного);
– если заданы количества обоих реагирующих веществ, обязательно рассчитать количество моль каждого из них для проверки стехиометричности и установления вещества в недостатке.
Остальные нюансы разберем на реальных примерах задания 34.
Пример 34-1. Водород объемом 10,08 л (н.у.) пропустили при нагревании над порошком оксида меди (II), при этом водород прореагировал полностью. Этот твердый остаток поместили в 255 г 25 %-го раствора нитрата серебра. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем первую реакцию:
CuO + H2 = Cu + H2O
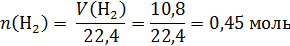
Обратим внимание, числа в задаче подобраны так, что в расчетах, в том числе промежуточных, получается «красивое» число, в противном случае проверьте себя: возможно, допущена ошибка в расчетах.
Указано, что весь водород прореагировал, значит, оксида меди было достаточно для реакции, был ли избыток – неизвестно и не важно – если и был избыток, то в дальнейших реакциях оксида меди участия принимать не будет. В реакцию с раствором нитрата серебра вступит восстановленная медь:
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
(*)
В стакан с раствором нитрата серебра поместили твердый остаток, количество вещества меди в котором:
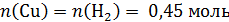
Рассчитаем количество вещества нитрата серебра в растворе:
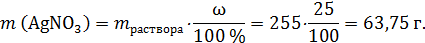
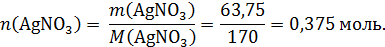
В реакцию (*) Cu и AgNO3 вступают в мольном соотношении 1 : 2. По расчетам:
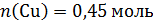 ,
, 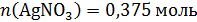
В избытке Cu, реакцию вступит весь AgNO3, 0,375 моль, с ним прореагирует соответствующее количество Cu, столько же образуется соли Cu(NO3)2 в растворе:
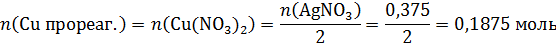
Обратим внимание, что вся соль AgNO3 прореагирует, в конечном растворе будет одна соль – Cu(NO3)2 ее масса:

Основные расчеты приведены. Теперь нужно внимательно рассчитать массу образовавшегося раствора. Рекомендую при решении задачи 34 всегда рисовать на черновике стаканчик (см. рисунок).
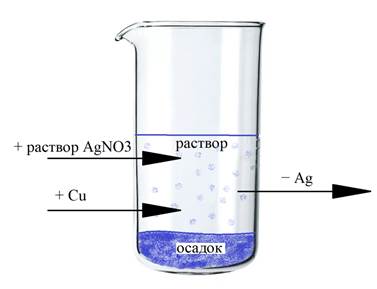
Основа раствора – 255 г раствора нитрата серебра. К нему добавили медь (а, возможно, и смесь меди и непрореагировавшего с водородом оксида меди). Масса всего твердого остатка не имеет значения: в раствор перейдет только часть – медь, прореагировавшая с нитратом серебра. Ее масса составит:
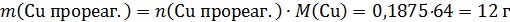
Эта медь прореагирует и останется в растворе в виде соли.
Но серебро, образовавшееся по реакции (*), выпадет в осадок, масса раствора уменьшится на массу серебра:

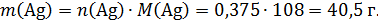
Таким образом, масса конечного раствора:
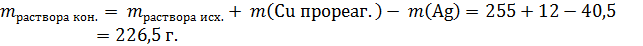
Массовая доля соли в конечном растворе:
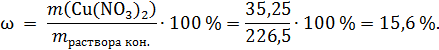
На чистовике нужно привести всю необходимую информацию с минимальными пояснениями, например:
CuO + H2 = Cu + H2O
Cu + 2AgNO3 = Cu(NO3)2 + 2Ag
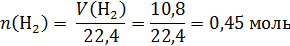
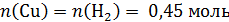
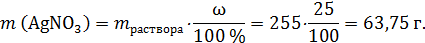
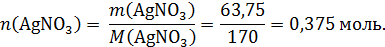
В избытке Cu:
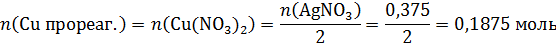

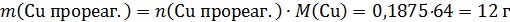

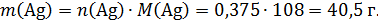
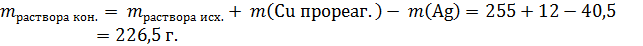
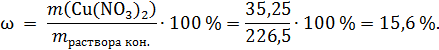
Ответ: 15,6 %.
Пример 34-2. Газообразный аммиак, выделившийся при полном гидролизе 2 г нитрида магния растворили в 100 мл 2,9 %-го раствора серной кислоты плотностью 1,025 г/мл. Определите массовую долю средней соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Найдем количество моль аммиака, образовавшегося по реакции:
Mg3N2 + 6H2O = 3Mg(OH)2 + 2NH3
Не забываем уравнять реакцию и проверить коэффициенты!
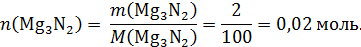
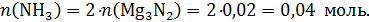
Рассчитаем количество серной кислоты в растворе:


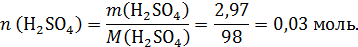
При взаимодействии NH3 и H2SO4 может образовываться кислая и средняя соль:
2NH3 + H2SO4 = (NH4)2SO4
NH3 + H2SO4 = NH4HSO4
В первой реакции соотношение компонентов 2 : 1, т.е. на 0,04 моль NH3 потребуется 0,02 моль H2SO4, во второй реакции соотношение компонентов 1 : 1, т.е. на 0,04 моль NH3 потребуется 0,02 моль H2SO4.
По расчетам получается соотношение 0,04 моль NH3 к 0,03 моль H2SO4, т.е. образуется смесь средней и кислой соли. В этом случае, чтобы не запутаться, будем считать, что сначала образовалась средняя соль в количестве 0,02 моль (считаем по аммиаку, он полностью вступит в реакцию):
2NH3 + H2SO4 = (NH4)2SO4
на это расходуется 0,02 моль H2SO4;
а далее часть средней соли, реагируя с оставшейся кислотой, перейдет в кислую:
(NH4)2SO4 + H2SO4 = 2NH4HSO4
Осталось 0,03 – 0,02 = 0,01 моль H2SO4, именно столько кислоты вступит в реакцию, при этом вступит в реакцию и 0,01 средней соли. В таких случаях удобно приписывать количества моль веществ в реакциях:
2NH3 + H2SO4 = (NH4)2SO4
0,04 0,02 0,02
(NH4)2SO4 + H2SO4 = 2NH4HSO4
0,01 0,01
Таким образом, в растворе останется 0,01 моль средней соли. Её масса:
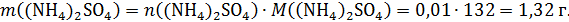
Рассчитаем массу полученного раствора: его масса увеличилась только на массу растворенного аммиака:
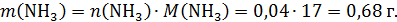
Обе соли растворимы, газ не выделяется, поэтому масса конечного раствора:

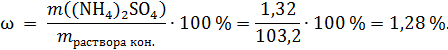
Ответ: 1,28 %.
Пример 34-3. Нитрат меди(II) частично разложился при нагревании, при этом выделилось 39,2 л газов (н.у.) и образовалось 93,6 г твердого остатка. Твердый остаток добавили к 122,5 г 36 %-ой азотной кислоты. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Запишем реакцию разложения нитрата меди(II):
2Cu(NO3)2 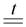 2CuO + 2NO2 + 3O2
2CuO + 2NO2 + 3O2
По количеству газов определим количество CuO в твердом остатке:
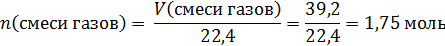
По реакции, при образовании 2 моль CuO образуется 5 моль смеси газов, составим пропорцию:
2 моль CuO – 5 моль смеси газов
х – 1,75
откуда
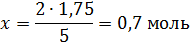
т.е.

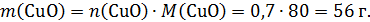
Тогда масса Cu(NO3)2 в твердом остатке:
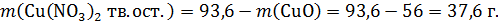
Теперь рассчитаем количество азотной кислоты:

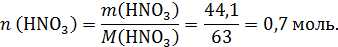
CuO будет реагировать с HNO3:
CuO + 2HNO3 = Cu(NO3)2 + H2O
0,7 0,7
По расчетам получается, что
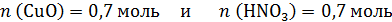
а по реакции на 0,7 моль CuO требуется 0,7×2=1,4 моль HNO3, т.е. кислота в недостатке, часть CuO не растворится. Количество CuO после реакции и количество образовавшегося Cu(NO3)2 рассчитаем по веществу в недостатке – по HNO3:
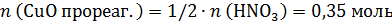
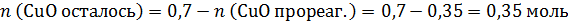
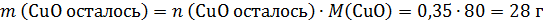
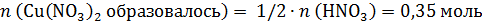
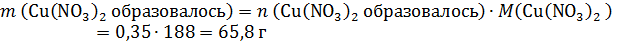
В конечном растворе

Масса конечного раствора – это сумма масс твердого остатка и раствора азотной кислоты, но за вычетом не растворившегося оксида меди:
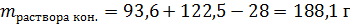
Массовая доля Cu(NO3)2:
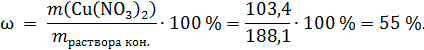
Ответ: 55 %.
Пример 34-4.. Растворимость безводного сульфида натрия при некоторой температуре составляет 15,6 г на 100 г воды. При этой температуре приготовили 289 г насыщенного раствора сульфида натрия. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток раствора хлорида алюминия. К раствору во второй колбе добавили 100 г раствора соляной кислоты, также взятой в избытке. При этом объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида натрия в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Сначала рассчитаем массу сульфида натрия в 289 г насыщенного раствора. Массовая доля соли в насыщенном растворе:

Масса соли в 289 г раствора составит:

Сразу рассчитаем количество моль сульфида натрия:
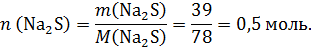
Это количество разделили на 2, вероятно неравные, части.
Теперь разберемся с реакциями в каждой колбе.
1 колба – совместный гидролиз двух солей:
2AlCl3 + 3Na2S + 6H2O = 2Al(OH)3¯ + 3H2S + 6NaCl
Указано, что AlCl3 в избытке, следовательно, количество моль газа в этой реакции рассчитываем по количеству моль сульфида натрия в 1 колбе:
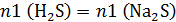
2 колба – вытеснение слабой кислоты сильной:
2НCl + Na2S = H2S + 2NaCl
Соляная кислота в избытке, следовательно, количество моль газа в этой реакции рассчитываем по количеству моль сульфида натрия в 2 колбе:

В условии сказано, что объём газа, выделившийся из второй колбы, оказался в 1,5 раза больше объёма газа, выделившегося из первой колбы. Объем газа пропорционален количеству моль, т. е. количество моль газа, выделившегося из второй колбы, оказалось в 1,5 раза больше количества моль газа, выделившегося из первой колбы:
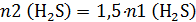
а так как
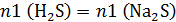

то
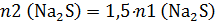
Общее же число моль сульфида натрия 0,5 моль:
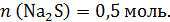


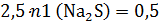
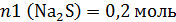

Перейдем ко 2 колбе:
2НCl + Na2S = H2S + 2NaCl
Соляная кислота в избытке, следовательно, количество моль NaCl в этой реакции рассчитываем по количеству моль сульфида натрия в 2 колбе:
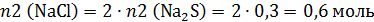
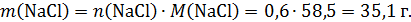
В этой задаче непросто рассчитать массу раствора в колбах. Во второй колбе было 100 г раствора соляной кислоты и к ней добавили насыщенный раствор сульфида натрия, содержащий 0,3 моль этой соли. Сначала рассчитаем массу добавленного раствора:
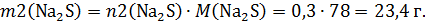
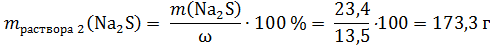
Нарисуем 2 колбу:

тут важно не забыть, что выделяется газ H2S массой:
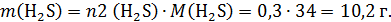
(  )
)
Масса конечного раствора во 2 колбе:

Массовая доля хлорида натрия
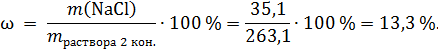
Ответ: 13,3 %.
Пример 34-5. (реальный вариант 2018 года). При проведении электролиза 500 г 16%-го раствора сульфата меди(II) процесс прекратили, когда на аноде выделилось 1,12 л газа (н.у.). Из полученного раствора отобрали порцию массой 98,4 г. Вычислите массу 20%-го раствора гидроксида натрия, необходимого для полного осаждения ионов меди из отобранной порции раствора. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Рассчитаем количество моль сульфата меди(II) в исходном растворе:

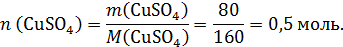
Запишем реакцию, протекающую при электролизе:
2CuSO4 + 2Н2О 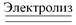 2Cu + О2 + 2H2SO4
2Cu + О2 + 2H2SO4
катод анод
Газ на аноде – кислород:
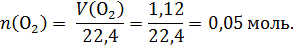
По реакции электролиза определим число моль образовавшейся меди, серной кислоты и число моль прореагировавшего сульфата меди:
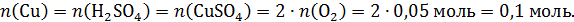
Теперь рассчитаем параметры раствора после электролиза, учтем, что масса раствора уменьшилась на массу выделившейся меди и газа кислорода, серная кислота остается в растворе:

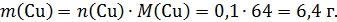

В этом растворе:
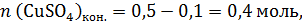

Из полученного раствора отобрали порцию массой 98,4 г, это ровно 1/5 конечного раствора:
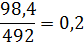
(здесь мы убеждаемся, что пока считаем верно).
В этой порции раствора:
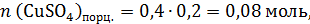
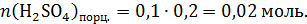
Именно эти количества веществ прореагируют с гидроксидом натрия:
CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4
0,08 0,16
H2SO4 + 2NaOH = Na2SO4 + 2H2O
0,02 0,04
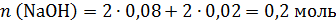

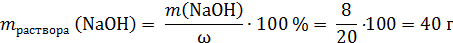
Ответ: 40 г.
Пример 34-6. (реальный вариант 2018 года). Нагревали нитрат цинка. Некоторая часть разложилась, и выделилось 5,6 л смеси газов. Твердый остаток массой 64,8 г растворили в строгом количестве 28 %-го раствора гидроксида натрия (то есть достаточном для растворения и без избытка). Определите массовую долю нитрата натрия. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Разложение нитрата цинка идет по уравнению:
2Zn(NO3)2 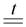 2ZnO + 4NO2 + O2
2ZnO + 4NO2 + O2
По реакции видно, что при разложении 2 моль Zn(NO3)2 образуется 2 моль ZnO и 5 моль смеси газов (4NO2 и 1O2). По условию задачи выделилось

Составим пропорцию:
2 моль ZnO – 5 моль смеси газов
х – 0,25
откуда
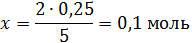
т.е.
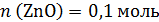
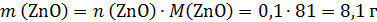
Твердый остаток после прокаливания массой 64,8 г – это смесь Zn(NO3)2 и ZnO, поэтому
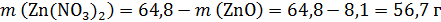
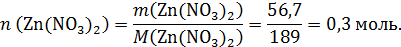
И Zn(NO3)2 и ZnO реагируют с NaOH:
ZnO + 2NaOH +2Н2О = Na2[Zn(OH)4]
0,1 0,2
Zn(NO3)2 + 4NaOH = Na2[Zn(OH)4] + 2NaNO3
0,3 1,2 0,6
Общее количество моль NaOH:
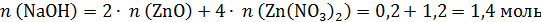

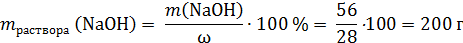
Твердый остаток (смесь Zn(NO3)2 и ZnO) полностью растворяется в растворе NaOH, ни газ, ни осадок не образуются, поэтому:
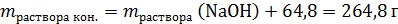
Рассчитаем массовую долю нитрата натрия:
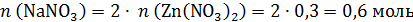
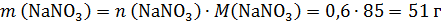

Ответ: 19,3 %.
Пример 34-7 (реальный вариант 2018 года). При прокаливании смеси карбоната натрия и карбоната магния до постоянной массы выделилось 4,48 л (н.у.) газа. Твёрдый остаток полностью прореагировал с 73,0 г 25%-ой соляной кислоты. Рассчитайте массовую долю карбоната натрия в исходной смеси. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Надо помнить, что карбонаты щелочных металлов не разлагаются при нагревании, они даже плавятся без разложения. (!Гидрокарбонаты щелочных металлов при прокаливании теряют воду и углекислый газ и переходят в карбонаты).
Карбонаты щелочноземельных металлов разлагаются при нагревании на оксид щелочноземельного металла и углекислый газ.
Таким образом, при прокаливании смеси Na2CO3 и MgCO3 разлагаться будет карбонат магния:
MgCO3 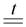 MgO + CO2
MgO + CO2
Прокаливать «до постоянной массы» означает доводить реакцию разложения до конца, т.е. весь карбонат магния в задаче перешел в оксид, а количество карбоната магния в смеси можно определить по объему образовавшегося углекислого газа:
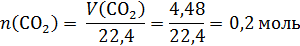
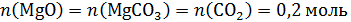

Твердый остаток – это смесь Na2CO3 и MgO, оба вещества реагируют с HCl. Рассчитаем количество моль кислоты:
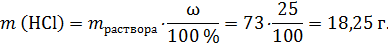
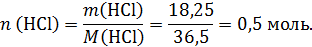
Помним, что атомная масса хлора 35,5 г/моль!
Запишем реакции:
Na2CO3 + 2HCl = 2NaCl + H2O + CO2
MgO + 2HCl = MgCl2 + H2O
0,2 0,4
Количество HCl на реакцию с MgO:
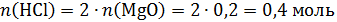
Всего было 0,5 моль HCl, следовательно на реакцию с Na2CO3 ушло 0,5–0,4=0,1 моль, откуда:


Исходная смесь состояла из 16,8 г MgCO3 и 5,3 г Na2CO3, рассчитаем массовую долю Na2CO3:
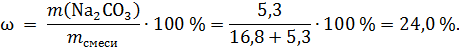
Ответ: 24 %
Д/З
1. Водород объёмом 6,72 л (н.у.) пропустили при нагревании над порошком оксида меди(II), при этом водород прореагировал полностью. В результате реакции получили 20,8 г твёрдого остатка. Этот остаток растворили в концентрированной серной кислоте массой 200 г. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
2. В 250 мл воды растворили 13,8 г натрия, затем добавили 50 г 59%-ного раствора ортофосфорной кислоты. Определите массовую долю соли в полученном растворе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
3. Растворимость безводного карбоната аммония при некоторой температуре составляет 96 г на 100 г воды. При этой температуре приготовили насыщенный раствор, добавив необходимое количество карбоната аммония к 250 мл воды. Раствор разлили в две колбы. К раствору в первой колбе добавили избыток твёрдого гидроксида натрия и нагрели до прекращения выделения газа. К раствору во второй колбе добавили 250 г раствора соляной кислоты, также взятой в избытке. При этом, объём газа, выделившийся из первой колбы, оказался в 3 раза больше объёма газа, выделившегося из второй колбы. (Объёмы газов измерены при одинаковых условиях). Определите массовую долю хлорида аммония в конечном растворе во второй колбе. В ответе запишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления (указывайте единицы измерения искомых физических величин).
Дата добавления: 2021-04-05; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
