Тема: « Доказательство непредельного характера жидкого жира»
ОR
О Н2SO4 конц . О
СН3 – С – ОН + С2Н5ОН ↔ СН3 – С – ОС2Н5 + Н2О
уксусная кислота этилацетат
III. Реакции с разрывом связей С-Н (реакции с участием радикала), в присутствии Ркрасный
1) СН3 – СООН + Сl2 → СН2Сl – СООН + НСl
хлоруксусная кислота
2) СН3 – СООН + Сl2 → СНСl2 – СООН + НСl
дихлоруксусная кислота
3) СН3 – СООН + Сl2 → ССl3 – СООН + НСl
трихлоруксусная кислота
Лабораторная работа № 12
« Свойства уксусной кислоты, общие со свойствами минеральных кислот»
Цель работы: изучить свойства карбоновых кислот.
Оборудование и реактивы: штатив с пробирками (3 шт.), пробка с длинной стеклянной трубкой-холодильником, химический стакан, уксусная кислота (70%), магний, цинк, фенолфталеин, гидроксид натрия, этанол, серная кислота (конц.), вода, хлорид натрия.
Ход работы:
Смотреть по ссылке: https://www.youtube.com/watch?v=fU0Pg8tIEqg
Опыт № 1. Взаимодействие уксусной кислоты с некоторыми металлами.
В две пробирки влейте по 1 мл раствора уксусной кислоты. В одну пробирку всыпьте немного стружек магния, а во вторую – несколько гранул цинка. В первой пробирке происходит бурная реакция, а во второй – реакция протекает спокойно (иногда она начинается только при нагревании).
|
|
|
Задания для самостоятельного вывода:
1. Как уксусная кислота реагирует с магнием и цинком?
2. Сравните скорость этих реакций и напишите уравнения в молекулярном, ионном и сокращенном ионном виде.
Опыт № 2. Взаимодействие уксусной кислоты с основаниями.
Влейте в пробирку 1-1,5 мл раствора гидроксида натрия и добавьте несколько капель раствора фенолфталеина. При добавление уксусной кислоты происходит обесцвечивание.
Опыт № 3. Взаимодействие уксусной кислоты со спиртами. https://www.youtube.com/watch?v=C0JOH3v-2Rk
В пробирку налейте 2 мл раствора уксусной кислоты. Прилейте 2 мл этанола. Затем в пробирку осторожно добавьте 1 мл концентрированной серной кислоты. Пробирку закройте пробкой с длинной стеклянной трубкой-холодильником. Смесь осторожно подогрейте. Жидкость налейте в сосуд с насыщенным раствором хлорида натрия.
Задания для самостоятельного вывода:
1. Какие свойства уксусной кислоты сходны со свойствами минеральных кислот?
2. Какие вещества образуются при взаимодействии уксусной кислоты с основаниями?
3. Какие вещества образуются при взаимодействии уксусной кислоты со спиртами?
4. Напишите уравнения всех этих трѐх опытов.
|
|
|
5. Составьте уравнения реакций муравьиной кислоты: а) с цинком; б) с гидроксидом калия; в) с содой.
Получение предельных монокарбоновых кислот
I. Общие способы получения.
1. Окисление первичных спиртов и альдегидов под действием различных окислителей:

2. Окисление алканов кислородом воздуха (в присутствии катализаторов)
2СН3 – СН2 – СН2 – СН3 + 5О2 → 4СН3 – СООН + 2Н2О
бутан уксусная кислота
В лаборатории карбоновые кислоты получают из их солей, действуя на них серной кислотой при нагревании:
t
СН3СООNa + Н2SО4 → Na2SО4 + СН3СООH
ацетат натрия уксусная кислота
II. Получение уксусной кислоты.
Для пищевых целей уксусную кислоту получают уксуснокислым брожением жидкостей, содержащих спирт (вино, пиво): фермент
СН3 – СН2 – ОН + О2 → СН3СООH + Н2О
воздух
Синтетическую уксусную кислоту для химических целей получают различными методами:
а) окислением ацетальдегида:
СН3 – СОН + [О] → СН3СООH
|
|
|
б) синтезом метанола и оксида углерода (II)
t, кат.
СН3 – ОН + СО → СН3СООH
ДОМАШНЕЕ ЗАДАНИЕ
Ответьте на вопросы (письменно):
1. Выучить тривиальные названия низших карбоновых кислот.
2. Напишите уравнения реакций следующих превращений:
этан → хлорэтан → этанол → этаналь → уксусная кислота
3. По желанию: подготовить презентацию о важнейших представителях ненасыщенных монокарбоновых кислот или составить кроссворд по изученной теме.
. УРОК № 66, 67
Тема: Сложные эфиры и жиры
Смотреть по ссылке: https://www.youtube.com/watch?v=kZX6bV9c1JQ
Сложные эфиры можно рассматривать как производные кислот, у которых атом водорода в карбоксильной группе замещен на углеводородный радикал:
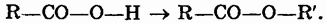
Номенклатура.
Сложные эфиры называют по кислотам и спиртам, остатки которых участвуют в их образовании, например Н—СО—О—СН3 — метилформиат, или метиловый эфир муравьиной кислоты; этилацетат, или этиловый эфир уксусной кислоты.
Способы получения.
1. Взаимодействие спиртов и кислот (реакция этерификации):
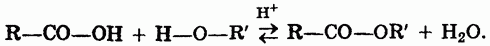
2. Взаимодействие хлорангидридов кислот и спиртов (или алкоголятов щелочных металлов):
|
|
|
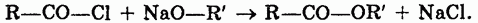
Физические свойства.
Сложные эфиры низших кислот и спиртов — жидкости легче воды, с приятным запахом. В воде растворимы только сложные эфиры с наименьшим числом атомов углерода. В спирте и диэтиловом эфире сложные эфиры растворимы хорошо.
Химические свойства.
1. Гидролиз сложных эфиров — важнейшая реакция этой группы веществ. Гидролиз под действием воды — обратимая реакция. Для смещения равновесия вправо используются щелочи:

2. Восстановление сложных эфиров водородом приводит к образованию двух спиртов:

3. Под действием аммиака сложные эфиры превращаются в амиды кислот:
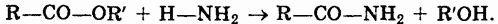
Жиры. Жиры представляют собой смеси сложных эфиров, образованных трехатомным спиртом глицерином и высшими жирными кислотами. Общая формула жиров:
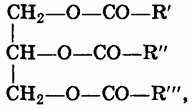
где R — радикалы высших жирных кислот.
Наиболее часто в состав жиров входят предельные кислоты пальмитиновая и стеариновая и непредельные кислоты олеиновая (С17Н33COOH) СН 3 (СН 2 ) 7 СН=СН(СН 2 ) 7 СООН и линолевая (С17Н31COOH) CH 3 (CH 2 ) 3 -(CH 2 CH=CH) 2 (CH 2 ) 7 COOH/
Получение жиров.
В настоящее время практическое значение имеет лишь получение жиров из природных источников животного или растительного происхождения.
Физические свойства.
Жиры, образованные предельными кислотами, — твердые вещества, а непредельными — жидкие. Все очень плохо растворимы в воде, хорошо растворимы в диэтиловом эфире.
Химические свойства.
1. Гидролиз, или омыление жиров происходит под действием воды (обратимо) или щелочей (необратимо):
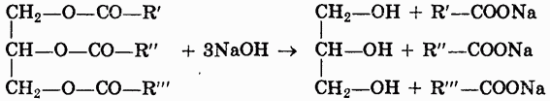
При щелочном гидролизе образуются соли высших жирных кислот, называемые мылами.
2. Гидрогенизацией жиров называется процесс присоединения водорода к остаткам непредельных кислот, входящих в состав жиров. При этом остатки непредельных кислот переходят в остатки предельных кислот, и жиры из жидких превращаются в твердые.
Из важнейших пищевых веществ — белков, жиров и углеводов — жиры обладают наибольшим запасом энергии.
ЛАБОРАТОРНАЯ РАБОТА № 13
Тема: « Доказательство непредельного характера жидкого жира»
Цель: изучить свойства жидкого жира.
Оборудование: штативы, пробирки, пробиркодержатель, спиртовки; подсолнечное масло, твердый животный жир, бромная вода
Ход работы:
Смотреть по ссылке: https://www.youtube.com/watch?v=YoeHAFJvho0
Опыт. Доказательства непредельного характера жидкого жира
В одну пробирку налейте 1-2 см3 подсолнечного масла, во вторую поместите кусочек твердого животного жира и нагрейте ее до расплавления жира. К содержимому каждой пробирки добавьте немного бромной воды и встряхните смеси.
Отметьте, в какой из пробирок бромная вода обесцветилась. О чем это свидетельствует?
________________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Составьте уравнение реакции.
________________________________________________________________________________
________________________________________________________________________________
Сделать вывод по работе:
Задание
1) Составьте уравнение реакции получения этилового эфира муравьиной кислоты.
2) Напишите уравнение реакции щелочного гидролиза тристеарата глицерина.
3) Напишите структурную формулу триглицерида, образованного одним остатком пальмитиновой кислоты и двумя остатками олеиновой кислоты.
4) Относительная плотность паров сложного эфира по водороду равна 30. Приведите структурную формулу этого эфира.
5) Имеется водный раствор, содержащий глицерин, фенол, уксусный альдегид. Как можно доказать присутствие каждого их этих веществ в растворе? Ответ обоснуйте уравнениями соответствующих химических реакций.
Дата добавления: 2021-06-02; просмотров: 534; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
