Изменение окраски индикаторов в зависимости от среды
Основания
В нем металл и кислород,
Да еще плюс водород,
И такое сочетание
Называют основание.
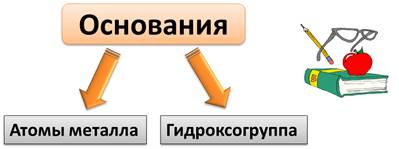
Основания – это сложные вещества, состоящие из атомов металла и гидроксогруппы. Гидроксогруппа – это группа ОН.
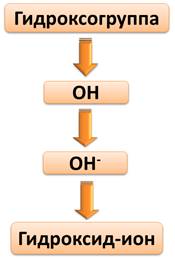
Степень окисления О (-2), Н (+1), поэтому суммарный заряд этого иона (1-). Т.е. гидроксогруппа представляет собой сложный ион, который еще называют гидроксид-ионом.
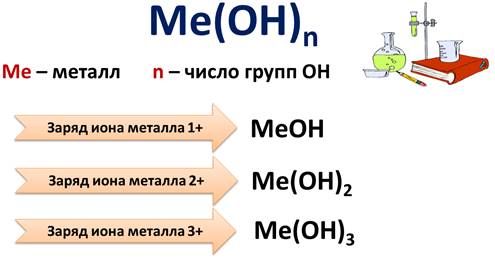
Состав оснований можно записать формулой Ме(ОН)n, где Ме – это металл, а n – число групп ОН.
Если заряд иона металла 1+, то с ионом металла связана 1 группа ОН-, формула таких оснований будет МеОН, а если заряд иона металла 2+, то с ионом металла связано 2 группы ОН- и формула таких оснований будет Ме(ОН)2 и т.д.
Название оснований состоит из слова гидроксид + название металла в родительном падеже. Например, КОН – гидроксид калия, Ва(ОН)2 – гидроксид бария, Al(OH)3 – гидроксид алюминия.

Если металл проявляет переменную степень окисления, то после названия в скобках римскими цифрами ставят численное значение степени окисления. Например: Cu(OH)2 – гидроксид меди (II), Fe(OH)3 – гидроксид железа (III), Mn(OH)2 – гидроксид марганца (II).
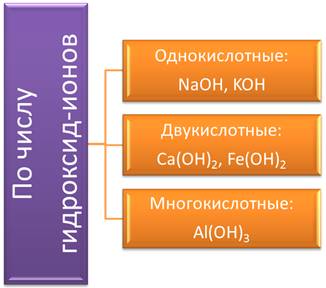
По числу гидроксид-ионов основания подразделяют на: однокислотные, в формулах которых 1 гидроксид-ион (NaOH, KOH); двукислотные, в формулах которых 2 гидроксид-иона (Ca(OH)2, Fe(OH); многокислотные основания, в которых три и более гидроксид-ионов (Al(OH)3).
По растворимости в воде основания делятся на растворимые в воде, или щёлочи и нерастворимые в воде. Растворимыми основаниями являются основания, образованные металлами I A группы и некоторыми металлами II A группы. Например, NaOH, Ba(OH)2, KOH. Растворимые в воде основания хорошо растворяются в воде, не образуя, осадка, а нерастворимые, наоборот, выпадают в виде осадка и нерастворимы в воде. Например, Cu(OH)2, Al(OH)3, Fe(OH)2.
Для того чтобы определить растворимо или нерастворимо основание в воде, можно воспользоваться таблицей растворимости. Если в таблице на пересечении иона металла и гидроксид-иона стоит буква «Р», значит, это основание растворимо в воде, если на пересечении стоит буква «М», значит, основание мало растворимо в воде, а если буква «Н», значит, основание нерастворимо в воде.
Таблица растворимости
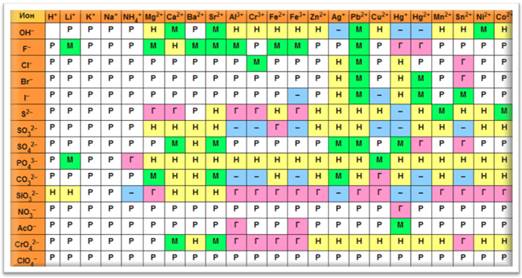
Рассмотрим некоторые щёлочи. Одной из наиболее распространённых щелочей является гидроксид натрия – NaOH. Это твердое белое вещество, гигроскопично, т.е. поглощает влагу из воздуха, поэтому оно расплывается на воздухе, хорошо растворимо в воде с выделением тепла.
Раствор гидроксида натрия мыльный на ощупь и очень едкий, поэтому его ещё называют едкий натр. Он разъедает ткани, кожу, бумагу и др. органические материалы. С гидроксидом натрия и его раствором обращаться нужно осторожно, при попадании на кожу вызывает долго не заживляющие раны. Гидроксид натрия широко используется в мыловарении, кожевенной, фармацевтической промышленности, бумажной и текстильной промышленности. Его техническое название – «каустическая сода».
Гидроксид калия – КОН – является тоже твердым белым веществом, которое хорошо растворимо в воде, при этом выделяется большое количество теплоты.
Его раствор мыльный на ощупь и очень едкий, поэтому гидроксид калия тоже называют едкое кали. Его применяют при производстве мыла и тугоплавкого стекла.
Гидроксид кальция Са(ОН)2 называют еще гашёной известью. Его получают реакцией негашёной извести с водой. Гидроксид кальция представляет собой рыхлый белый порошок, малорастворимый в воде. Этот гидроксид используют при кладке и штукатурке стен, побелке деревьев, для получения хлорной извести.
Прозрачный раствор гидроксида кальция называют известковой водой. Если через нее пропустить углекислый газ, то она помутнеет, вследствие образования нерастворимого карбоната кальция. Эта реакция является качественной на углекислый газ. Качественные реакции – это реакции, с помощью которых распознают определенные вещества. Следовательно, углекислый газ распознают по помутнению известковой воды.
Для того чтобы определить щёлочи, используют специальные вещества, которые называют индикаторами. Индикаторы – это вещества, которые изменяют свою окраску под действием различных веществ. Сравним окраску индикаторов в нейтральной среде, или в воде и в растворах щелочей.
Наиболее распространенными индикаторами являются: лакмус, метиловый оранжевый и фенолфталеин. В нейтральной среде лакмус – фиолетовый, метиловый оранжевый – оранжевый, фенолфталеин – бесцветный.
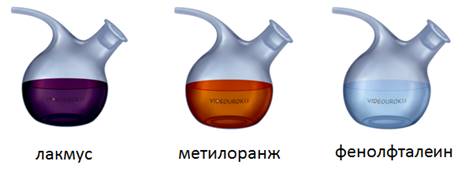
Если мы капнем в щелочь лакмуса, то он станет синим, метиловый оранжевый – желтым, а фенолфталеин и вовсе станет малиновым. Поэтому c помощью индикаторов можно отличить щелочи от других классов соединений.
Изменение окраски индикаторов в зависимости от среды

Классификация оснований
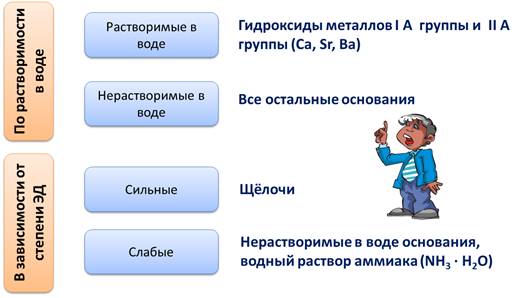
По растворимости в воде основания делятся на растворимые в воде, или щёлочи, к ним относятся гидроксиды металлов I A группы главной подгруппы и гидроксиды металлов II A группы главной подгруппы, таких как Ca, Sr, Ba. Все остальные основания являются нерастворимыми в воде.
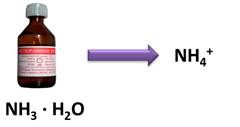
В зависимости от степени электролитической диссоциации различают сильные основания, к ним относятся щёлочи, степень диссоциации этих оснований стремиться к единице. К слабым основаниям относятся основания, степень диссоциации которых стремиться к нулю, к таким основаниям относятся нерастворимые в воде основания, водный раствор аммиака (NH3 · H2O).
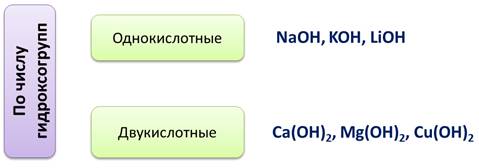
По числу гидроксогрупп основания делятся на однокислотные, у которых одна группа ОН-, например, NaOH, KOH, LiOH. Двукислотные, у которых две группы ОН-, например, Ca(OH)2, Mg(OH)2, Cu(OH)2.
Все основания по агрегатному состоянию являются твёрдыми веществами, имеющими различную окраску. Исключение составляет только раствор аммиака в воде, представляющий собой всем известный нашатырный спирт. Это основание, в отличие от других, содержит не катион металла, а катион аммония (NH4+) и существует только в растворе. Он легко разлагается на аммиак и воду.
NH3 · H2O ↔ NH3↑ + H2O
Такое основание, как гидроксид кальция (Са(ОН)2) имеет белую окраску, Cu(OH)2 – голубую окраску, Ni(OH)2 – зелёную окраску, а Fe(OH)3 – красно-бурую окраску.

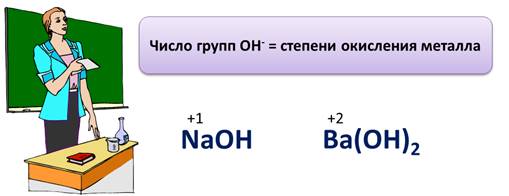 Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
Основания – это электролиты, при диссоциации которых в качестве катионов выступают катионы металла (или аммония), а в качестве анионов – гидроксид-ионы. Число групп ОН равно степени окисления металла. Если степень окисления металла +1, значит, в составе основания будет 1 группа ОН, например NaOH, 1 группа ОН, т.к. степень окисления металла натрия +1, или Ba(OH)2, в составе данного основания 2 группы ОН, т.к. у металла бария степень окисления +2.
Наличие группы ОН обуславливает ряд общих свойств оснований: мыльность на ощупь, изменение окраски индикаторов и др.
Основания, в частности щёлочи, изменяют окраску индикаторов, т.к. при диссоциации образуют гидроксид-ионы. В присутствии щелочей лакмус изменяет свою окраску на синюю, метиловый оранжевый – на желтую, фенолфталеин – на малиновую.

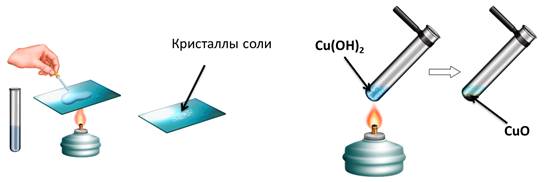
Основания вступают в реакцию с кислотами. Эти реакции относятся к реакциям обмена. В результате чего образуется соль и вода. Вспомните, если мы в стакан с гидроксидом натрия добавим несколько капель фенолфталеина, то раствор щёлочи окрасится в малиновый цвет, а затем сюда же добавим раствор соляной кислоты, то малиновая окраска исчезает. Окраска исчезает, т.к. в результате этой реакции образуется соль и вода. Образование соли можно легко подтвердить: если мы на предметное стекло капнем несколько капель раствора и выпарим, то на стекле появятся кристаллы соли.

NaOH + HCl = NaCl + H2O
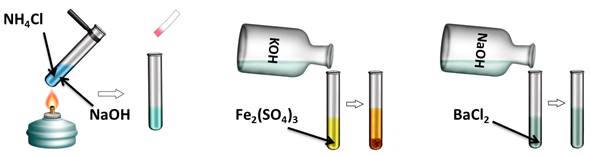
Аналогично, и нерастворимые основания реагируют с кислотами. Получим, например, нерастворимое основание – гидроксид железа (III). Для этого, в раствор сульфата железа (III) добавим несколько капель гидроксида калия, при этом образуется осадок бурого цвета – это гидроксид железа (III). К этому нерастворимому основанию добавим соляной кислоты, осадок растворяется, т.к. образуется соль и вода. Если мы этот раствор соли поместим на предметное стекло и выпарим, то на стекле появятся кристаллы жёлтого цвета – это кристаллы соли хлорида железа (III).

Fe2(SO4)3 + 6 К OH = 2Fe(OH)3↓ + 3 К 2 SO4
Fe(OH)3 + 3HCl = FeCl3 + 3H2O
Fe(OH)3 + 3H+ = Fe3+ + 3H2O
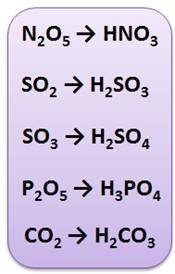
Щёлочи реагируют и с оксидами неметаллов. Каждому оксиду неметалла соответствует своя кислота, так оксиду азота (V) соответствует азотная кислота (N2O5 → HNO3), оксиду серы (IV) – сернистая кислота (SO2 → H2SO3), оксиду серы (VI) соответствует серная кислота (SO3 → H2SO4), оксиду фосфора (V) – фосфорная кислота (P2O5 → H3PO4), оксиду углерода (IV) – угольная кислота (CO2 → H2CO3) и т.д.
Поэтому в реакциях щелочей с оксидами неметаллов образуются соли соответствующих кислот и вода. Вспомните качественную реакцию на углекислый газ: известковая вода реагирует с углекислым газом, в результате чего происходит помутнение известковой воды, вследствие образования карбоната кальция.

 Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Са(ОН)2 + СО2 = СаСО3↓ + Н2О
Эта реакция относится к реакциям обмена.
Щёлочи вступают в реакцию обмена с солями, при этом образуется новая соль и новое основание, но при этом, должны выполняться определённые условия, т.е. должен образоваться осадок или слабый электролит.
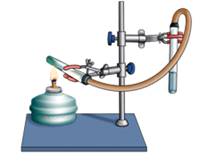
Проведём эксперимент, для этого нальём в первую пробирку гидроксида натрия и хлорида аммония, во вторую – гидроксида калия и сульфата железа (III), а в третью – гидроксида натрия и хлорида бария. Содержимое первой пробирки нагреем. В результате появляется резкий запах аммиака. Во второй пробирке образуется осадок бурого цвета, а в третьей пробирке изменений не произошло. Т.о. в двух пробирках реакция прошла, т.к. выполнялись условия: образуется осадок или слабый электролит.

NaOH + NH4Cl = NaCl + NH3↑ + H2O
6KOH + Fe2(SO4)3 = 3K2SO4 + 2Fe(OH)3↓
NaOH + BaCl 2 ≠
Все нерастворимые основания при нагревании разлагаются на оксид металла и воду. Щёлочи этой способностью не обладают. Например, гидроксид железа (II) разлагается на оксид железа (II) и воду.
Fe(OH)2 = FeO + H2O
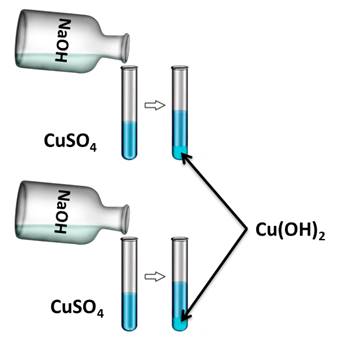
Для подтверждения этого свойства получим нерастворимое основание гидроксида меди (II), а затем нагреем его. Для этого, в две пробирки нальём раствора сульфата меди (II), затем сюда же добавим несколько капель гидроксида натрия. У нас образуется осадок голубого цвета. Это гидроксид меди (II).
CuSO 4 + 2 NaOH = Cu ( OH )2↓ + Na 2 SO 4
Если в одну из пробирок с осадком гидроксида меди (II) добавить раствора соляной кислоты, то осадок растворяется. В результате образуется соль и вода. В этом можно убедиться, если несколько капель раствора капнуть на предметное стекло и выпарить, то на стекле появляются кристаллы соли.
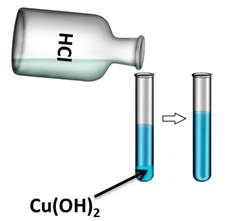
Cu ( OH )2 + 2 HCl = CuCl 2 + 2 H 2 O
Нагреем пробирку с гидроксидом меди (II). В результате образуется вещество черного цвета – это оксид меди (II). Образуется оксид меди (II), т.к. нерастворимые основания при нагревании разлагаются на оксид металла и воду.
Дата добавления: 2021-06-02; просмотров: 1477; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
