Состояние электронов в атоме.
Атом. Строение атома.
Понятие «атом» пришло к нам из далекой античности, но совершенно изменило тот первоначальный смысл, который вкладывали в него древние греки (в переводе с греческого «атом» означает «неделимый»). Этимология названия «неделимый» отражает сущность атома с точностью до наоборот. Атом делим и состоит из элементарных частиц.
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX и начале XX в. в результате изучения природы катодных лучей (Дж. Томсон, 1897 г.), открытия явления фотоэффекта (А. Г. Столетов, 1889 г.), открытия радиоактивности химических элементов (А. Беккерель, М. Склодовская-Кюри, 1896—1899 гг.), определения природы α-частиц (эксперименты Э. Резерфорда, 1889—1900 гг.). Ученые пришли к заключению о том, что атомы обладают собственной структурой, имеют сложное строение.
Как же развивалась классическая теория строения атома?
В 1904 г. в работе «О структуре атома» Дж. Томсон дал описание своей модели, получившей образное название «сливового пудинга».
В 1911 г. Э. Резерфорд предложил планетарную модель атома.
В 1913 г. Н. Бор внес в планетарную модель атома Э. Резерфорда квантовые представления.
В 1932 г. была разработана протонно-нейтронная теория ядра, согласно которой ядра атомов состоят из протонов и нейтронов.
| Атом — электронейтральная система взаимодействующих элементарных частиц, состоящая из ядра (образованного протонами и нейтронами) и электронов. |
Электроны, протоны и нейтроны называют элементарными частицами.
Каковы же свойства этих частиц?
Корпускулярно-волновые свойства микромира. Элементарные частицы, а также построенные из них атомные ядра, атомы и молекулы имеют ничтожно малые массы и размеры и поэтому обладают своими особыми свойствами, непохожими на те, которые имеют объекты окружающего нас макромира. Они образуют свой, специфический мир — микромир, описываемый законами квантовой механики, которые в значительной степени применимы для частиц с очень маленькими массами и очень большими скоростями.
Квантовая механика характеризует частицы микромира как объекты с двойственной природой — корпускулярно-волновым дуализмом: они являются одновременно и частицами (корпускулами), и волнами.
Корпускулярно-волновой дуализм объектов микромира подтвержден и экспериментально знакомыми вам из курса физики интерференцией и дифракцией электронов, протонов, нейтронов, атомов и т. д.
Электрон — частица, определяющая наиболее характерные химические свойства атомов и молекул. Двойственная природа электрона может быть подтверждена на опыте. Если электроны, испускаемые источником — катодом — пропускать через маленькие отверстия в пластинке, поставленной на их пути, то они, попадая на фотопластинку, вызывают ее почернение. После проявления фотопластинки на ней можно увидеть совокупность чередующихся светлых и темных колец, т. е. дифракционную картину (рис. 1).

Рис. 1.
Электронограммы газов (слева) и кристаллов (справа). Центральное пятно обусловлено нерассеянным пучком электронов, а кольца — электронами, рассеянными под разными углами
Дифракционная картина включает в себя как дифракцию — огибание волной препятствия, так и интерференцию, т. е. наложение волн друг на друга. Эти явления доказывают наличие у электрона волновых свойств, так как только волны способны огибать препятствия и налагаться друг на друга в местах их встречи. Однако, попадая на фотослой, электрон дает почернение лишь в одном месте, что свидетельствует о наличии у него корпускулярных свойств. Будь он только волной, он более или менее равномерно засвечивал бы всю пластинку.
Вследствие дифракции электрон, пройдя отверстие, может в принципе попасть в любую точку фотопластинки, но с разной вероятностью, т. е. можно говорить о вероятности обнаружения электрона в той или иной области фотослоя, а в общем случае — в той или иной области пространства. Поэтому движение электрона и в атоме нельзя рассматривать как движение точечного заряда по строго определенной замкнутой траектории.
Вопросы и задания:
1. Назовите те явления, которые прямо или косвенно доказывают, что атом — сложная частица.
2. Как развивалась классическая теория строения атома? Какие модели атомов вам известны? В чем их суть? В чем — недостатки?
3. Приведите примеры явлений, доказывающих двойственную (дуалистическую) природу частиц микромира.
4. В чем отличие объектов микро- и макромира?
5. Под элементарными (наименьшими) частицами понимают неделимые частицы. Как такое допущение соответствует утверждению физиков о том, что элементарная атомная частица — электрон — делима? Кстати, именно открытие делимости электрона было удостоено Нобелевской премии в 1998 г.
Состояние электронов в атоме.
Мы уже знаем, что электрон в атоме не имеет траектории движения, т. е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда.
Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точек. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек будет больше всего.
На рисунке 2 показан «разрез» такой электронной плотности в атоме водорода, проходящий через ядро, а штриховой линией ограничена сфера, внутри нее вероятность обнаружения электрона составляет 90%. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона -10%, вероятность же обнаружения электрона внутри второго от ядра контура составляет -20%, внутри третьего — -30% и т. д.
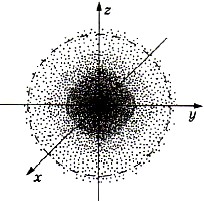
Рис. 2.
Электронное облако атома водорода
Поверхность, охватывающая ядро атома, за пределами которой вероятность пребывания электрона исчезающе мала, называется граничной поверхностью электронного облака. Граничная поверхность охватывает более 90% заряда электрона и передает форму электронного облака. Электронное облако и его граничную поверхность в атоме часто называют атомной орбиталью. Это модельное представление состояния электрона является графическим выражением решения некоторого волнового уравнения, описывающего движение электрона в атоме. Подробнее об этом вы узнаете при изучении химии в высшей школе.
Важнейшей характеристикой движения электрона в атоме является его энергия. Для характеристики энергии электрона в атоме, формы электронного облака и некоторых других его свойств используют квантовые числа. Их значения указывают на наиболее вероятный «адрес» электрона в атоме.
Энергия электрона и размер электронного облака характеризуются главным квантовым числом n, которое принимает целочисленные значения: 1, 2, 3, 4, ... .
Совокупность атомных орбиталей с одинаковым значением квантового числа называют энергетическим уровнем. Совокупность электронов, которые находятся на одном энергетическом уровне, — это электронный слой. Наименьшей энергией обладают электроны первого энергетического уровня. По сравнению с электронами первого уровня электроны последующих уровней будут иметь больший запас энергии. Следовательно, наименее прочно связаны с ядром атома электроны внешнего уровня. В многоэлектронных атомах энергия электронов зависит не только от главного квантового числа n, но также и от орбитального (побочного) квантового числа l. Оно может принимать любые целочисленные значения от нуля до {n - 1): l = 0, 1, 2, ..., (n - 1).
Орбитальное квантовое число характеризует различные энергетические состояния электронов данного уровня (подуровни) и определяет форму электронного облака.

Электроны, характеризующиеся значениями побочного квантового числа 0, 1, 2, 3, называют соответственно s-электронами, р-электронами, d-электронами и f-электронами.
Электронное облако s-электрона обладает сферической симметрией, т. е. имеет форму шара. Электронное облако р-электрона имеет форму гантели или объемной восьмерки. Еще более сложную форму имеют d- и f-электронные облака.
На рисунке 3 приведены формы s-, р- и d-электронных облаков.
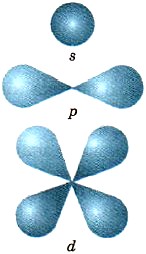
Рис. 3.
Форма s-, р- и d-электронных облаков
Подуровень с l = 0 в связи с шаровой симметрией электронной плотности s-облака имеет только один вариант ориентации в пространстве. Положение других облаков в пространстве относительно внешнего магнитного или электрического поля характеризует магнитное квантовое число m.
Магнитное квантовое число m связано с орбитальным квантовым числом и может принимать значения от +Z до -Z, включая 0. Так, для l = 1 магнитное квантовое число имеет три значения: -l, 0, +l. Таким образом, подуровень с l = 1 образован тремя p-орбиталями. Соответствующие облака ориентированы в атоме взаимно перпендикулярно, вдоль осей пространственных координат х, y, z. Если l = 2, то магнитное квантовое число m принимает пять значений: -2, -1, 0, +1, +2, такой подуровень образован пятью d-орбиталями, а подуровень с l = 3 образован соответственно семью f-орбиталями, имеющими следующие значения магнитного квантового числа: -3, -2, -1, 0, +1, +2, +3.
Состояние электрона в атоме зависит также еще от одной его характеристики, называемой спином (от англ. spin — веретено). Спин электрона проявляется в том, что электрон ведет себя так, словно обладает собственным магнитным моментом за счет вращения вокруг «своей оси». Соответствующее этой характеристике электрона спиновое квантовое число m8 может принимать значения +1/2 или -1/2 в зависимости от того, параллельно или не параллельно магнитному полю, обусловленному движением электрона вокруг ядра, ориентируется магнитное поле электрона.
Таким образом, в современной модели атома состояние электрона определяется четырьмя параметрами, называемыми квантовыми числами: главным (n), орбитальным (l), магнитным (m) и спиновым (m8).
Рассмотренный материал обобщен на рисунке 4 и в таблице 1.

Рис. 4.
Формы и размеры электронных облаков атомов элементов
Таблица 1
Распределение электронов по энергетическим уровням
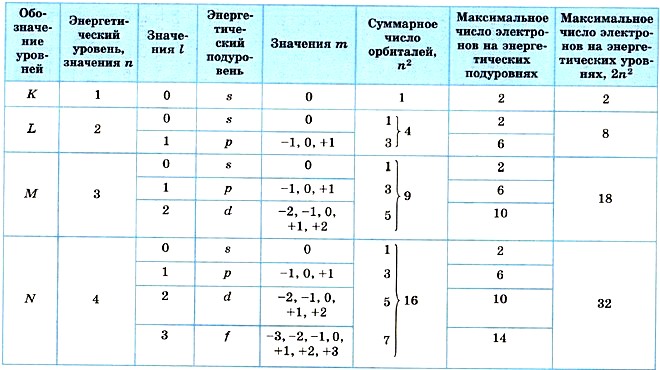
Различные состояния электронов в атоме неравноценны и заполняются электронами определенным образом, подчиняясь основным закономерностям:
1. Принцип минимума энергии. В основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Согласно правилу В. М. Клечковского, в основном состоянии электрон занимает уровень с наименьшим значением суммы (n + l), причем сначала заполняется подуровень с наименьшим значением n.
Например, для атома кальция при распределении электронов по энернетическим уровням предпочтительнее 4s-состояние (п + l = 4 + 0 = 4), чем 3d-состояние (n + l = 3 + 2 = 5). А для атома скандия предпочтение следует отдать Зd-состоянию (n + l = 3 + 2 = 5), а не 4р-состоянию (n + l = 4 + 1 = 5), так как при одинаковых суммах квантовых чисел (n + l) 3d-cocтояние имеет меньшее значение n = 3. На рисунке 5 показана схема энергетических уровней и подуровней в порядке увеличения энергии электрона.
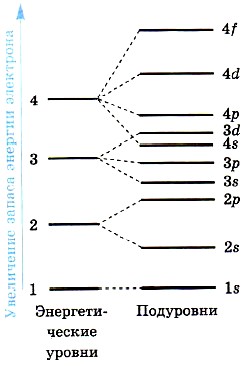
Рис. 5.
Схема подразделения энергетических уровней на подуровни
2. Принцип Паули. В атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел.
Поэтому любой атомной орбитали соответствуют максимум два электрона (у которых главное, орбитальное и магнитное квантовые числа одинаковы) с противоположными спинами. Используя этот принцип, можно подсчитать максимальное число электронных состояний N, соответствующих различным значениям главного квантового числа п: N = 2n2.
3. Правило Гунда. Электроны в пределах одного подуровня располагаются так, чтобы суммарное спиновое число их было максимальным.
Таким образом, наиболее устойчивому состоянию атома соответствует максимально возможное число неспаренных электронов с одинаковыми спинами. Например, 3 электрона на р-подуровне будут распределяться так

В этой записи каждая атомная орбиталь обозначена клеткой (квантовой ячейкой), а электрон — стрелкой, направление которой соответствует направлению спина.
2. Вопросы и задания:
1. В настоящее время не принято говорить о вращении электрона вокруг атомного ядра. Почему?
2. Что такое электронное облако и как это понятие соотносится с понятием «орбиталь»?
3. Как с помощью электролиза определить заряд электрона?
4. Чем отличается 1s-орбиталь от 2s-орбитали?
5. Что такое главное квантовое число?
6. Какие значения n и l соответствуют состояниям электрона: a) 4s; б) 5р; в) 3d?
7. Сколько энергетических подуровней образует: а) пятый энергетический уровень; б) третий энергетический уровень?
Дата добавления: 2021-06-02; просмотров: 129; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
