Основные электрические характеристики аккумулятора
Лабораторная работа № 4
Наименование работы : Сборка гальванического элемента и его испытание.
Цель работы: 1) исследование зависимости напряжения на выводах гальванического элемента от материала его электродов и электролита;
Норма времени : 2 часа.
Оборудование: источник электропитания, вольтметр, кювета с медным и цинковым электродами, ключ, стаканы с насыщенным раствором поваренной соли и сахара, рабочая тетрадь (конспект), ручка, калькулятор, карандаш, линейка, методичка.
Правило техники безопасности : правила техники безопасности при работе с электричеством,соблюдать дисциплину.
Информационное обеспечение : 1. Синдеев Ю.Г. Электротехника с основами электроники. Учебное пособие для профессиональных училищ и колледжей. Ростов – на – Дону, «Феникс», 2004.
2. Касаткин А.С. Основы электротехники. Учебное пособие для средних профессиональных училищ. – М., Высш. шк., 2006.
Теоретические сведения
Химические источники тока прочно вошли в нашу жизнь. В обычной жизни мы их представляем как батарейки и аккумуляторы. Обычно они используются в фонариках, часах, игрушках, радиоприемниках, автомобилях, ЭВМ, мобильных средствах связи, аварийном освещении и т.д.
Гальванические элементы — это химический источник электрического тока, основан на взаимодействии двух металлов и (или) их оксидов в электролите, приводящем к возникновению в замкнутой цепи электрического тока. Гальванические элементы называются первичными.
|
|
|
Первым, кто открыл возможность получения электричества без электризации трением, был итальянский ученый Луиджи Гальвани. Он работал в лаборатории, где проводились опыты с лягушками. Гальвани поставил ряд опытов для обнаружения причин возникновения электрического тока. Итальянский физик Алессандро Вольта, опираясь на результаты исследований Луиджи Гальвани, изготовил электрическую батарею, названную впоследствии вольтовым столбом. Батарея Вольта была составлена из чередующихся медных и цинковых кружков, которые были сложены столбиком и переложены кусочками сукна, смоченного в растворе кислоты. Вольта предложил назвать этот элемент гальваническим в честь Гальвани.
Простейший элемент может быть изготовлен из двух полосок: медной и цинковой, погруженных в воду, слегка подкисленную серной кислотой. Если цинк достаточно чист, чтобы быть свободным от местных реакций, никаких заметных изменений не произойдет до тех пор, пока медь и цинк не будут соединены проводом.
Однако полоски имеют разные потенциалы одна по отношению к другой, и когда они будут соединены проводом, в нем появится электрический ток. Внутри гальванического элемента непрерывно идет химическая реакция, в результате которой происходит разделение зарядов. В результате один электрод становится положительно заряженным, а другой отрицательно заряженным. Электроды находятся в электролите, с которым они взаимодействуют в ходе химической реакции.
|
|
|
По мере этого действия цинковая полоска будет постепенно растворяться, а близ медного электрода будут образовываться пузырьки газа, собирающиеся на его поверхности. Этот газ — водород, образующийся из электролита. Электрический ток идет от медной полоски по проводу к цинковой полоске, а от нее через электролит обратно к меди.
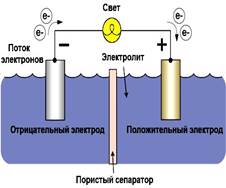
Постепенно серная кислота электролита замещается сульфатом цинка, образующимся из растворенной части цинкового электрода. Благодаря этому напряжение элемента уменьшается. Однако еще более сильное падение напряжения вызывается образованием газовых пузырьков на меди. Оба эти действия производят «поляризацию». Подобные элементы не имеют почти никакого практического значения. Все гальванические элементы и батареи гальванических элементов имеют определенный срок действия. После этого мы их просто выбрасываем.
|
|
|
Наиболее распространены гальванические элементы марганцево-цинковой, марганцево-воздушной, воздушно-цинковой и ртутно-цинковой систем с солевым и щелочным электролитами.

Аккумуляторы- являются химическими источниками электрической энергии многоразового действия.
В настоящее время наиболее часто на практике применяют свинцовые и кадмиево-никелевые аккумуляторы. У первых электролитом служит раствор серной кислоты, а у вторых — раствор щелочей в воде. Свинцовые аккумуляторы называют также кислотными, а кадмиево-никелевые — щелочными.
Принцип работы аккумуляторов основан на поляризации электродов при электролизе. Простейший кислотный аккумулятор устроен следующим образом: это две свинцовые пластины, опущенные в электролит. В результате химической реакции замещения пластины покрываются слабым налетом сернокислого свинца PbSO4, как это следует из формулы Pb + H2SO4 = PbSO4 + Н2.
Такое состояние пластин соответствует разряженному аккумулятору. Если теперь аккумулятор включить на заряд, т. е. подсоединить его к генератору постоянного тока, то в нем вследствие электролиза начнется поляризация пластин. В результате заряда аккумулятора его пластины поляризуются, т. е. изменяют вещество своей поверхности, и из однородных (PbSO4) превращаются в разнородные (Pb и РbО2).
|
|
|
Аккумулятор становится источником тока, причем положительным электродом у него служит пластина, покрытая двуокисью свинца, а отрицательным — чистая свинцовая пластина.
Величина тока разряда и напряжение, которые может быть выдано одной банкой незначительно. Для многих электрических приборов их значения явно недостаточны. Поэтому однотипные аккумуляторы (банки) подключают последовательно, причем это часто делают в едином корпусе.
Примером подобной конструкции служит широко распространенная автомобильная разработка на основе серной кислоты и свинцовых пластин-электродов. Собранная из нескольких последовательно подключенных банок конструкция является уже батареей, за которой закрепилось сокращенное название «АКБ». Ее внутреннее устройство показано на рисунке.
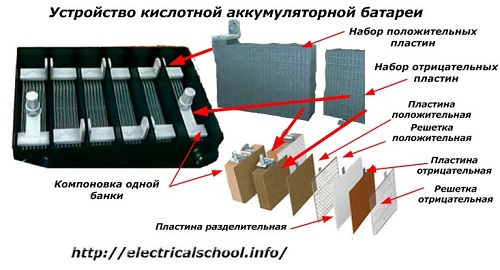
Любая из банок состоит из двух блоков с набором пластин для положительного и отрицательного электродов. Блоки входят друг в друга без металлического контакта с возможностью надежной гальванической связи через электролит.
При этом контактные пластины имеют дополнительную решетку и отдалены между собой разделительной пластиной — сепаратором.
Соединение пластин в блоки увеличивает их рабочую площадь, снижает общее удельное сопротивление всей конструкции, позволяет повышать мощность подключаемой нагрузки.
С внешней стороны корпуса такая АКБ имеет элементы, показанные на рисунке ниже.
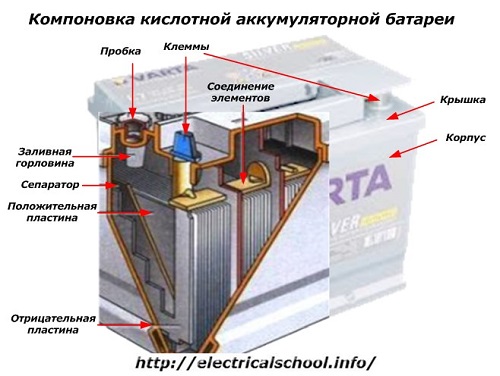
Из него видно, что прочный пластмассовый корпус закрыт герметично крышкой и сверху оборудован двумя клеммами (обычно конусной формы) для подключения к электрической схеме автомобиля. На их выводах выбита маркировка полярности: «+» и «-». Как правило, для блокировки ошибок при подключении диаметр положительной клеммы немного больше, чем у отрицательной.
У обслуживаемых аккумуляторных батарей сверху каждой банки размещена заливная горловина для контроля уровня электролита или доливки дистиллированной воды при эксплуатации. В нее вворачиваются пробка, которая предохраняет внутренние полости банки от попадания загрязнений и одновременно не дает выливаться электролиту при наклонах АКБ.
Поскольку при мощном заряде возможно бурное выделение газов из электролита (а этот процесс возможен при интенсивной езде), то в пробках делаются отверстия для предотвращения повышения давления внутри банки. Через них выходят кислород и водород, а также пары электролита. Подобные ситуации, связанные с чрезмерными токами заряда, желательно избегать.
Стартерные автомобильные АКБ (свинцово-кислотные) работают по принципу двойной сульфатации. На них во время разряда/заряда происходит электрохимический процесс (окислительно-восстановительные и наоборот реакции), сопровождающийся изменением химического состава активной массы электродов с выделением/поглощением в электролит (серную кислоту) воды.
Этим объясняется повышение удельной плотности электролита при заряде и снижение при разряде батареи. Другими словами, величина плотности позволяет оценивать электрическое состояние АКБ. Для ее замера используют специальный прибор — автомобильный ареометр.
Современное производство для различных целей выпускает более трех десятков разнообразных по составу электродов и электролиту изделий.
Основные электрические характеристики аккумулятора
На эксплуатацию устройства влияют параметры:
· емкость;
· плотность энергии;
· саморазряд;
· температурный режим.
Емкостью называют максимальный заряд у аккумулятора, который он способен отдать во время разряда до наименьшего напряжения. Ее выражают в кулонах (система СИ) и ампер часах (внесистемная единица).
Как разновидность емкости существует «энергетическая емкость», определяющая энергию, отдаваемую при разряде до минимально допустимого напряжения. Она измеряется джоулями (система СИ) и ватт-часами (внесистемная единица).
Плотность энергии выражается соотношением количества энергии к весу или объему аккумулятора.
Саморазрядом считают потери емкости после заряда при отсутствии нагрузки на клеммах. Он зависит от конструкции и усиливается при нарушениях изоляции между электродами по многочисленным причинам.
Температурный режим эксплуатации влияет на электрические свойства и при серьезных отклонениях от указанной производителем нормы может вывести аккумулятор из строя. Жара и холод недопустимы, они влияют на протекание химических реакций и давление среды внутри банки.
Порядок выполнения работы
1. Изучить теоретические сведения.
2. Выполнить задания.
3. Оформить лабораторную работу.
4. Ответить на контрольные вопросы.
Ход работы
Задание 1 . Собрать гальванический элемент испытать и его.
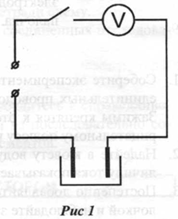
1. Нарисуйте в тетради электрическую цепь.
2. Заполните таб.1
| Наименование прибора | Предел измерения | Цена деления |
3. Соберите экспериментальную установку, как показано на рисунке 1. Установите в кювету медный и цинковый электроды. Медный электрод подключают к клемме вольтметра, помеченной знаком "+".
4. В кювету залейте раствор поверенной соли, замкните ключ, определите и запишите показания вольтметра.
5. Цинковый электрод замените вторым медным.
6. Определите и запишите показания вольтметра во втором опыте. Сделайте вывод о том, зависит ли напряжение на выводах гальванического элемента от вещества электродов.
7. Раствор соли вылейте из кюветы в стакан, кювету ополосните и залейте в нее раствор сахара.
8. Опыт повторите с двумя медными электродами и запишите показание вольтметра.
9. Опыт повторите, установив в кювету медный и цинковый электрод. Определите показание вольтметра, запишите его и сравните с результатом, полученным при заполнении кюветы раствором поваренной соли.
10. Сделайте вывод о том, зависит ли напряжение на выводах гальванического элемента от вещества, которое находится между его электродами.
Дата добавления: 2021-06-02; просмотров: 110; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
