Изучите параграф 30 и ответьте на вопросы:
§30-31
Запишите тему урока: Основные сведения о строении атомов. Строение электронных оболочек атомов.
В переводе с греческого «атом» означает «неделимый», однако учеными было установлено, что в состав атома входят более мелкие частицы. Их стали называть элементарными.
Запишите:
К элементарным частицам относятся:
1. Протоны - р
2. Нейтроны - n
3. Электроны - e
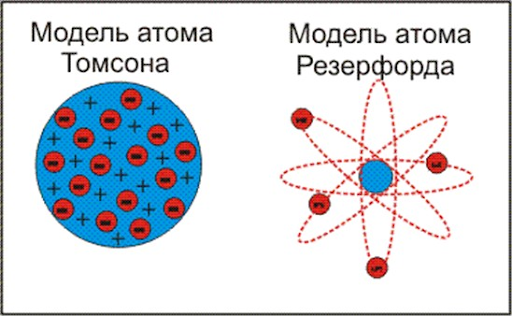
Ученые выдвигали различные гипотезы о модели строения атома. Наибольшую популярность приобрели две модели. Первая была предложена Д.Томсоном еще в 1895 году и получила название сливовый пудинг или булочка с изюмом. Согласно Томсону атом представляет собой шар размером порядка 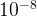 см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны. В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. В 1911 г. Э.Резерфорд предложил свою модель строения атома, названную в дальнейшем планетарной. В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
см. По этому шару некоторым образом распределён положительный заряд, а внутри шара, подобно изюминкам, находятся электроны. В конечном счёте она оказалась неверной, но сыграла важную роль, будучи стимулом последующих экспериментальных исследований Резерфорда. В 1911 г. Э.Резерфорд предложил свою модель строения атома, названную в дальнейшем планетарной. В этой модели Резерфорд описывает строение атома состоящим из крохотного положительно заряженного ядра, в котором сосредоточена почти вся масса атома, вокруг которого вращаются электроны, — подобно тому, как планеты движутся вокруг Солнца.
Более подробно модели строения атома, вы будете изучать в курсе физики.
Современная модель атома представлена на рисунке.
|
|
|
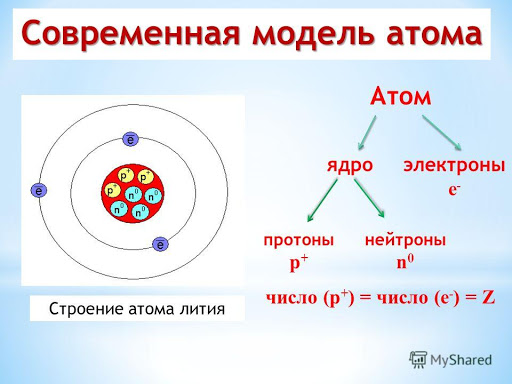 Зарисуйте модель строения атома (слева)
Зарисуйте модель строения атома (слева)
Запишите: Атом состоит из ядра в состав, которого входят протоны и нейтроны. Их называют нуклонами. А вокруг ядра располагаются электроны, совокупность которых называется электронной оболочкой.
Электрон - отрицательно заряженная частица. Заряд -1
Протон – положительно заряженная частица. Заряд +1
Нейтрон – нейтральная не имеющая заряда частица, имеющая массу 1.
При этом установлено, что число протонов соответствует числу электронов, поэтому атом в целом не имеет электрического заряда.
Стр.133 запишите определение – атом, химический элемент.
Изучите таблицу 13 и перенесите ее в тетрадь.
Давайте рассмотрим расчет протонов, электронов и нейтронов в атоме химического элемента.
Запишите:
N – число нейтронов
Z – число протонов (зарядовое число) - соответствует порядковому номеру химического элемента (Хэ) в ПСХЭ
A – массовое число (сумма протонов и нейтронов) соответствует относительное атомной массе Хэ в ПСХЭ (Ar)/
Массовое число записывается слева вверху от химического эл., порядковый номер слева внизу.
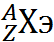
Для примера возьмем углерод – С
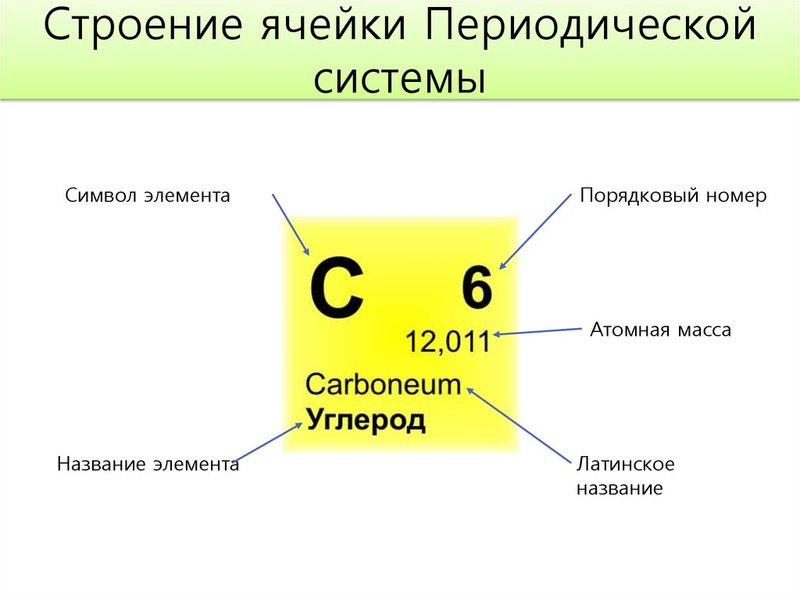
А = атомной массе округленной до целого числа, в данном случае =12
|
|
|
Z = порядковому номеру=6
Получится следующая запись:
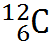
Z=6 значит в атоме 6 протонов и 6 электронов
Теперь найдем число нейтронов:
N=A-Z=12-6=6
Таким образом, у углерода:
6 р
6 n
6 e
Изучите параграф 30 и ответьте на вопросы:
1. Что такое ионы?
2. Что такое изотопы?
3. Как рассчитать среднюю относительную атомную массу Хэ?
Внимательно прочитайте параграф 31 и посмотрите видеофрагмент https://www.youtube.com/watch?v=kqHYbT9rv6A до 5минут 14 секунд, остальное можно не смотреть. Короткий файл прикреплен у меня на странице в вк.
Ответьте на вопросы:
1. Что такое электронная плотность?
2. Чему равно число электронных уровней?
3. Какие энергетические уровни называются завершенными?
Дата добавления: 2021-04-05; просмотров: 92; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
