Перегруппировка Бекмана как метод синтеза труднодоступных аминов
Перегруппировка Бекмана происходит при обработке оксимов кислотами Бренстеда или Льюиса, согласно общей схеме, приведенной ниже [12]:
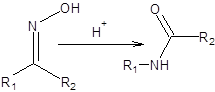
Схема 5.23
Механизм перегруппировки Бекмана предполагает миграцию заместителя, находящегося в транс-положении по отношению к уходящей группе к электронодефицитному азоту, как показано на схеме 5.24.

Схема 5.24
Для проведения региоселективной перегруппировки Бекмана необходимо использовать оксим заданной конфигурации. Необходимость использовать только один геометрический изомер оксима для обеспечения региоселективности реакции требует предварительного разделения их смеси, обыкновенно образующейся при обработке кетонов гидроксиламином. Поэтому синтетическая значимость перегруппировки Бекмана ограничивается использованием в качестве субстратов симметричных оксимов, например, оксимов циклических кетонов (схема 5.25).
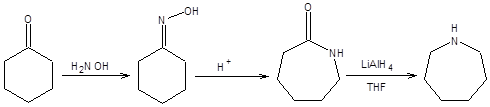
Схема 5.25
В некоторых случаях, когда один из изомерных оксимов образуется в значительном избытке, перегруппировка Бекмана становится ценным методом синтеза труднодоступных аминов. Катализ перегруппировки Бекмана серной кислотой или пентахлоридом фосфора также не допустим при ее применении к лабильным полифункциональным субстратам. В качестве каталитической системы для проведения перегруппировки Бекмана в мягких условиях в настоящее время используется смесь мезилхлорида и триметиламина в хлористом метилене (схема 5.26).
|
|
|
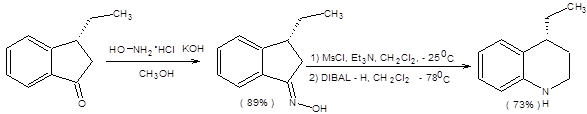
Схема 5.26
Перегруппировки Гофмана, Курциуса и Лоссеня. Реакция Шмидта
Перегруппировки Гофмана, Курциуса, Лоссеня и реакция Шмидта имеют схожие механизмы, включающие образование ацилнитрена в качестве ключевого интермедиата, и отличаются лишь способом его генерации. Синтетическая значимость указанных перегруппировок не велика, однако иногда они являются необходимым инструментом при решении некоторых синтетических задач.
А. Перегруппировка Гофмана
Перегруппировка Гофмана позволяет получать амины исходя из амидов с укорочением углеродной цепи на один атом, как показано на схеме 5.27.
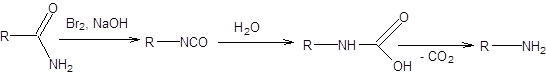
Схема 5.27
Предполагаемый механизм перегруппировки Гофмана включает образование ацилнитрена и представлен на схеме 5.28 [13].
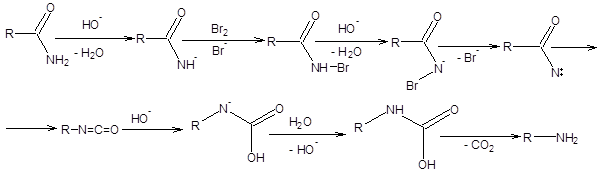
Схема 5.28
Б. Перегруппировка Курциуса
Перегруппировка Курциуса позволяет достичь той же цели, что и перегруппировка Гофмана, однако исходными соединениями для перегруппировки Курциуса являются ацилазиды [14]. Ацилазиды, как и амиды, легкодоступны и образуются при взаимодействии хлорангидридов карбоновых кислот и азидов щелочных металлов, согласно общей схеме, приведенной ниже:
|
|
|
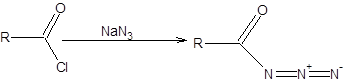
Схема 5.29
Механизм реакции Курциуса включает образование ацилнитренов при нагревании ацилазидов с последующим внедрением и приведен на схеме 5.30.
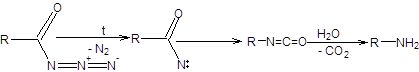
Схема 5.30
Перегруппировка Курциуса получила наибольшее синтетическое значение из всех ее аналогов, так как она протекает в относительно мягких условиях, а также позволяет остановить реакцию на стадии образования изоцианата при проведении реакции в ненуклеофильных растворителях. Изоцианаты проявляют разностороннюю реакционную способность по отношению к нуклеофилам и являются ценными реагентами (схема 5.31).
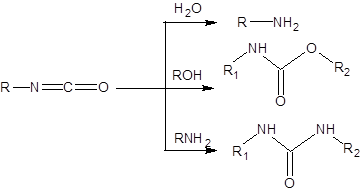
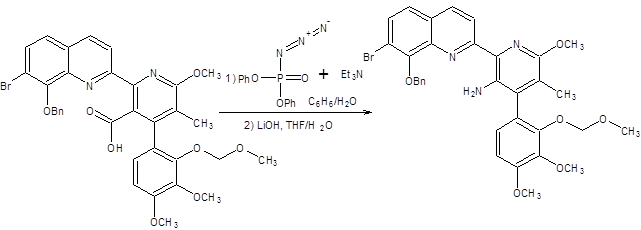

Схема 5.31
В. Перегруппировка Лоссена
Перегруппировка Лоссена аналогична перегруппировкам Гофмана и Курциуса. Перегруппировка Лоссена происходит при обработке ацилгидроксамовых кислот основаниями [15]. Механизм перегруппировки приведен на схеме 5.32.
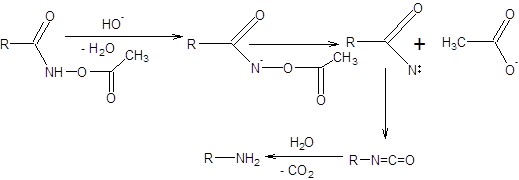
Схема 5.32
Гидроксамовые кислоты малодоступны, поэтому перегруппировка Лоссена редко применяется в органическом синтезе. Гидроксамовые кислоты получают из хлорангидридов в две стадии (схема 5.33).

Схема 5.33
Г. Реакция Шмидта
Реакция Шмидта позволяет получать амины исходя из карбоновых кислот, нитрилы из альдегидов и амиды из кетонов [16]. Механизм реакции Шмидта на субстратах различных классов приведен на схеме 5.34. Реакция Шмидта на кетонах имеет наибольшее синтетическое значение. Региоселективность реакции Шмидта определяется отношением скоростей миграции двух альтернативных заместителей, причем скорость миграции убывает при переходе от третичных к первичным радикалам.
|
|
|
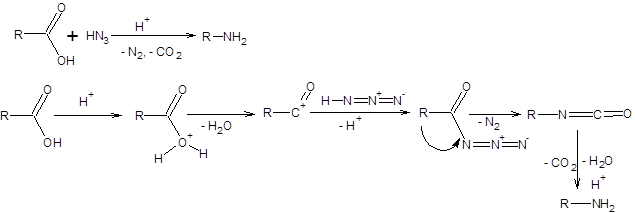
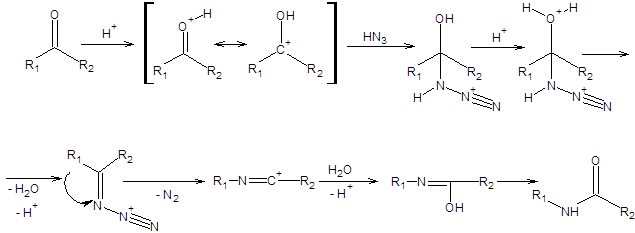
Схема 5.34
Реакция Шмидта также протекает при замене азотистоводородной кислоты на соответствующие алкилазиды с образованием диалкиламидов, в том числе и циклического строения (схема 5.35).

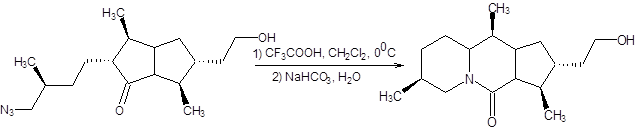
Схема 5.35
Реакция Брауна
Реакция Брауна позволяет осуществлять синтез первичных и вторичных аминов исходя из алкилборанов. Первичные амины образуются при взаимодействии алкилборанов с хлорамином или его аналогами, с последующим щелочным или кислотным гидролизом. Движущей силой процесса является миграция эквивалента карбаниона к азоту от четырехкоординационного атома бора (схема 5.36).
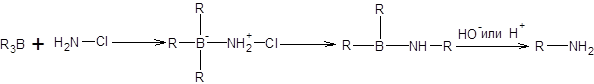

Схема 5.36
Вторичные амины образуются при взаимодействии алкилборанов с алкилазидами, как показано на схеме 5.37.
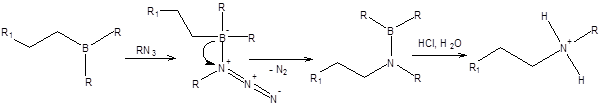
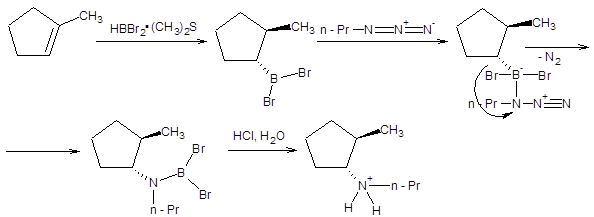
Схема 5.37
Реакция Брауна проста и весьма универсальна, что в совокупности с наличием отработанных методик позволяет считать ее одним из наиболее значимых методов синтеза первичных и вторичных аминов.
|
|
|
Дата добавления: 2021-05-18; просмотров: 176; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
