Mathematical model and computational aspects
Patient-oriented calculation of the blood flow in a proximal graft-artery anastomosis
Y F Ivanova1,2, L G Tikhomolova2, A D Yukhnev1,2, Y A Gataulin1,2,
E M Smirnov1,2, R V Kalmikova2, A N Morozov2, A A Suprunovich2,
A A Vrabiy2, G G Khubulava2
1 Peter the Great St. Petersburg Polytechnic University, 29 Polytechnicheskaya Str., 195251, St. Petersburg, Russia
2 Pavlov First Saint Petersburg State Medical University, 6-8 L'va Tolstogo Str., 197022, St. Petersburg, Russia
E-mail: radfn94@mail.ru
1. Introduction
В современной сосудистой хирургии одним из методов восстановления кровотока в сосудах является шунтирование. В частности, при бедренно-подколенном шунтировании устанавливается протез, соединяющий общую бедренную артерию (ОБА) проксимальным анастомозом выше и подколенную артерию (ПА) дистальным анастомозом ниже закупоренного участка артерии.
После операции шунтирования важно проконтролировать, насколько восстановились параметры кровотока, а также оценить риски послеоперационных осложнений, а именно, быстрого нарастания неоинтимы в области соединения сосуда с протезом (анастомоза). При послеоперационной диагностике, наряду с клиническими исследованиями, может быть использовано математическое моделирование, обеспечивающее возможность построения персонифицированной картины трехмерного течения крови в анастомозе [1-3].
Пациент-ориентированные расчеты позволяют оценить гемодинамические параметры, влияющие на нарастание неоинтимы. К настоящему времени выявлены следующие значимые для данного процесса параметры: максимальная величина сдвигового напряжения на стенке, осредненный по времени модуль сдвигового напряжения (TAWSS), индекс колебаний сдвиговых напряжений (OSI) [4-6]. Используя знания о взаимосвязи гемодинамических параметров с нарастанием неоинтимы в анастомозе, можно прогнозировать темпы его послеоперационного зарастания.
Целями настоящего исследования является разработка и пилотное приложение методики пациент-ориентированного расчетов кровотока в области проксимального анастомоза бедренной артерии.
2. Methods
Geometric model
Представляемая в настоящей работе персонифицированная 3D модель анастомоза построена на основе данных ангиографии, полученных методом мультиспиральной компьютерной томографии (GE Optima 660 с программным комплексом AWServer20 V.5.). Томография проводилась спустя 12 месяцев после бедренно-подколенного шунтирования линейным протезом Экофлон Л8-80 выше щели коленного сустава. Для построения модели использовались четыре компьютерные программы. В коде 3D Slicer медицинские изображения просматриваются, делятся на сегменты и выводятся в исходный файл с геометрическими данными. В программе VMTK (Vascular Modeling Toolkit) торцы 3D модели обрезаются перпендикулярно центральной линии сосуда и формируется фасеточное тело. В программе Rhino 6 фасеточное тело преобразуется в поверхность типа «polysurface». Наконец, код Siemens NX 10 используется для построения поперечных сечений сосудистого русла, в которых впоследствии задаются входные и выходные граничные условия для расчета кровотока.
Итоговая трехмерная модель представлена на рис. 1. Внутренний диаметр общей бедренной артерии (CFA) на входе в модель составляет 5 мм, глубокой бедренной артерии (DFA) – 3 мм, поверхностной бедренной артерии (SFA) – 2 мм, протеза (graft) – 8 мм.
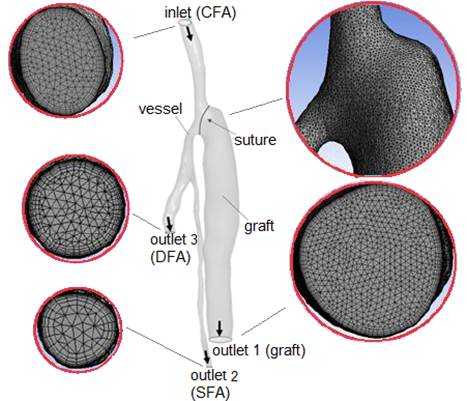
Figure 1. Персонифицированная геометрия области проксимального анастомоза бедренной артерии с протезом и примеры поперечных сечений расчетной сетки
Mathematical model and computational aspects
Рассматривалось пульсирующее течение несжимаемой вязкой жидкости с плотностью ρ = 1000 кг/м3 и вязкостью µ = 0.004 Па·с, характерной для течения крови в крупных сосудах. Упругость стенок сосудов и перенос тепла не учитывались.
Как и в предыдущей работе авторов [7], посвященной моделированию течения в среднестатистической модели дистального анастомоза, настоящие пациент-ориентированные расчеты проводились с применением гидродинамического пакета ANSYS CFX, обеспечивающего возможность численного интегрирования нестационарных трехмерных уравнений Навье-Стокса по методу конечных объемов.
Согласно методу конечных объемов, расчетная область разбивается на достаточно малые элементы (контрольные объемы), для каждого из которых применяются уравнения сохранения в интегральной форме с последующей аппроксимацией интегралов по квадратурным формулам и применением интерполяционных и конечно-разностных схем. В программном пакете ANSYS CFX контрольные объемы автоматически строятся вокруг узлов расчетной сетки.
Для численного моделирования кровотока в рассматриваемой модели анастомоза была построена (в программе Ansys Meshing) неструктурированная расчетная сетка, иллюстрируемая рис.1. Количество сеточных элементов составляет около 3 млн. Сетка содержит слой призматических элементов, сгущающихся к стенке c коэффициентом 1,4. При выполнении настоящих расчетов продвижение по физическому времени проводилось по схеме второго порядка, шаг по времени составлял 0.01 с. Для вычисления конвективных потоков использовалась опция “Second-order scheme”.
Для задания граничных условий были использованы персонифицированные данные клинических ультразвуковые измерения пульсирующей среднерасходной скорости (Mindrey 7) на разных участках анастомоза, проведенных по разработанному авторами протоколу измерений (рис. 2). Время цикла составляет 0.82 с. В момент максимального расхода среднерасходная скорость на входе в модель (CFA) составляет 80 см/с, а расход в протеза составляет 70% входного расхода. Зависимости среднерасходной скорости от времени были заданы в трех сечениях: на входе в модель, на выходе из протеза и на выходе из DFA. Профили скорости принимались плоскими. На выходе из SFA предписывалось нулевое значение редуцированного давления. На стенках задавалось условие прилипания.

Figure 2. Персонифицированные кривые среднерасходной скорости, использованные для задания граничных условий
Важнейшим параметром моделируемого пульсирующего течения является максимальное входное число Рейнольдса, построенное по внутреннему диаметру ОБА на входе и среднерасходной скорости в момент максимального расхода. Для рассматриваемой модели анастомоза максимальное число Рейнольдса составляет 1000. Пульсирующий кровоток характеризуется также числом Уомерсли. Значение данного параметра, построенного по входному радиусу ОБА и указанному выше периоду пульсаций, составляет 3.5.
Методические расчеты показали, что при старте с нулевых полей скорости периодическое решение практически устанавливается за два цикла. Приводимые ниже распределения среднего по циклу модуля сдвигового напряжения на стенках модели (TAWSS) и (безразмерного) индекса колебаний сдвигового напряжения (OSI) получены посредством осреднения актуальных данных по третьему циклу.
3. Results
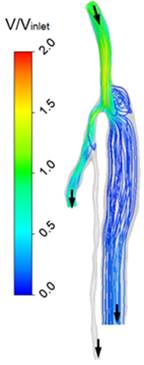
При анализе рассчитанного течения в области соединения сосуда с протезом обнаруживается застойная зона, протяженность которой в момент максимального расхода составляет около 10 мм (см. картину линий тока на рис. 3). Известно, что наличие застойных зон в анастомозе тесно связано с наличием областей малых значений осредненных по времени сдвиговых напряжений и повышенных значений индекса их колебаний. Эти особенности структуры течения в области анастомоза способствуют развитию процесса субинтимальной гиперплазии после операции.
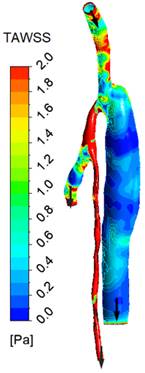
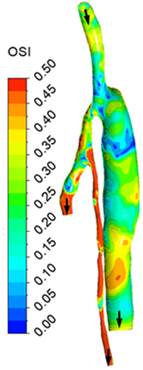
Зоны низких сдвиговых напряжений (менее 1 Па) наблюдаются в области соединения сосуда с шунтом и по длине всего шунта (рис.4). Что касается индекса колебаний сдвиговых напряжений, его «опасные» значения (0.5 и более) наблюдаются как непосредственно в области шва, так и в отдельных местах по длине шунта. Для получения интегральных оценок были вычислены также значения TAWSS и OSI, осредненные по участку стенки сосуда (на длине 20 мм) в области соединения сосуда с шунтом. Полученные оценки, составляющие, соответственно, 1.6 Па и 0.25, находятся вне диапазона значений указанных параметров с повышенными риском послеоперационных осложнений.
| 
| 
|
| Figure 3. Линии тока в момент максимального расхода | Figure 4. Поле осредненного по времени модуля сдвигового напряжения | Figure 5. Поле индекса колебаний сдвигового напряжения |
Рассчитанные локальные значения параметра ТAWSS были сопоставлены с данными ультразвуковых измерений толщины неоинтимы (рис. 6). Измерения проводились от «пятки» анастомоза (нижнего по потоку края пришивного шва) вдоль по стенке шунта на длине до 25 мм по ближней к ПБА стороне. Измеренное распределение толщины неоинтимы в целом коррелирует с расчетными данными для ТAWSS: при малых сдвиговых напряжениях наблюдается бОльшая толщина неоинтимы и, наоборот, при больших сдвиговых напряжениях толщина неоинтимы меньше.
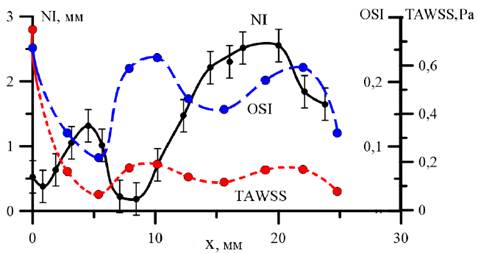
Figure 6. Изменение толщины неоинтимы NI, среднего модуля сдвигового напряжения TAWSS и индекса колебаний напряжений OSI вдоль внутренней стенке шунта (через год после операции)
4. Conclusions
Разработана методика пациент-ориентированных расчетов кровотока в области проксимального анастомоза при бедренно-подколенном шунтировании. Расчеты основываются на трехмерной геометрической модели, построенной по данным КТ ангиографии сосудистого русла в области анастомоза, и граничных условий, полученных путем УЗ доплеровских измерений скорости в контрольных сечениях русла. Проведен численный анализ структуры течения в частной модели проксимального анастомоза, характеризуемой 70% долей кровотока через шунт в момент максимального входного расхода. Определены размеры и расположение застойных зон, областей с низкими значениями осредненного по времени модуля сдвигового напряжения на стенки и с высокими значениями индекса колебаний напряжений. Показано, что результаты расчетного предсказания участков с пониженными значениями среднего модуля сдвигового напряжения, находятся в качественном согласии с данными локальных измерений толщины неоинтимы, образовавшейся вдоль стенки шунта через год после операции.
Acknowledgements
The study was carried out in the framework of Project No. 20-65-47018 supported by the Russian Science Foundation.
References
[1] Marsden A L 2014 Optimization in Cardiovascular Modeling Annual Review of Fluid Mechanics 46(1) 519–46
[2] Díaz-Zuccarini V, Agu O, Tomaso G Di and Pichardo-Almarza C 2014 Towards personalised management of atherosclerosis via computational models in vascular clinics: technology based on patient-specific simulation approach Health Technol Lett 1 13–8
[3] Randles A, Frakes D H and Leopold J A 2017 Computational Fluid Dynamics and Additive Manufacturing to Diagnose and Treat Cardiovascular Disease Trends in Biotechnology 35(11) 1049–61
[4] Haruguchi H and Teraoka S J 2003 Intimal hyperplasia and hemodynamic factors in arterial bypass and arteriovenous grafts: a review Artif Organs 6(4) 227-35
[5] McGah P M, Leotta D F, Beach K W, Riley J J and Aliseda A 2011 A longitudinal study of remodeling in a revised peripheral artery bypass graft using 3D ultrasound imaging and computational hemodynamics J Biomech Eng 133 41008 1-10
[6] Donadoni F, Pichardo-Almarza C, Bartlett M, Dardik A, Homer-Vanniasinkam S and Díaz-Zuccarini V 2017 Patient-Specific, Multi-Scale Modeling of Neointimal Hyperplasia in Vein Grafts Front. Physiol. 8 20
[7] Ivanova Y F, Yukhnev A D, Gataulin Y A, Smirnov E M, Vrabiy A A and Vavilov V N 2020 Numerical and experimental study of the 3D flowin a graft-artery junction model J. Phys.: Conf. Ser. 1675 012003 6
Дата добавления: 2021-05-18; просмотров: 66; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
