Понятие об истинных растворах.
Лекция по теме растворы.
Дисперсные системы (ДС)
Между микрочастицами, имеющими размер молекул и атомов (10-10 – 10-9 м), и макрочастицами величиной >10-4 м (>0,1 мм), находится большой класс частиц промежуточных размеров, которые составляют основу т.н. дисперсных систем.
1. Классификация ДС.
Дисперсными называют гетерогенные системы, состоящие из двух и более фаз, имеющих сильно развитую внутреннюю поверхность раздела, причем одна из фаз является сплошной средой (дисперcионная среда), а другие, распределены в ней в виде мелких включений (дисперсная фаза). Фазой называют гомогенную часть гетерогенной системы, отделенную от других частей поверхностью раздела, при переходе через которую все свойства изменяются скачкообразно.
Дисперсную фазу характеризуют дисперсностью – обратной величиной среднего размера частиц (D = 1/ d). По размеру частиц системы разделяют на грубодисперсные (d >10-6 м), тонкодисперсные или коллоидные (d <10-6 м). Последние могут иметь удельную поверхность до сотен м2/г.
Если дисперсная фаза представляет собой изолированные фрагменты, распределенные в дисперсионной среде, то такую бесструктурную ДС называют золем. Дисперсную систему, в которой дисперсная фаза представляет собой пространственную пленочную структуру, стенки которой сформированы твердыми частицами, а в ячейках находится дисперсионная среда, называют гелем.
|
|
|
Классификация ДС по агрегатному состоянию:
| Среда | Дисперсная фаза | Тип дисперсной системы | |
| Г | Т | Дым | Аэрозоль |
| Г | Ж | Туман | |
| Ж | Т | Суспензия | Лиозоль |
| Ж | Ж | Эмульсия | |
| Ж | Г | Пена | |
| Т | Г | Пенопласты |
Гель |
| Т | Ж | Почвы, грунты | |
| Т | Т | Эвтектические сплавы, бетоны | |
2. Образование ДС и их свойства.
Получают ДС двумя противоположными путями – диспергированием грубых частиц на более мелкие и агрегацией молекул или ионов в более крупные частицы. Первый вариант реализуется при механическом измельчении, распылении или растворении уже существующей, но осажденной дисперсной фазы (пептизация). Второй путь может быть физическим (конденсация пара с образованием тумана) или химическим (получение осадка в виде золя или геля при протекании химической реакции).
Важнейшее свойство дисперсных систем – высокая удельная поверхность. Поверхностный слой жидкости и твердого тела обладает свободной энергией за счет некомпенсированных химических связей внешних частиц (молекул или атомов). Это иллюстрирует рисунок 7.1.
| Рис 7.1. Модель кристаллического вещества, иллюстрирующая наличие на его поверхности некомпенсированных химических связей. |
Равнодействующая сил поверхностных частиц направлена внутрь данной фазы, поэтому капли жидкости стремятся приобрести сферическую форму.
|
|
|
Удельная поверхностная энергия называется поверхностным натяжением [Дж/м2] или [Н/м]. Это работа по созданию единицы площади новой поверхности. Чем больше , тем сильнее капля жидкости стремится к приобретению сферической формы. Силы межмолекулярного взаимодействия у жидкостей тем больше, чем выше полярность молекул. Поэтому поверхностное натяжение велико у сильнополярных жидкостей.
Поверхностная энергия (Fs) может быть рассчитана по формуле
Fs = S, (7.1)
где S – удельная поверхность.
Высокая удельная поверхностная энергия обусловливает ряд специфических свойств ДС, прежде всего, их высокую адсорбционную способность. Адсорбция – самопроизвольное концентрирование вещества на поверхности раздела фаз. Широко известна адсорбционная способность активированных углей, имеющих удельную поверхность до 500 м2/г.
Оценка устойчивости дисперсных систем.
Избыток поверхностной свободной энергии – причина термодинамической неустойчивости ДС. Дисперсная система проявляет стремление к расслоению, при котором удельная поверхность и поверхностная энергия снижаются на несколько порядков. Коагуляция (слипание частиц) и разрушение ДС происходит лишь при определенных условиях, отсутствие которых позволяет коллоидным растворам существовать неопределенно долго. Кинетическая устойчивость золейсогласно теории Дерягина-Ландау обусловлена ионно-электростатическим фактором стабилизации. Стабилизация обеспечивается электростатическим отталкиванием диффузных частей двойного электрического слоя, образующегося на поверхности частиц при адсорбции на ней ионов электролита.
|
|
|
Рассмотрим возникновение частиц при осаждении AgCl и их строение.
AgNO 3 + KCl = AgCl + KNO 3. (7.2)
В начальный момент осаждения имеет место недостаток Cl— -ионов. Сформировавшиеся первичные кристаллы образуют ядро мицеллы ( AgCl ) m, на котором адсорбируются прежде всего те ионы, которые по размеру и заряду соответствуют осаждаемому соединению. Первый адсорбционный слой формируется из имеющихся в растворе ионов Ag + . После формирования избыточного положительного заряда частицы осадка второй адсорбционный слой образуется из ионов противоположного знака - NO 3 — (формируется двойной электрический слой). Часть ионов NO 3 — адсорбирована, а часть свободно диффундирует в ближайшем слое дисперсионной среды (т.н. диффузионная часть двойного электрического слоя в дополнение к ранее сформированной адсорбционной части). Образующиеся при этом коллоидные мицеллы имеет строение, выражаемое формулой:
|
|
|
{( AgCl ) m nAg + ( n - x ) NO 3 — } x + x NO 3 —. (7.3)
Как следует из формулы, частицы мицелл несут одноименный (положительный) заряд, что препятствует их слипанию.
Добавление посторонних электролитов приводит к перезарядке частиц коллоидной мицеллы. Наблюдается коагуляция и разрушение дисперсной системы. Коагуляцию вызывают ионы, имеющие заряд, противоположный по знаку заряду частицы золя. Коагулирующее действие тем больше, чем выше заряд. Минимальное количество электролита в миллимолях, которое необходимо для коагуляции 1 л данного золя называют порогом коагуляции j. Зависимость порога коагуляции золя от величины заряда коагулирующего иона Z называют правилом Шульце – Гарди, ее выражает формула:
 , (7.4)
, (7.4)
где α – множитель. На основании этой зависимости пороги коагуляции одно- двух- и трехзарядных ионов относится, как
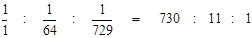 .
.
Al 2 ( SO 4 )3 – наиболее распространенный коагулянт, имеющий низкий порог коагуляции.
Для стабилизации дисперсных систем применяют поверхностно-активные вещества (ПАВ). Молекулы этих соединений, как правило, имеют неполярную углеводородную цепь, на конце которой находится полярная группа (- OH , - COOH , - NH 2 , - SO 3 H и др.). Адсорбируясь на поверхности частиц золя полярными группами, молекулы ПАВ препятствуют слипанию этих частиц и повышают устойчивость ДС. Рассмотренное взаимодействие объясняет также и причину моющего действия ПАВ.
Электрокинетические явления. Наличие двойного электрического слоя на поверхности частиц золя обусловливает специфические свойства ДС, проявляющиеся при пропускании через слой ДС постоянного тока. Движение дисперсной фазы в электрическом поле называют электрофорезом. Перенос дисперсионной среды через пористую мембрану под влиянием внешней разности потенциалов называют элекроосмосом . Оба названные явления широко применяются в современных технологиях для концентрирования и очистки препаратов.
Для дисперсных систем характерно рассеивание света. Размер частиц сравним с λ видимой части спектра. Поэтому длинные волны красного края видимой части спектра огибают коллоидные частицы, а короткие – фиолетового края – рассеиваются. В проходящем свете ДС имеют красную окраску, а в отраженном – голубую.
Образование и свойства гелей. При потере агрегативной устойчивости золей в результате сцепления частиц твердой фазы под действием ван-дер-ваальсовых сил образуются неупорядоченные пространственные сетки, ячейки которых заполнены дисперсионной средой. Часто контакт твердых частиц происходит через тонкую пленку дисперсионной среды. Для таких гелей характерна тиксотропия – обратимое разрушение структуры под нагрузкой. Структурированные ДС могут иметь каркас более жесткий, в котором прочность сцепления частиц сравнима с собственной прочностью дисперсной фазы.. Примером геля является силикатный клей, имеющий состав Н2 SiO 3 . n H 2 O.
Дисперсные системы распространены в природе и технологиях. Приведем некоторые примеры. В красках дисперсионная среда – олифа, а дисперсная фаза – пигмент. Через состояние золя, геля и образование более жесткой структуры протекает твердение минеральных вяжущих: гипса, цемента, извести. Эмульсии представляют собой молоко, сливки. Если в составе эмульсий дисперсная фаза составляет 75% и более, то их называют желатинизированными, это сливочное масло, майонез, консистентные смазки. Формирование дельт рек при впадении их в моря и океаны обусловлено коагуляцией частиц, взвешенных в пресной воде, при слиянии реки с соленой водой.
2. Основные положения теории растворов.
Большинство химических процессов в природе и технологии протекают в растворах.
Понятие об истинных растворах.
К истинным растворам относят многокомпонентные системы, не имеющие поверхностей раздела фаз. В них одни вещества распределены в среде других на молекулярном или ионном уровне (что не исключает существования в растворах ассоциатов молекул и ионов). Растворами называют однофазные системы, состоящие из двух и более компонентов, состав которых можно изменять в некоторых пределах без выделения новой фазы.
Истинные растворы образуются самопроизвольно за счет сил межмолекулярного взаимодействия между растворителем и растворяемым соединением. Процесс растворения невозможно отнести к чисто физическому смешиванию различных компонентов. Он сопровождается тепловым эффектом, а объем раствора не равен сумме объемов смешиваемых компонентов. Исследования показали, что в составе растворов часто присутствуют сольваты (для водных растворов – гидраты)определенного состава, например, в растворах серной кислоты H 2 SO 4 . H 2 O , H 2 SO 4 . 2 H 2 O . Эти признаки характерны для протекания химических реакций. Таким образом, истинные растворы занимают по своей природе промежуточное положение между механическими смесями и продуктами химической реакции.
Если при растворении нет теплового эффекта, а объем раствора равен сумме объемов компонентов, то такой раствор называют идеальным. Идеальные растворы рассматривают для теоретического вывода законов о поведении растворов.
Для выражения состава растворов применяют следующие формулы.
Массовая доля:
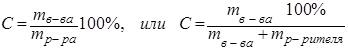 . (8.1)
. (8.1)
Молярная концентрация:
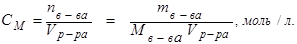 (8.2)
(8.2)
Эквивалентная концентрация:
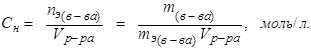 (8.3)
(8.3)
Моляльная концентрация:
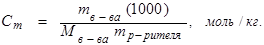 (8.4)
(8.4)
Мольная доля:
 . (8.5)
. (8.5)
Титр раствора, широко применяемый в аналитической химии:
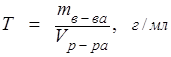 . (8.6)
. (8.6)
Закономерности растворения.
Обсудим закономерности процесса растворения. Раствор, находящийся в равновесии с избытком растворенного вещества, называют насыщенным. Концентрация насыщенного раствора при данной температуре называется растворимостью.
Образование раствора протекает самопроизвольно, следовательно, для этого процесса
G = H - T S < 0. (8.7)
При растворении твердого вещества в жидком растворителе энтропия возрастает ( S > 0). На разрушение химических связей в растворяемом веществе необходима затрата энергии (следовательно, Hр-рения > 0). Поскольку процесс растворения эндотермичен, то увеличение Т приводит к росту растворимости. Однако на практике растворение часто протекает с выделением теплоты (например, приготовление водного раствора гидроксида натрия приводит к сильному разогреванию вплоть до кипения). Причина этого – гидратация молекул или ионов растворяемого вещества. Гидратация – экзотермический процесс, а диспергирование нелетучего вещества на молекулярно-ионном уровне в среде растворителя – эндотермический. Наблюдаемый тепловой эффект процесса практически является суммой двух противоположных по знаку теплот разрушения растворяемого кристалла и гидратации его молекул или ионов.
Важной характеристикой жидкого растворителя является давление его равновесных насыщенных паров при данной температуре.
Давление пара растворителя.
Обсудим зависимость «Р-Т» для универсального растворителя – воды.
Диаграмма зависимости давления пара от температуры воды приведена на рис. 8.1. Из нее следует, что каждому значению Т соответствует определенное значение давления насыщенных паров. Повышение Т приводит к росту Р. Достижение давлением насыщенного пара величины Ратм приводит к тому, что испарение воды протекает не только с поверхности, но и с любой точки объема – вода кипит. Условие замерзания воды –
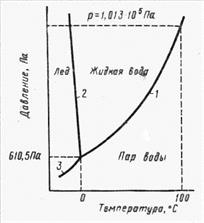
| Рис.8.1. Фазовая диаграмма воды: 1- линия равновесия водапар; 2- линия равенства давлений над водой и льдом; 3- линия равновесия лед пар. |
равенство давления над жидкостью и льдом (кривая 3 на рис. 8.1, называемая линией кристаллизации). Это условие для нормального атмосферного давления выполняется при Т = 0 оС.
Законы Рауля и Вант Гоффа.
Выведем закон Рауля, связывающий изменение давления пара растворителя с величиной концентрации растворенного вещества.
При некоторой температуре для чистого растворителя установилось равновесие «жидкость - пар», которому соответствует давление Ро. Растворим в этой жидкости некоторое нелетучее вещество (например, глюкозу). При этом мольная доля растворителя N 1 уменьшится от 1 до некоторого другого значения. Согласно принципу Ле Шателье, система, чтобы ослабить внешнее воздействие и частично компенсировать снижение N 1, сместит равновесие влево и конденсирует часть пара. Его давление понизится. Исходя из этого рассуждения
Р = К N1.
Если N1=1, то Р =Ро, следовательно, К=Ро, тогда Р = Ро N1. Но, состав раствора принято выражать содержанием не растворителя, а растворенного вещества, т.е. N1 = 1 – N2. Тогда Р = Ро (1 – N2), и Р = Ро–Ро N2. Окончательно закон Рауля (1886) запишем в виде:
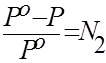 . (8.8)
. (8.8)
Он гласит: относительно понижение давления пара растворителя равно мольной доле растворенного вещества. На основании этого закона ведут расчет процессов дистилляции и рассчитывают состояния равновесия в многокомпонентных системах.
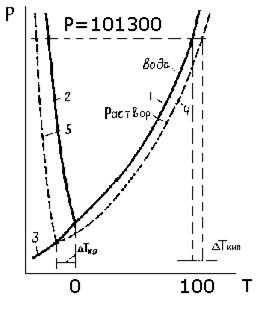 |
Согласно рассмотренному выше закону, давление пара растворителя над раствором при любой температуре ниже, чем над чистым растворителем. Таким образом, линии равновесия в координатах «Р-Т» для водного раствора будут смещены по отношению к соответствующим линиям чистой воды (рис. 8.2). Сравнение хода линий равновесия 4 и 5 показывает,
Рис.8.2. Фазовая диаграмма воды (сплошная линия)
и давления пара над водным раствором (пунктир).
что раствор кипит при большей Т, чем растворитель, а замерзает - при меньшей.
На основании закона Рауля установлены зависимости для изменения температуры кипения и замерзания растворов по сравнению с чистым растворителем:
Ткр. = К · С m , (8.9)
Ткип. = Е · С m , (8.10)
где К – криоскопическая, Е – эбуллиоскопическая постоянные растворителя. Для воды К = 1,86; Е = 0,52.
Зависимости (8.9) и (8.10) позволяют найти молярную массу вещества по Ткр. или Ткип, поскольку в формулу для выражения Сm входит молярная масса растворенного вещества (см. уравнение (8.4.)). Соотношение (8.9) используют при расчете состава антифризов – растворов, не замерзающих при низких температурах.
Осмос.
Если опустить вертикально в раствор трубку, нижнее отверстие которой перекрыто мембраной (например, пленки животного происхождения, целлофан), то через некоторое время растворитель в трубке поднимется над уровнем раствора. Высота подъема может быть весьма значительной. Самопроизвольный процесс одностороннего проникновения молекул растворителя через мембрану называют осмосом. Этому процессу можно воспрепятствовать, если к поверхности растворителя в трубке приложить давление. Минимально необходимое давление, делающее невозможным осмос называется, осмотическим. Вант Гофф установил закон зависимости осмотического давления от молярной концентрации раствора:
Росм. = С M R T (8.10)
Отсюда следует:
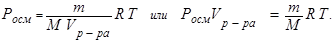 (8.10)
(8.10)
Последнее выражение соответствует уравнению Клапейрона - Менделеева, что позволяет дать следующую формулировку закона: осмотическое давление равно тому давлению, которое имело бы растворенное вещество, если бы оно было газом и занимало объем раствора. Закон позволяет определить молярную массу растворенного вещества по величине осмотического давления раствора.
Мембранные процессы, теоретической основой которых является закон Вант Гоффа, – основа технологии очистки растворов и концентрирования растворенных веществ (диализ), а также клеточного обмена в живой природе.
Дата добавления: 2021-05-18; просмотров: 53; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
