Клиническая значимость: ферменты и анестезиолог
Ферменты
Ферменты - это биологические катализаторы, функция которых заключается в увеличении скорости метаболических реакций.
Что такое катализатор?
Катализатор - это вещество, которое увеличивает скорость химической реакции, не будучи само химически измененным. Поскольку катализатор не расходуется в реакции, он может быть вовлечён в повторяющиеся химические реакции – требуется лишь относительно небольшое количество молекул катализатора.
Каковы основные свойства фермента?
Ферменты - это сложные трёхмерные белки, обладающие тремя важными свойствами:
- Катализ. Ферменты действуют как катализаторы биологических реакций.
- Специфичность. Их сложная трёхмерная структура приводит к высокоспецифичному связыванию – активному участку – для реагирующих молекул или субстратов. Активный центр может даже различать различные стереоизомеры одной и той же молекулы.
- Регулирование. Многие реакции в биохимических путях (например, гликолитический путь) протекают очень медленно в отсутствие ферментов. Поэтому скорость биохимического пути можно контролировать, регулируя активность ферментов на его пути, в частности фермента, контролирующего стадию замедления скорости, которым в случае гликолиза является фосфофруктокиназа.
Как работает фермент?
Ферменты работают, связывая субстраты в определённой ориентации, приводя их в оптимальное положение для совместной реакции. Это снижает энергию активации химической реакции, что резко увеличивает скорость реакции. Трёхмерная форма активного участка имеет решающее значение. Если форма активного центра изменяется (например, при повышении температуры или рН), функция фермента может быть нарушена и химическая реакция замедлена.
|
|
|
Например, реакция между CO2 и водой, дающая углекислоту (H2CO3), очень медленная:
CO2 + H2O = H2CO3
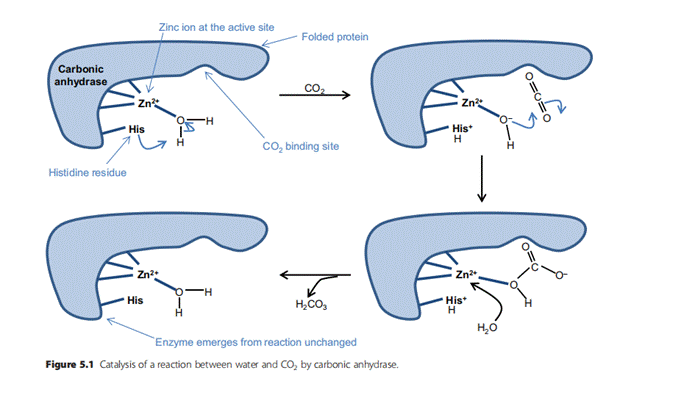
Однако добавление фермента карбоангидразы (СА), содержащего атом цинка в своём активном центре, к смеси СО2 и воды значительно увеличивает скорость реакции. Сначала вода связывается с атомом цинка, затем соседний остаток гистидина удаляет из воды ион H+, оставляя высокоактивный ион OH‾, прикрепленный к цинку (рис. 5.1). Наконец, в активном центре есть карман, который идеально подходит для молекулы CO2: когда CO2 и OH находятся в непосредственной близости, химическая реакция происходит быстро. После того, как CO2 и вода вступили в реакцию, полученная H2CO3 диффундирует из фермента, оставляя его химически неизменным; то есть фермент действует как катализатор.
Тот же фермент может катализировать и обратную реакцию. Это действительно относится к СА, который катализирует
|
|
|
H2CO3 = H2O + CO2
Газированные напитки дегазируются довольно медленно, когда их контейнер открыт, но дегазируются очень быстро при контакте со слюной, которая содержит CA. Это даёт ощущение газированных напитков, которые "шипят" на языке.
Общее направление реакции подчиняется принципу Ле Шателье: если химическое равновесие испытывает изменение концентрации или парциального давления, равновесие сдвигается, чтобы противодействовать этому изменению, и достигается новое равновесие. Ферменты увеличивают скорость, с которой достигается равновесие.
Какие существуют типы ферментов?
Ферменты классифицируются по типу биологической реакции, которую они катализируют:
- Оксидоредуктазы, катализирующие окислительно-восстановительные (окислительно-восстановительные) реакции.
- Трансферазы, которые переносят функциональные группы (например, киназа переносит фосфатную группу) от одной молекулы к другой.
- Гидролазы, катализирующие реакции гидролиза.
- Лиазы, которые расщепляют связи другими способами, кроме гидролиза и окисления.
- Изомеразы, которые позволяют молекуле взаимодействовать между своими изомерами.
|
|
|
- Лигазы, которые используют энергию (полученную в результате гидролиза АТФ) для соединения двух молекул вместе с ковалентными связями.
Что подразумевается под терминами "кофактор" и "кофермент"?
Некоторые ферменты состоят исключительно из белка и сами катализируют биологические реакции. Другие ферменты нуждаются в небелковых молекулах (называемых кофакторами), чтобы помочь их ферментативной активности. Кофакторы могут быть:
- Неорганическими. Многие ферменты содержат ионы металлов в своем активном месте. Например:
– CA содержит Zn2+, как обсуждалось выше.
– Все ферменты группы цитохрома Р450 содержат Fe2+.
– Витамин В12 содержит Co2+.
– Супероксиддисмутаза содержит Cu2+.
– Гексокиназа содержит Mg2+.
- Органическими. Когда кофактор органический, его называют "коферментом". Например:
– Коэнзим А (КоА), коэнзим, используемый для переноса ацильных групп различными ферментами (например, ацетил-КоА карбоксилазой).
– никотинамидадениндинуклеотид (NAD+), кофермент, который принимает гидридный ион (H‾). NAD+ используется, например, в сочетании с ферментом алкогольдегидрогеназой.
Клиническая значимость: ферменты и анестезиолог
|
|
|
Ферменты очень важны в анестезиологической практике. Многие из препаратов, которые мы используем, прекращают свое действие ферментативной активностью; другие действуют путем прямого ингибирования ферментов. Некоторые заболевания являются результатом снижения ферментативной активности.
Примеры:
- Цитохром Р450. Это суперсемейство ферментов отвечает за метаболизм большинства обезболивающих препаратов. Заметные исключения включают атракурий и цисатракурий (которые деградируют в основном путем элиминации Гофмана), катехоламины, суксаметоний, мивакурий и ремифентанил (см. ниже).
- Моноаминоксидаза (МАО). Моноаминовые катехоламины (адреналин, дофамин, норадреналин) метаболизируются этим митохондриальным ферментом. Ингибиторы МАО являются антидепрессантами, что имеет важное значение для анестезиолога: симпатомиметики непрямого действия могут вызвать потенциально фатальный гипертонический криз. При необходимости можно использовать симпатомиметики прямого действия в сниженной дозе, поскольку они также метаболизируются другим ферментом-катехол-О-метилтрансферазой (КОМТ). Ингибиторы МАО также участвуют в расщеплении серотонина. При применении с другими серотонинергическими препаратами, такими как петидин, может развиться серотониновый синдром.
- Псевдохолинэстераза (также известная как холинэстераза плазмы и бутирилхолинэстераза). Это фермент плазмы, который метаболизирует суксаметоний и мивакурий. Пациенты, которым не хватает этого фермента или у которых снижена активность фермента, испытывают длительный мышечный паралич после дозы суксаметония или мивакурия – состояние, известное как "апноэ суксаметония".
- Ацетилхолинэстераза (АцхЭ). Это фермент, обнаруженный в синаптической щели нервно-мышечного соединения. Он гидролизует нейромедиатор Ацх, прекращая нейромедиацию. Неостигмин, обратимый ингибитор боли, используется для увеличения концентрации Ацх в синаптической щели. Повышенный уровень Ацх конкурентно вытесняет недеполяризующие миорелаксанты из их рецепторов.
- Неспецифические тканевые и плазменные эстеразы. Они отвечают за быстрый гидролиз ремифентанила, опиоида ультракороткого действия. Это означает, что накопление не происходит, и контекстно-зависимый период полувыведения остается на уровне 4 мин даже после длительной инфузии. Эсмолол, "кардиоселективный" антагонист β1-рецепторов, используемый для лечения тахиаритмий во время анестезии и для контроля частоты сердечных сокращений и артериального давления во время кардиохирургических операций, быстро разлагается эритроцитарными эстеразами. Это приводит к быстрому прекращению эффекта после отмены.
Дата добавления: 2021-05-18; просмотров: 68; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
