Особенности номенклатуры алкенов
Химические свойства алканов
Реакции замещения.
А) Галогенирование
при действии света - hν или нагревании (стадийно – замещение атомов водорода на галоген носит последовательный цепной характер. Большой вклад в разработку цепных реакций внёс физик, академик, лауреат Нобелевской премии Н. Н. Семёнов )
В реакции образуются вещества галогеналканы RГ или Сn H2n+1Г
(Г - это галогены F, Cl, Br, I)
CH4 + Cl2 hν → CH3Cl + HCl (1 стадия) ;
метан хлорметан
CH3Cl + Cl2 hν → CH2Cl2 + HCl (2 стадия);
дихлорметан
СH2Cl2 + Cl2 hν → CHCl3 + HCl (3 стадия);
трихлорметан
CHCl3 + Cl2 hν → CCl4 + HCl (4 стадия).
тетрахлорметан
Скорость реакции замещения водорода на атом галогена у галогеналканов выше, чем у соответствующего алкана, это связано с взаимным влиянием атомов в молекуле:


Электронная плотность связи С – Cl смещена к более электроотрицательному хлору, в результате на нём скапливается частичный отрицательный заряд, а на атоме углерода – частичный положительный заряд.
На атом углерода в метильной группе ( - СН3) создаётся дефицит электронной плотности, поэтому он компенсирует свой заряд за счёт соседних атомов водорода, в результате связь С – Н становится менее прочной и атомы водорода легче замещаются на атомы хлора. При увеличении углеводородного радикала наиболее подвижными остаются атомы водорода у атома углерода ближайщего к заместителю:
|
|
|
CH3 – CH2 – Cl + Cl2 hν → CH3 – CHCl2 + HCl
хлорэтан 1,1 -дихлорэтан
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Йодирование происходит обратимо, поэтому требуется окислитель для удаления HI из реакции.
Внимание!
В реакциях замещения алканов легче всего замещаются атомы водорода у третичных атомов углерода, затем у вторичных и, в последнюю очередь, у первичных. Для хлорирования эта закономерность не соблюдается приT>400˚C.
4 3 2 1
CH3-CH2-CH-CH3 + Cl2 hν → смесь галогеналканов.
│
CH3 1; 4 – первичные; 3 – вторичный; 2 – третичный.
б) Нитрование (реакция М.И. Коновалова, он провёл её впервые в 1888 г)
CH4 + HNO3 t˚ С → CH3NO2 + H2O
раствор нитрометан
RNO2 или Сn H2n+1 NO2 (нитроалкан)
t˚С , Ni или Pd
|
|
|
2. Реакции отщепления (дегидрирование) а) CnH2n+2 → CnH2n + H2
б) При нагревании до 1500 С происходит образование ацетилена и водорода:
1500°С
2CH4 → C2H2 + 3H2
3. Реакции перегруппировки (изомеризация) AlCl3, t°С
н-алкан → изоалкан
4. Реакции горения (горят светлым не коптящим пламенем), алканы с небольшой молекулярной массой загораются легче, чем алканы с большой молекулярной массой. t°С
CnH2n+2 + O2 → nCO2 + (n+1)H2O
Помните! Смесь метана с воздухом и кислородом взрывоопасна
V(CH4) : V(O2) = 1: 2
V(CH4) : V(воздуха) = 1 : 10
Реакции разложения
а) Крекинг при температуре 700-1000°С разрываются (-С-С-) связи:
C10H22 t°С → C5H12 + C5H10
алкан алкен
б) Пиролиз при температуре 1000°С разрываются все связи, продукты – С и Н2:
1000°С
|
|
|
СH4 → C + 2H2
в) Конверсия метана с образованием синтез-газа (СО + Н2)
CH4 + H2O 800˚C, Ni → СО + 3Н2
Получение алканов
Получение метана
1. В п р о м ы ш л е н н о с т и:
а) из природного газа
б) синтез-газа (СО + Н2), т.е. из оксида углерода (II) и водорода: Ni,300˚C
CO + 3H2 → CH4 ↑ +H2O
2. В л а б о р а т о р и и
а) гидролиз карбида алюминия Al4C3 +12H2O → 3CH4 ↑ +4Al(OH)3
б) сплавление солей уксусной кислоты со щелочами t˚
CH3COONa +NaOH (т) → CH4 ↑ +Na2 CO3
Получение гомологов метана.
1. В п р о м ы ш л е н н о с т и
а) из природного сырья (нефть, газ, горный воск)
б) синтез из оксида углерода (II) и водорода
2. В л а б о р а т о р и и
а) каталитическое гидрирование непредельных углеводородов (алкенов, алкинов)
Pt Ni,150˚C
CnH2n + H2 → CnH2n+2 CnH2n-2 + 2H2 → CnH2n+2
|
|
|
б) взаимодействие галогеноалканов с натрием (реакция Вюрца)
2R−Br + Na → R−R +2NaBr
2CH3Br + Na → CH3 − CH3 +2NaBr
ДОМАШНЕЕ ЗАДАНИЕ
1) Среди данных формул найдите 2 изомера и назовите их:
а) СН3-СН2-СН2-СН2-СН3 б) СН3-СН2-СН2-СН3 в) СН3-СН-СН2-СН3
|
СН3
2) Допишите уравнения реакций
1) C4H10 →t
2) CH4 + Br2 →
3) С2Н6 + НNО3 →
3) Осуществить цепочку превращений: СН4 → СН3Вr → С2Н6 , назвать продукты реакций.
4) Определить предельный углеводород, плотность паров которого по водороду равна 29.
5) Изучить § 7, глава 1, учебник 10 кл., Г.Е. Рудзитис, Ф.Г. Фельдман, стр. 30, №5, 7, тесты
6) Изучить § 8, 9 глава 1, учебник 10 кл., Г.Е. Рудзитис, Ф.Г. Фельдман, стр. 34, №5, тесты/ 
УРОК № 54
Тема: Алкены
Базовые понятия и термины: алкены, кратные связи, структурные формулы, изомерия и номенклатура, изомерия по углеродному скелету и по положению кратных связей
Смотреть по ссылке: https://www.youtube.com/watch?v=KYR0ezBGPQw
АЛКЕНЫ - это ненасыщенные углеводороды с общей формулой CnH2n, в молекулах которых имеется одна двойная связь С=С.
Особенности номенклатуры алкенов
Принадлежность углеводорода к классу алкенов отражают суффиксом –ен:
С2Н4 CH2=CH2 этен (этилен)
С3Н6 CH2=CH2-СН3 пропен (пропилен)
С4Н8 CH2=CH2-СН2-СН3 бутен и т.д.
Особенности строения молекул
В этилене углерод находится в состоянии sp2-гибридизации (в гибридизации участвуют одна s и 2 p-орбитали). У каждого атома углерода в молекуле этилена – 3 гибридные sp2-орбитали и по одной негибридной р-орбитали. Оси гибридных орбиталей располагаются в одной плоскости, а угол между ними равен 120°.Такие орбитали каждого атома углерода пересекаются с аналогичными другого атома углерода и s-орбиталями двух атомов водовода, образуя σ-связи С-С и С-Н.

 Схема образования σ-связей в молекуле этилена
Схема образования σ-связей в молекуле этилена
Две негибридных р-орбитали атомов углерода взаємно перекрываются в плоскости, которая расположена перпендикулярно к плоскости σ-связей, образуя одну π-связь.
 Схема образования π-связи в молекуле этилена
Схема образования π-связи в молекуле этилена
Чтобы назвать алкен,
- соединение нумеруют, начиная с того конца, к которому ближе двойная связь;
- положение двойной связи указывают в конце названия номером того атома углерода, от которого она начинается.
Изомерия алкенов
1. Структурная изомерия.
1. Изомерия строения углеродной цепи.
2. Изомерия положения двойной связи.

Пространственная изомерия.
1. Геометрическая изомерия (цис-/транс-)

Физические свойства
C2H4 – C4H8 – газы, С5Н10 – С17Н34 – жидкости, С18Н36 и выше – твердые вещества.
Получение
1. В промышленности – из природного газа и при процессах крекинга и пиролиза нефти.
2. Дегидратация (отщепление воды) спиртов.

3. Дегидрирование (отщепление водорода) алканов.
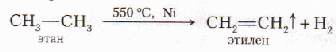
4. Из галогенпроизводных (дегидрогалогенирование)
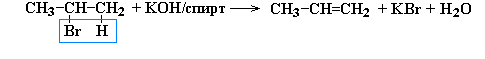 :
:
2-бромпропан пропен
Реакции дегидрогалогенирования и дегидратации идут по правилу Зайцева:
Водород отщепляется от соседнего менее гидрированного атома углерода.

И др.
Химические свойства
Реакции присоединения
1. Взаимодействие с галогенами
Качественная реакция на наличие двойных связей – обесцвечивание бромной воды!

2. Гидрирование.

kt – Ni, Pt, Pd.
3. Гидратация (присоединение воды)

Реакции гидратации идут в присутствии серной или ортофосфорной кислот.
4. Реакция с галогеноводородами (гидрогалогенирование).


Реакции окисления.
1. Горение.

2. Реакция с раствором перманганата калия.
Обесцвечивание раствора перманганата калия (ярко-розовая окраска) – качественная реакция на двойную C=C связь!

Кроме раствора KMnO4, можно использовать другие мягкие окислители.
3. Частичное окисление кислородом воздуха.

Реакции полимеризации.

Катализаторы катионной полимеризации – кислоты, пероксиды, например – H2O2.
Реакция полимеризации – химический процесс соединения множества исходных молекул низкомолекулярного вещества (мономера) в крупные молекулы(макромолекулы) полимера.
Полимер – высокомолекулярное соединение, молекулы которого состоят из множества одинаковых структурных звеньев.
Применение этилена – сырье для ускорения созревания фруктов, производства горючего, пластмасс, взрывчатых веществ, антифризов, растворителей, ацетальдегида, этилового спирта, синтетического каучука, уксусной кислоты и др.
Применение полиэтилена – материал для изготовления медицинского оборудования, предметов домашнего обихода, тары, пленок, клейкой ленты, деталей и др.
ДОМАШНЕЕ ЗАДАНИЕ
1) Изучить § 10, 11 глава 1, учебник 10 кл., Г.Е. Рудзитис, Ф.Г. Фельдман, стр. 48, тесты, стр.54, №3, тесты.
2) Составить формулы всех изомеров алкена состава С6 и назвать их.
3) Напишите структурные формулы двух гомологов пентена-2 и назовите их.
4) Среди данных формул найдите 2 изомера и назовите их:
а) СН3-СН=СН-СН2-СН3 б) СН3-СН=СН-СН3 в) СН3-С=СН2-СН3
|
СН3
5) Допишите уравнения реакций и назовите продукты реакций
1) C4H10 →t Н2 + …..
2) C3H6 + Н2 →
3) C3H6 + Н2О →
4) C3H6 + Br2 →
5) C3H6 + НBr →
6) Осуществить цепочку превращений: С2Н6 → С2Н4 → С2Н5Вr → С2Н6 , назвать продукты реакций.
7) Учебник 10 кл.: §10, 11, стр.48, № 6 и тесты, стр. 54 тесты.

Стр.48, упр. 6 и тесты

Стр.54, тесты
Дата добавления: 2021-05-18; просмотров: 74; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
