Тяжелые формы магнезии из магнезита и доломита
Обжигом высокосортного магнезита при относительно невысоких температурах получают магнезию, содержащую все примеси, имевшиеся в магнезите. При высокотемпературном обжиге магнезита получается неактивная форма окиси магния, состоящая из крупных зерен периклаза, она носит название металлургического порошка и применяется для изготовления огнеупоров. Обжиг магнезита осуществляют в шахтных, вращающихся и механических полочных печах, а также в печах со взвешенным слоем.
Существует несколько способов получения магнезий:
Известковый;
Аммиачный;
Гидросульфидный;
Термическое разложение сульфата магния.
Соли магния
Физиологические функции.
возбуждение клеток мускул и нервных клеток;
сокращение мышц;
играет ключевую роль во многих различных метаболических процессах;
участвует в образовании и поддержки зубов и костей скелета;
стабилизация внутренней структуры клетки.
Потребление магния в необходимых нормах является обязательным для:
Беременных женщин и кормящих матерей для обеспечения нормального протекания беременности и развития ребенка.
Атлетов склонных к потере высоких количеств магния во время потения.
Суточная потребность магния для взрослых варируется между 300-400 мг, в зависимости от ситуации человека. Дефицит магния, или гипермагнезимия, вызванный увеличенной необходимостью или из-за недостаточности. Судороги мышц, нервозность, головные боли и аритмия - некоторые из возможных последствий дефицита магния. Однако, не всегда возможно получить суточную норму магния через пищу.
|
|
|
Свойства смесей магния
Приблизительно 20 смесей магния одобрены в пищевых целях. Эти смеси магния обычно предлагаются в форме прозрачных кристаллов или белых порошков.
Водные нерастворимые смеси магния имеют нейтральный вкус. У некоторых водных смесей магния есть более интенсивный вкус (кислый, горький).
Свойство солей магния
| 1. Оксид магния | высокое содержание Мg нейтральный вкус мелкий порошок |
| 2. Магния глицерофосфат | должная водная растворимость нейтральный вкус источник фосфора |
| 3. Карбонат магния | высокое содержание Мg нейтральный вкус мелкий порошок |
| 4. Глюконат магния | высокая водная растворимость нейтральный вкус нейтральный pH фактор |
| 5. Магния гидроген цитрат | приятный вкус очень хорошая водная растворимость |
| 6. Лактат магния | хорошая водная растворимость нейтральный pH фактор |
| 7. Тримагниядицитрат ангидрид | нейтральный вкус хорошая водная растворимость хорошее содержание Мg |
| 8. Сульфат магния, высушенный | разрешимая вода высокое содержание Мg |
|
|
|
Оксид магния
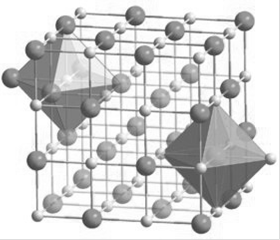
Окси́д ма́гния-(жжёная магнезия, периклаз) - химическое соединение с формулой Mg <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B8%D0%B9><http://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>, бесцветные кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен. Основная форма - минерал периклаз <http://ru.wikipedia.org/wiki/%D0%9F%D0%B5%D1%80%D0%B8%D0%BA%D0%BB%D0%B0%D0%B7>.
| 1. Физические свойства. | Легкий, рыхлый порошок белого цвета, легко впитывает воду. На этом свойстве основано его применение в спортивной гимнастике, нанесенный на ладони спортсмена, порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления - 2825 °C температура кипения - 3600 °C.Плотность=3,58 г/см3. |
| 2.Химические свойства. | Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2: MgO + 2HCl(разб.) → MgCl2 + H2O; MgO + H2O → Mg(OH)2. |
| 3.Получение. | Получают обжигом минералов <http://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B5%D1%80%D0%B0%D0%BB> магнезита <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B5%D0%B7%D0%B8%D1%82> и доломита <http://ru.wikipedia.org/wiki/%D0%94%D0%BE%D0%BB%D0%BE%D0%BC%D0%B8%D1%82>. 2Mg + O2 = 2MgO. |
| 4.Применение. | В промышленности применяется для производства огнеупоров <http://ru.wikipedia.org/wiki/%D0%9E%D0%B3%D0%BD%D0%B5%D1%83%D0%BF%D0%BE%D1%80%D1%8B>, цементов <http://ru.wikipedia.org/wiki/%D0%A6%D0%B5%D0%BC%D0%B5%D0%BD%D1%82>, очистки нефтепродуктов <http://ru.wikipedia.org/wiki/%D0%9D%D0%B5%D1%84%D1%82%D0%B5%D0%BF%D1%80%D0%BE%D0%B4%D1%83%D0%BA%D1%82>, как наполнитель при производстве резины <http://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%B7%D0%B8%D0%BD%D0%B0>. Сверхлегкая окись магния применяется как очень мелкий абразив для очистки поверхностей, в частности, в электронной промышленности. В медицине <http://ru.wikipedia.org/wiki/%D0%9C%D0%B5%D0%B4%D0%B8%D1%86%D0%B8%D0%BD%D0%B0> применяют при повышенной кислотности <http://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%BD%D0%BE%D1%81%D1%82%D1%8C> желудочного сока <http://ru.wikipedia.org/wiki/%D0%96%D0%B5%D0%BB%D1%83%D0%B4%D0%BE%D1%87%D0%BD%D1%8B%D0%B9_%D1%81%D0%BE%D0%BA>, так как она обусловливается избыточным содержанием соляной кислоты <http://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D1%8F%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>. Жжёную магнезию принимают также при случайном попадании в желудок кислот. |
|
|
|
Рис. 1
Карбонат магния
Карбонат магния, магний углекислый, MgCO3 - магниевая <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B8%D0%B9> соль <http://ru.wikipedia.org/wiki/%D0%A1%D0%BE%D0%BB%D1%8C> угольной кислоты <http://ru.wikipedia.org/wiki/%D0%A3%D0%B3%D0%BE%D0%BB%D1%8C%D0%BD%D0%B0%D1%8F_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D0%B0>.
минеральный соль кальций натрий
|
|
|
| 1.Свойства | Бесцветные кристаллы, плотность 3,037 г/см³. При 500 °C заметно, а при 650 °C полностью разлагается на MgO <http://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D0%BC%D0%B0%D0%B3%D0%BD%D0%B8%D1%8F> иCO2 <http://ru.wikipedia.org/wiki/%D0%9E%D0%BA%D1%81%D0%B8%D0%B4_%D1%83%D0%B3%D0%BB%D0%B5%D1%80%D0%BE%D0%B4%D0%B0(IV)>. Растворимость карбоната магния в воде незначительна (22 мг/л при 25 °C) и уменьшается с повышением температуры. При насыщении CO2 водной суспензии MgCO3 последний растворяется вследствие образования гидрокарбоната Мg(HCO3)2. Из водных растворов в отсутствие избытка CO2 выделяются основные карбонаты магния. С карбонатами ряда металлов карбонат магния образует двойные соли <http://ru.wikipedia.org/wiki/%D0%94%D0%B2%D0%BE%D0%B9%D0%BD%D1%8B%D0%B5_%D1%81%D0%BE%D0%BB%D0%B8>, к которым относится и природный минерал <http://ru.wikipedia.org/wiki/%D0%9C%D0%B8%D0%BD%D0%B5%D1%80%D0%B0%D0%BB>доломит MgCO3·CaCO3 <http://ru.wikipedia.org/wiki/%D0%94%D0%BE%D0%BB%D0%BE%D0%BC%D0%B8%D1%82>. |
| 2.Распрастранённость в природе | Карбонат магния широко распространён в природе в виде минерала магнезита <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B5%D0%B7%D0%B8%D1%82>. |
| 3.Применение | Основной карбонат магния 3MgCO3·Mg(OH)2·3H2O (так называемая белая магнезия) применяют как наполнитель в резиновых смесях, для изготовления теплоизоляционных материалов. В медицине и в качестве пищевой добавки <http://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%89%D0%B5%D0%B2%D0%B0%D1%8F_%D0%B4%D0%BE%D0%B1%D0%B0%D0%B2%D0%BA%D0%B0> E504 используется основной карбонат магния 4MgCO3·Mg(OH)2·nH2O Спортивная магнезия <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B5%D0%B7%D0%B8%D1%8F_(%D1%81%D0%BF%D0%BE%D1%80%D1%82)> 4MgCO3·Mg(OH)2·4H2O используется для подсушивания рук и, как следствие, увеличения надежности хвата. Карбонат магния необходим в производстве стекла, цемента, кирпича. |
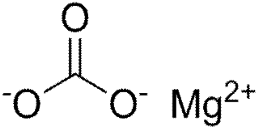
Рис. 2
Глюконат магния
Глюконовая кислота (глюконат магния) - альдоновая кислота <http://ru.wikipedia.org/wiki/%D0%90%D0%BB%D1%8C%D0%B4%D0%BE%D0%BD%D0%BE%D0%B2%D1%8B%D0%B5_%D0%BA%D0%B8%D1%81%D0%BB%D0%BE%D1%82%D1%8B> (C6H12O7), образующаяся при окислении альдегидной группы глюкозы <http://ru.wikipedia.org/wiki/%D0%93%D0%BB%D1%8E%D0%BA%D0%BE%D0%B7%D0%B0>. Образует соли - глюконаты (напр. Глюконат железа <http://ru.wikipedia.org/wiki/%D0%93%D0%BB%D1%8E%D0%BA%D0%BE%D0%BD%D0%B0%D1%82_%D0%B6%D0%B5%D0%BB%D0%B5%D0%B7%D0%B0>).
Фосфорилированная форма глюконовой кислоты является важным промежуточным продуктом углеводного обмена в живых клетках <http://ru.wikipedia.org/wiki/%D0%9A%D0%BB%D0%B5%D1%82%D0%BA%D0%B0>.
| 1.Применение | Глюконовая кислота применяется в фармацевтической промышленности как наполнитель для таблеток. В пищевой промышленности <http://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%89%D0%B5%D0%B2%D0%B0%D1%8F_%D0%BF%D1%80%D0%BE%D0%BC%D1%8B%D1%88%D0%BB%D0%B5%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C> зарегистрирована в качестве пищевой добавки <http://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%89%D0%B5%D0%B2%D0%B0%D1%8F_%D0%B4%D0%BE%D0%B1%D0%B0%D0%B2%D0%BA%D0%B0> E574, как регулятор кислотности <http://ru.wikipedia.org/wiki/PH> и разрыхлитель.Она активизирует обмен веществ, повышает работоспособность мышц и оказывает другие, положительные действия на организм. |
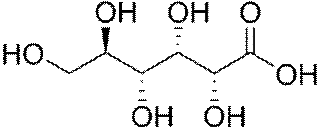
Рис. 3
Сульфат магния
Гептагидра́т сульфа́та ма́гния (Mg <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B8%D0%B9><http://ru.wikipedia.org/wiki/%D0%A1%D0%B5%D1%80%D0%B0><http://ru.wikipedia.org/wiki/%D0%9A%D0%B8%D1%81%D0%BB%D0%BE%D1%80%D0%BE%D0%B4>4·7H2O <http://ru.wikipedia.org/wiki/%D0%92%D0%BE%D0%B4%D0%B0>) - бесцветные кристаллы с ромбической решёткой (а = 1,187 нм, b = 1,200 нм, с = 0,688 нм, z = 4); плотностью 1,68 г/см3; твёрдость по Моосу 2-2,5; в воде легко растворяется. Другие названия - английская соль, горькая соль, магнезия <http://ru.wikipedia.org/wiki/%D0%9C%D0%B0%D0%B3%D0%BD%D0%B5%D0%B7%D0%B8%D1%8F> (медицинский жаргон), эпсом (англ. <http://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%BB%D0%B8%D0%B9%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> epsom) соль.
В природе английская соль содержится в воде многих горьких минеральных источников, из которых её раньше и добывали.
Впервые в 1695 году была выделена английским ботаником Неемия Грю <http://ru.wikipedia.org/wiki/%D0%93%D1%80%D1%8E,_%D0%9D%D0%B5%D0%B5%D0%BC%D0%B8%D1%8F> (англ. <http://ru.wikipedia.org/wiki/%D0%90%D0%BD%D0%B3%D0%BB%D0%B8%D0%B9%D1%81%D0%BA%D0%B8%D0%B9_%D1%8F%D0%B7%D1%8B%D0%BA> Nehemiah Grew) из воды минерального источника в Эпсоме <http://ru.wikipedia.org/wiki/%D0%AD%D0%BF%D1%81%D0%BE%D0%BC>, отсюда название минерала того же состава - эпсомит <http://ru.wikipedia.org/wiki/%D0%AD%D0%BF%D1%81%D0%BE%D0%BC%D0%B8%D1%82>.
| 1.Применение | В пищевой промышленности <http://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%89%D0%B5%D0%B2%D0%B0%D1%8F_%D0%BF%D1%80%D0%BE%D0%BC%D1%8B%D1%88%D0%BB%D0%B5%D0%BD%D0%BD%D0%BE%D1%81%D1%82%D1%8C> зарегистрирован в качестве пищевой добавки <http://ru.wikipedia.org/wiki/%D0%9F%D0%B8%D1%89%D0%B5%D0%B2%D0%B0%D1%8F_%D0%B4%D0%BE%D0%B1%D0%B0%D0%B2%D0%BA%D0%B0> E518. В медицине используется в качестве слабительного, а также как успокоительное, в качестве спазмолитика, как противосудорожный препарат. Выпускается для внутримышечного и внутривенного применения. См. также статью : Сульфат магния (лекарство) <http://ru.wikipedia.org/wiki/%D0%A1%D1%83%D0%BB%D1%8C%D1%84%D0%B0%D1%82_%D0%BC%D0%B0%D0%B3%D0%BD%D0%B8%D1%8F_(%D0%BB%D0%B5%D0%BA%D0%B0%D1%80%D1%81%D1%82%D0%B2%D0%BE)> Традиционно используется при принятии лечебных ванн. Очень концентрированный раствор (30 %) английской соли используется в флоатинг <http://ru.wikipedia.org/wiki/%D0%A4%D0%BB%D0%BE%D0%B0%D1%82%D0%B8%D0%BD%D0%B3>-терапии. Используется как удобрение для растений в качестве источника магния или серы. |
Список используемой литературы
1. Эйдензон М.А., Магний. - М., 1969.
2. Тихонов В.Н. Аналитическая химия магния. - М., 1973.
. Иванов А.И., Ляндрес М.Б., Прокофьев О.В. Производство магния. - М., 1979.
. С.И. Дракин. П.М. Чукуров, Дэвис А. Нутрицевтика. Питание для жизни, здоровья и долголетия. - М.: Саттва, Институт трансперсональной психологии, 2004. - С. 180-188. - ISBN.5-93509-021-X.
. Минделл Э. Справочник по витаминам и минеральным веществам. - М.: Медицина и питание, 2000. - С. 83-85.
. www.xumuk.ru <http://www.xumuk.ru>
. www.alhimik.ru <http://www.alhimik.ru>
. <http://chemistry.narod.ru/>
. Позин М.Е. Технология минеральных солей (удобрений, пестицидов, промышленных солей, окислов и кислот) (ч. 2).
Дата добавления: 2021-04-24; просмотров: 105; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
