Влияние катализатора на равновесие.
Тема 20 . Обратимые и необратимые химические реакции. Химическое равновесие
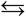 Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные, т. е. такие реакции могут протекать как в прямом, так и в обратном направлении (см. также раздел Задание 19). В уравнениях обратимых реакций вместо знака = используется знак .
Химические реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные, называются необратимыми. В обратимых реакциях образовавшиеся вещества взаимодействуют между собой, превращаясь в исходные, т. е. такие реакции могут протекать как в прямом, так и в обратном направлении (см. также раздел Задание 19). В уравнениях обратимых реакций вместо знака = используется знак .
Рассмотрим гомогенную обратимую реакцию
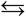 A + B C + D
A + B C + D
Реакция, протекающая слева направо, называется прямой, а противоположная – обратной.
В начальный момент времени t скорость прямой реакции максимальна, со временем она уменьшается, так как расходуются исходные вещества А и В. Напротив, скорость обратной реакции со временем возрастает, так как накапливаются вещества С и D (см. рис.).
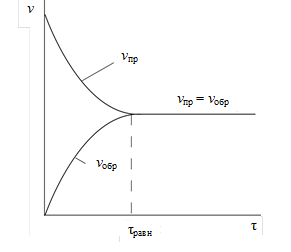
Рис. Состояние химического равновесия
Через некоторое время tравн скорости прямой и обратной реакции будут равны друг другу.
vпр = vобр.
Такое состояние называется динамическим химическим равновесием. В состоянии химического равновесия прямая и обратная реакции не прекращаются, однако химический состав системы сохраняется постоянным. Например, за некоторый промежуток времени по прямой реакции образуется х моль вещества С. За этот же промежуток времени в обратной реакции расходуется также х моль вещества С, аналогично и для веществ А, В и D данной системы. Следовательно, в состоянии равновесия концентрация каждого вещества остается во времени постоянной.
|
|
|
На состояние химического равновесия оказывают влияние концентрация, температура, а для газообразных веществ – давление. При изменении условий протекания реакции скорости прямой и обратной реакции изменяются неодинаково, химическое равновесие нарушается. В результате преимущественного протекания одной из реакций установится новое равновесие при новых значениях равновесных концентраций веществ. Подобный переход системы из одного состояния равновесия в другое называется смещением химического равновесия. Направление этого смещения определяется принципом Ле Шателье:
если на систему, находящуюся в состоянии равновесия, оказать какое-либо внешнее воздействие (изменить температуру, давление, концентрации веществ), то равновесие сместится в таком направлении, что оказанное воздействие будет ослаблено (преимущественно протекать будет та из противоположных реакций, которая уменьшает воздействие).
Например, если увеличить концентрацию исходных веществ, то протекать будет преимущественно прямая реакция, равновесие сместится «вправо» – в сторону образования продуктов реакции. Повышение температуры смещает равновесие в сторону эндотермической реакции, протекание которой сопровождается охлаждением системы. Повышение давления смещает равновесие в сторону уменьшения общего числа молей газообразных веществ, что приводит к понижению давления. Напомним, что, катализатор увеличивает скорость как прямой, так и обратной реакции и не смещает равновесие в системе.
|
|
|
Рассмотрим решение задач по теме «Химическое равновесие» на примере реакции
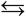 Н2С=СН2(г) С(тв) + 2Н2(г) + Q
Н2С=СН2(г) С(тв) + 2Н2(г) + Q
Влияние концентрации на равновесие. На равновесие влияют только концентрации газов и растворенных веществ. Если увеличить концентрацию исходного вещества (добавить газ этилен), то протекать будет преимущественно прямая реакция, равновесие сместится «вправо» – в сторону образования продуктов реакции. Если увеличить концентрацию продукта реакции – газа водорода, то протекать будет преимущественно обратная реакция, равновесие сместится влево – в сторону исходных веществ. При уменьшении концентраций – наоборот, рассмотрим кратко:
|
|
|
при концентрации исходных веществ равновесие смещается вправо, ®
при ¯Т концентрации исходных веществ равновесие смещается влево,
при Т концентрации продуктов реакции равновесие смещается влево,
при ¯Т концентрации продуктов реакции равновесие смещается вправо, ®
Влияние температуры на равновесие. Прямая реакция экзотермическая, идет с выделением тепла (+ Q), обратная, соответственно, эндотермическая (с поглощением тепла). При повышении температуры равновесие смещается влево, в сторону эндотермической реакции, протекание которой сопровождается охлаждением системы. При понижении температуры равновесие смещается вправо, в сторону экзотермической реакции, протекание которой компенсирует охлаждением. Кратко:
Прямая реакция экзотермическая (+ Q):
при Т равновесие смещается влево,
при ¯Т равновесие смещается вправо, ®
Прямая реакция эндотермическая (– Q):
при Т равновесие смещается вправо, ®
при ¯Т равновесие смещается влево,
Влияние давления на равновесие. Учитываем только газообразные вещества. Реакция
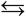 Н2С=СН2(г) С(тв) + 2Н2(г) + Q
Н2С=СН2(г) С(тв) + 2Н2(г) + Q
идет с увеличением числа моль газов: до реакции 1 моль газа этилена, после реакции 2 моля газа водорода.
|
|
|
Повышение давления смещает равновесие влево, в сторону обратной реакции, так как это приводит к понижению давления. Напротив, при уменьшении давления, равновесие смещается вправо, в сторону прямой реакции – это скомпенсирует уменьшение давления. Запишем кратко:
Прямая реакция идет с увеличением общего числа молей газов:
при Р равновесие смещается влево,
при ¯Р равновесие смещается вправо, ®
Прямая реакция идет с уменьшением общего числа молей газов:
при Р равновесие смещается влево,
при ¯Р равновесие смещается вправо, ®
Влияние катализатора на равновесие.
Напомним, что, катализатор увеличивает скорость как прямой, так и обратной реакции и не смещает равновесие в системе.
Дата добавления: 2021-04-24; просмотров: 181; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
