Определим количество и состав продуктов сгорания, а также
Министерство науки и высшего образования Российской Федерации
Федеральное государственное образовательное учреждение высшего профессионального образования
ИРКУТСКИЙ НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
Кафедра электропривода и электрического транспорта
РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА №1
Вариант № 67
Выполнил: студент группы ЭСБ-17-1
Фамилия И.О.
Проверил: доцент каф. ЭЭТ, к.т.н.
Степанова Т.Б.
Иркутск 2019
Цель работы: научиться определять высшую и низшую теплоту сгорания сухого беззольного топлива разными способами, а также рассчитать его жаропроизводительность и состав продуктов сгорания
Задание на работу:
а) По данным элементарного состава твёрдого сухого беззольного топлива определить теплоту сгорания (высшую и низшую) разными способами: расчётом по реакциям горения с использованием стандартных теплот образования веществ и по эмпирической формуле Д.И. Менделеева. Результаты сравнить.
Пересчитать состав топлива и найденные значения 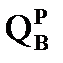 и
и 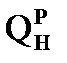 на сухую и рабочие массы топлива. Произвести перерасчёт состава и теплот сгорания топлива на другое содержание влаги.
на сухую и рабочие массы топлива. Произвести перерасчёт состава и теплот сгорания топлива на другое содержание влаги.
б) По данным элементарного состава твёрдого топлива (рабочее состояние) рассчитать показатели его сжигания: теоретический расход кислорода и воздуха, количество и состав продуктов сгорания и жаропроизводительность при 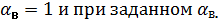
|
|
|
Исходные данные варианта 67:
| Состав угля | α в | ||||||||
| Месторождение | Марка, класс | Сdaf | Hdaf | 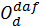
| Ndaf | 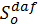
| Wr | Ad | |
| Донецкий бассейн, Антрацит | А, штыб | 92,0 | 1,8 | 4,6 | 0,8 | 0,8 | 9,0 | 35,0 | 1,23 |
Ход работы:
Произведём перерасчёт состава топлива на рабочую массу топлива.
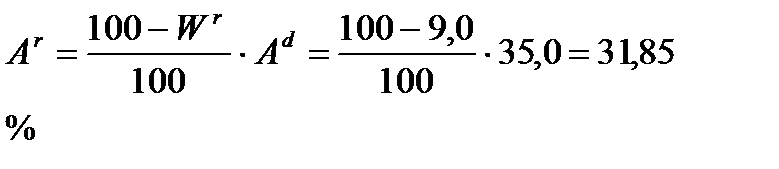 ;
;
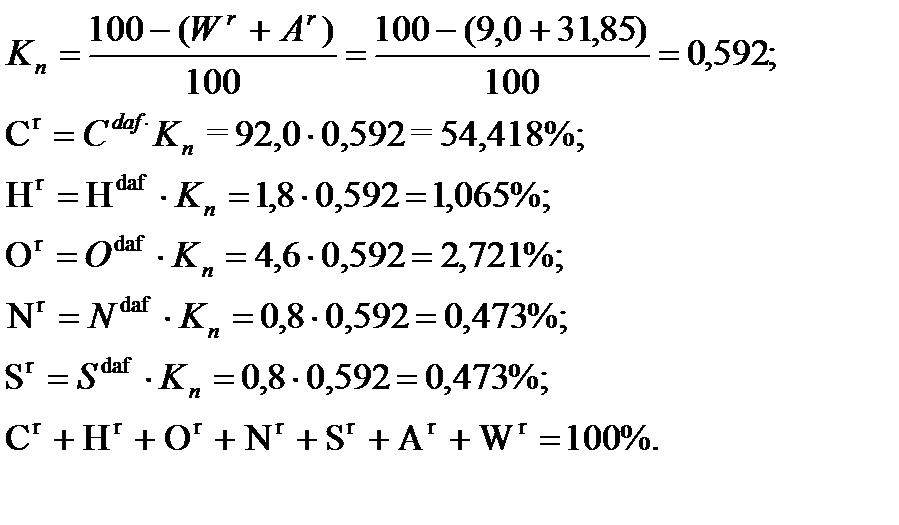
2) Рассчитаем 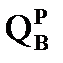 и
и 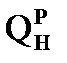 теплоты сгорания методом расчёта по реакциям горения с использованием стандартных теплот образования веществ.
теплоты сгорания методом расчёта по реакциям горения с использованием стандартных теплот образования веществ.
Реакции окисления компонентов топлива:
S+O2= SO2 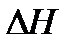 (SO2)г=-296,90 кДж/моль=-296,9/32=-9,28МДж/кг;
(SO2)г=-296,90 кДж/моль=-296,9/32=-9,28МДж/кг;
С+O2= СO2 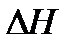 (СO2)г=-393,51кДж/моль=-393,51/12=-32,79МДж/кг;
(СO2)г=-393,51кДж/моль=-393,51/12=-32,79МДж/кг;
Н2+0,5O2= Н2О.
Для определения 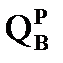 используем Н2О(ж) , а для
используем Н2О(ж) , а для 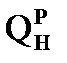 - Н2О(г).
- Н2О(г).
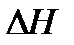 (Н2О(г) )=-241,81кДж/моль =-241,81/2=-120,9МДж/кг;
(Н2О(г) )=-241,81кДж/моль =-241,81/2=-120,9МДж/кг;
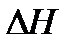 (Н2О(ж) )=-285,83кДж/моль=-285,83/2=-142,9МДж/кг.
(Н2О(ж) )=-285,83кДж/моль=-285,83/2=-142,9МДж/кг.
Найдем теплоты сгорания по формулам:

3) Рассчитаем 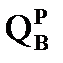 и
и 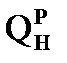 по эмпирической формуле Менделеева.
по эмпирической формуле Менделеева.
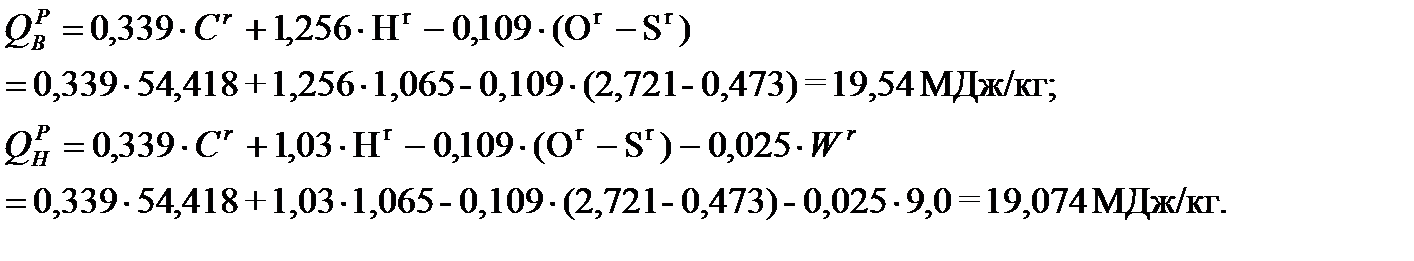
Сравним результаты двух методов:
| По реакциям горения топлива | По формуле Менделеева | |
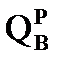
| 19,409 | 19,54 |
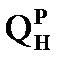
| 19,175 | 19,074 |
По данным элементарного состава топлива рассчитаем теоретический расход кислорода и воздуха при сжигании.
При сжигании 1 кг S расходуется 1 кг O2:
|
|
|
S+O2=SO2;
32+32=64;
32/32=1.
При сжигании 1 кг C расходуется 2,67 кг O2:
C+O2=CO2;
12+32=44;
32/12=2,67.
При сжигании 1 кг H2 расходуется 8 кг O2:
H2+ 1/2O2=H2O;
2+32/2=18;
16/2=8.
Теоретическая масса O2:
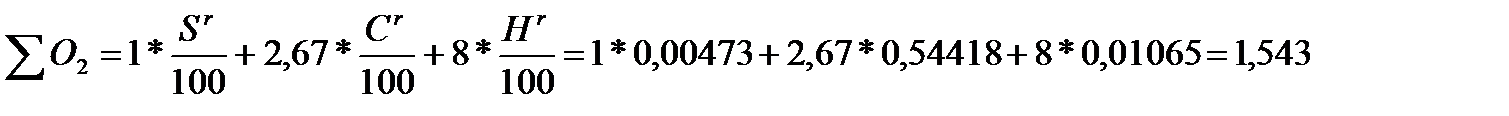 кг на 1 кг топлива.
кг на 1 кг топлива.
Теоретическая масса N2:
∑N2=77/23*∑O2=77/23∗1,543=5,165 кг на 1кг топлива.
Таким образом, воздуха требуется
∑N2+∑O2=5,165+1,543=6,708 кг на 1 кг топлива.
Определим количество и состав продуктов сгорания.
На 1 кг серы приходится 2 кг SO2 :
S+O2 = SO2;
32+32=64;
64/32=2.
На 1 кг углерода приходится 3,67 кг CO2:
C+O2=CO2;
12+32=44;
44/12=3,67.
На 1 кг водорода приходится 9 кг Н2O:
H2+ 1/2O2=H2O;
2+32/2=18;
18/2=9.
Рассчитаем массу продуктов сгорания:
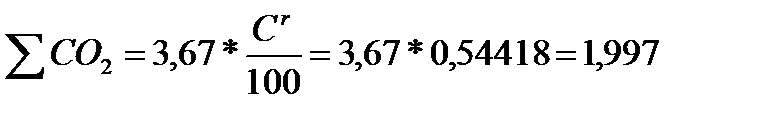 кг;
кг;
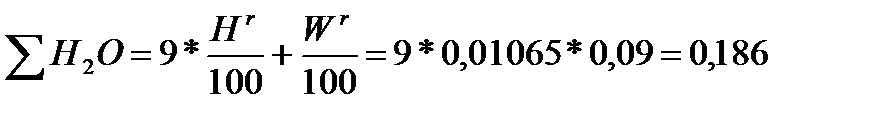 кг;
кг;
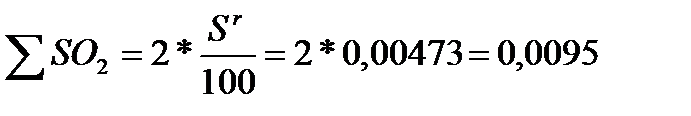 кг;
кг;
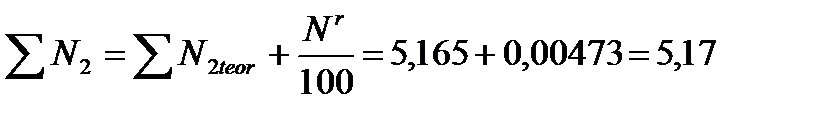 кг;
кг;
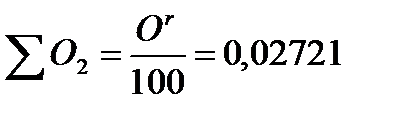 кг.
кг.
Определим количество и состав продуктов сгорания, а также жаропроизводительность при αв=1.
| Компоненты | Масса, кг | % |
| СО2 | 1,997 | 25,91 |
| Н2О | 0,186 | 2,411 |
| SO2 | 0,0095 | 0,123 |
| N2 | 5,17 | 67,072 |
| А (зола) | 0,3185 | 4,132 |
| O2 из угля | 0,02721 | 0,353 |
| Итого | 7,708 | 100 |
Рассчитаем жаропроизводительность.
Средняя удельная теплоемкость газов при 2200 о С, ккал/нм3*град по Юсти.
| СО2 | 0,586 |
| Н2О | 0,473 |
| SO2 | 0,573 |
| N2 | 0,359 |
| O2 | 0,379 |

|
|
|
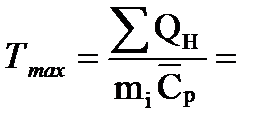
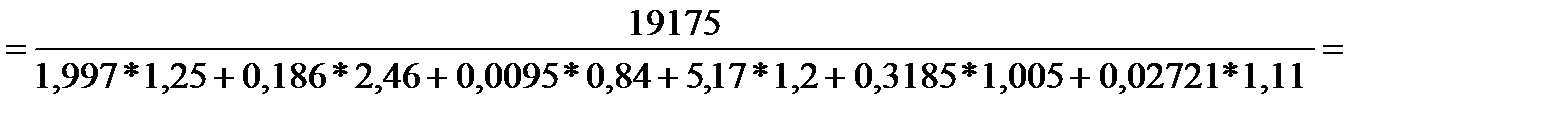
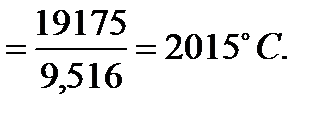
Определим количество и состав продуктов сгорания, а также
жаропроизводительность при αв=1,23; m -теоретическая масса O 2
В этом случае будет присутствовать кислород, избыток которого равен:
mтеорет*(αизб-αтеорет)=1,543*(1,23-1,00)+ О2топ = 0,35489+ 0,02721 = 0,382 кг.
Азота при этом будет: 5,17*1,23 + N2топ = 6,3591 + 0,00473 = 6,364 кг.
СО2, Н2О и SO2 не изменится.
| Компоненты | масса, кг | % |
| СО2 | 1,997 | 21,575 |
| Н2О | 0,186 | 2,007 |
| SO2 | 0,0095 | 0,102 |
| N2 | 6,364 | 68,747 |
| О2 | 0,382 | 4,127 |
| А | 0,3185 | 3,441 |
| Итого | 9,257 | 100 |
Рассчитаем жаропроизводительность при αв=1,23: 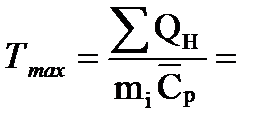
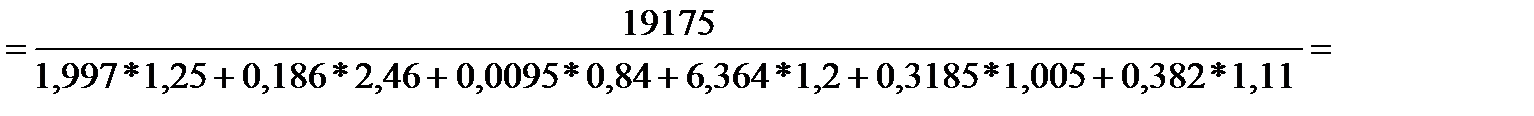
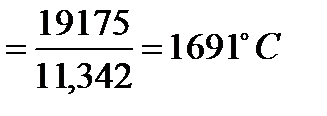 .
.
Вывод: В данной работе были рассчитаны высшая и низшая теплоты сгорания твёрдого сухого беззольного топлива разными способами: расчётом по реакциям горения с использованием стандартных теплот образования веществ и по эмпирической формуле Д.И. Менделеева. Также был рассчитан теоретический расход кислорода и воздуха, жаропроизводительность топлива и состав продуктов сгорания при избытке и без избытка кислорода.
Дата добавления: 2021-04-24; просмотров: 49; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
