Эквивалент. Молярная масса эквивалента
Основные законы химии
В 1905 г. А. Эйнштейн установил, что между массой и энергией существует взаимосвязь
Е = mc2,
где Е – энергия тела, Дж; m – масса, кг; c – скорость света (с = =2,997925×108м/с). Однако не совсем правильно было бы считать, что масса непосредственно превращается в энергию.
Для химических процессов изменением массы можно пренебречь. Существуют два важных для химии следствия, которые исторически получили названия закона сохранения массы и закона сохранения энергии. Однако, строго говоря, выполняются эти законы приближенно. Для химических процессов они формулируются следующим образом.
Закон сохранения массы. Массы веществ, вступающих в реакцию, равны массе веществ, образующихся в результате реакции.
Благодаря опытам М. В. Ломоносова в 1748 – 1756 гг. химия перешла от науки качественной к количественной. В производстве на этой основе ведутся многие расчеты материальных балансов в химической технологии.
Закон сохранения энергии. При любых взаимодействиях, имеющих место в изолированной системе, энергия этой системы остается постоянной и возможны лишь переходы из одного вида энергии в другой.
Практически это означает, что если в ходе реакции энергия выделяется или поглощается, то запас энергии в продуктах реакции по сравнению с запасом ее в исходных веществах будет меньше или больше соответственно. Запас энергии вещества в химии принято называть теплосодержанием (энтальпией), а выделяющуюся или поглощающуюся энергию – теплом. Благодаря закону сохранения существует целая наука, которая вместе с другими явлениями изучает тепловые эффекты химических реакций, называется химической термодинамикой. В производстве на основе данного закона составляются и рассчитываются тепловые балансы.
|
|
|
Закон постоянства состава. Любое химически индивидуальное соединение имеет один и тот же количественный состав независимо от способа его получения (Ж. Пруст, 1801 – 1808 гг.).
Это значит, что соотношения между массами элементов, входящих в состав соединения, постоянны. Закон всегда выполнятся для газообразных и жидких веществ. Например, для аммиака NH3 независимо от способа его получения (прямой синтез из простых веществ, разложение аммонийных солей) состав его молекулы всегда постоянен – на один атом азота приходится три атома водорода. Для вещества, находящегося в твердом состоянии, строго говоря, закон не справедлив. Это связано с тем, что в кристаллической структуре любого твердого вещества всегда имеются пустоты, не заполненные атомами, примесные атомы других элементов и другие отклонения от идеальной структуры. На все это, наряду с температурой, давлением, концентрациями веществ, влияет очень большое число других факторов, связанных уже с технологиями получения, выделения и очистки вещества. Так, в диоксиде титана TiO2 на единицу массы титана может приходиться от 0,65 до 0,67 единиц массы кислорода, что соответствует формуле TiO1,9-2,0. Такая формула отражает границы состава вещества. Пределы, в которых может изменяться их состав, установлены для многих соединений. При изменении изотопного состава элемента меняется и массовый состав соединения. Например, обычная вода содержит 11% (мас.) водорода, а тяжелая – почти в два раза больше (20%).
|
|
|
Закон сохранения отношений. Если два элемента образуют друг с другом несколько химических соединений, то весовые количества одного элемента, приходящиеся в этих соединениях на одну и ту же массу другого, относятся между собой как небольшие целые числа (Дж. Дальтон, 1808 г.)
Например, азот образует оксиды N2O, NO, N2O3, NO2 и N2O5. Рассчитаем массовую долю кислорода, которая приходится на одну массовую часть азота (ω(O)/ω(N)) в каждом соединении (табл. 5.1).
Таблица 5.1
Массовая доля кислорода, азота и их соотношении для оксидов азота
| Состав | Соединение, формула
| ||||||
| N2O | NO | N2O3 | NO2 | N2O5 | |||
| Массовая доля ω(N), % | 63,63 | 46,66 | 36,84 | 30,43 | 25,92 | ||
| Массовая доля ω(O), % | 36,37 | 53,34 | 63,16 | 69,57 | 74,08 | ||
| Отношение ω(O)/ω(N) | 0,57 1 | 1,14 2 | 1,71 3 | 2,28 4 | 2,85 5 | ||
Как видно из таблицы, на одну массовую часть азота приходится от1 до 5 частей кислорода, т. е. ω(O)/ω(N) = 1 : 2 : 3 : 4 : 5.
Закон кратных отношений, как и закон постоянства состава, не является всеобщим и, строго говоря, также не соблюдается для веществ в твердом состоянии. Например, титан образует с кислородом несколько оксидов переменного состава, важнейшими из которых являются TiO1,46-1,56 и TiO1,9-2,0. Ясно, что в этом случае закон кратных отношений не соблюдается.
Закон объемных соотношений. При одинаковых условиях объемы вступающих в реакцию газов относятся друг к другу и к объемам образующихся газообразных продуктов реакции как небольшие целые числа (Ж. Гей-Люссак, 1805 г.).
Например, при взаимодействии 2 объемов водорода и 1 объема кислорода образуются 2 объема водяного пара. Эти числа совпадают со стехиометрическими коэффициентами в уравнении реакции. На этом законе основаны методы газового анализа, применяемого в промышленности.
|
|
|
Закон Авогадро. В равных объемах любых газов, взятых при одной и той же температуре и при одинаковом давлении, содержится одно и то же число молекул (А. Авогадро, 1811 г.).
Закон Авогадро позволил сделать выводы о числе атомов в молекулах газов, например таких, как водород, хлор, кислород, азот. Закон применим и для заряженных частиц в газовой фазе (электронов, ионов), если их концентрация невелика, а воздействием магнитных и электрических полей можно пренебречь.
Определение молярных масс веществ, находящихся в газообразном состоянии. Для определения относительной молекулярной массы вещества обычно находят численно равную ей молярную массу вещества (в г/моль). Если вещество находится в газообразном состоянии, то его молярная масса может быть найдена с помощью закона Авогадро. По этому закону равные объемы газов, взятых при одинаковой температуре и одинаковом давлении, содержит равное число молекул. Отсюда следует, что массы двух газов, взятых в одинаковых объемах, должны относиться друг к другу, как их молекулярные массы:
m1/m2 = M1/M2,
где m1 и m2 – массы; M1 и M2 – молярные массы первого и второго газов.
Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Например, при нормальных условиях масса диоксида углерода в объеме 1 л равна 1,98 г, а масса водорода в том же объеме и при тех же условиях – 0,09 г, откуда плотность оксида углерода по водороду составит 1,98 : 0,09 = 22.
Обозначим относительную плотность газа m1/m2 буквой D. Тогда
D = M1/M2, откуда М1 = D×M2.
Молярная масса газа равна его плотности по отношению к другому газу, умноженной на молярную массу второго газа.
Часто плотности различных газов определяют по отношению к водороду как самому легкому из всех газов. Поскольку молярная масса водорода с точностью до сотых равна 2 г/моль, то в этом случае уравнение для расчета молярных масс принимает вид
М1 = 2×D.
Вычисляя, например, по этому уравнению молярную массу диоксида углерода, плотность которого по водороду, как указано выше, равна 22, находим
М1 = 2×22 = 44 г/моль.
Нередко также молярную массу газа вычисляют исходя из его плотности по воздуху. Хотя воздух представляет собой смесь нескольких газов, все же можно говорить о средней молярной массе воздуха, определенной из плотности воздуха по водороду. Найденная таким путем молярная масса воздуха равна 29 г/моль. Обозначив плотность исследуемого газа по воздуху через Dвозд, получим следующее уравнение для вычисления молярных масс:
М1 = 29×Dвозд.
Молярную массу вещества (следовательно, и его относительную молекулярную массу) можно определить и другим способом, используя понятие о молярном объеме вещества в газообразном состоянии. Для этого находят объем, занимаемый при нормальных условиях определенной массой данного вещества в газообразном состоянии, а затем вычисляют массу 22,4 л этого вещества при тех же условиях. Полученная величина и выражает молярную массу вещества.
Парциальное давление газа. При определении молекулярных масс газов очень часто приходится менять объем газа, собранного над водой и потому насыщенного водяным паром. Определяя в этом случае давление газа, необходимо вводить поправку на парциальное давление водяного пара. При обычных условиях различные газы смешиваются друг с другом в любых соотношениях. При этом каждый газ, входящий в состав смеси, характеризуется своим парциальным давлением. Оно представляет собой давление (рi), которое производило бы имеющееся в смеси количество данного газа, если бы оно одно занимало при той же температуре весь объем, занимаемый смесью.
Закон парциальных давлений (Дальтон). Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь.
Эквивалент. Молярная масса эквивалента
Простых и сложных веществ
Объёмные и массовые соотношения простых и сложных веществ в химических реакциях изучает раздел химии стехиометрия.
Количественные соотношения вступающих в реакцию исходных веществ и образующихся продуктов указываются в виде коэффициентов (стехиометрических чисел) перед химическими формулами веществ в управлении реакции. Например, запишем с соответствующими стехиометрическими коэффициентами реакции:
2Н2 + О2 = 2Н2О (6.1)
3Н2 + WO3 = 3H2O + W (6.2)
NaOH + H2SO4 = NaHSO4 + H2O (6.3)
2NaOH + H2SO4 = Na2SO4 + 2H2O (6.4)
Во многих случаях избежать громоздких уравнений в количественных расчетах можно, если использовать такую характеристику как эквивалент или молярная масса эквивалента. Чтобы уяснить понятие эквивалента, запишем реакции (6.1- 6.4) в виде
H2 + 1/2О2 = H2O (6.1*)
(Н + 1/2O = 1/2H2O)
H2 + 1/3WO3 = H2O + 1/3W (6.2*)
(Н + 1/6WO3 = 1/2H2O + 1/6W)
NaOH + 1/2H2SO4 = NaHSO4 + H2O (6.3*)
(OH- + H+ = H2O)
NaOH + 1/2H2SO4 = 1/2Na2SO4 + H2O (6.4*)
(OH- + H+ = H2O)
В реакциях (6.1*) - (6.4*), присоединения, замещения и обмена за единицу эквивалента удобно принять атом (ион) водорода.
Для реакции общего вида
ν1Х1 + ν2 Х2 = ν3Х3 + ν4 Х4 (6.5)
массы реагирующих веществ Х1 и Х2 можно определить из соотношения их количеств веществ n(X1) и n(X2) и стехиометрических коэффициентов ν1 и ν2
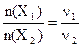 . (6.6)
. (6.6)
Выражая количество вещества X через массу m(X) и их молекулярную массу М(X) соотношение (6.6) можно представить в виде
 . (6.7)
. (6.7)
Отсюда можно получить расчетную формулу для определения массы вещества Х1 , прореагировавшей с массой вещества Х2, или наоборот:
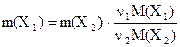 ; (6.8)
; (6.8)
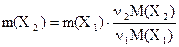 . (6.9)
. (6.9)
Однако в химической практике, особенно при количественных расчетах с использованием концентраций реагирующих веществ, более удобен другой вариант расчета, базирующийся на принципе химической эквивалентности веществ. Например, если ту же реакцию (6.5) привести к виду
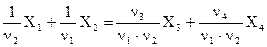 , (6.10)
, (6.10)
то из этого уравнения реакции видно, что в ней 1/ν2 моль вещества Х1 реагирует с 1/ν1 моль вещества Х2 с образованием 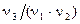 моль вещества Х3 и
моль вещества Х3 и 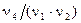 моль вещества Х4, если эта реакция идет до конца. Другими словами,
моль вещества Х4, если эта реакция идет до конца. Другими словами, 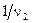 доля частицы молекулы (моль) вещества Х1 химически эквивалентна
доля частицы молекулы (моль) вещества Х1 химически эквивалентна 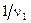 ,
, 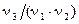 и
и 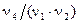 долям частиц (моль) веществ Х2 , Х3 , Х4 .
долям частиц (моль) веществ Х2 , Х3 , Х4 .
Коэффициенты 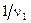 ,
, 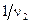 ,
, 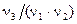 и
и  , выражающие долю химически эквивалентных частиц (или их количеств), называются факторами эквивалентности, а сами условные частицы
, выражающие долю химически эквивалентных частиц (или их количеств), называются факторами эквивалентности, а сами условные частицы 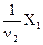 ,
, 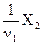 ,
, 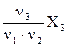 и
и 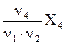 - эквивалентами этих веществ. Условными их называют потому, что в химических реакциях участвуют реальные частицы (молекулы, атомы, ионы, электроны), а не их доли, но обозначение этого вида указывает долю эквивалентного количества вещества (долю одного моль вещества), и поэтому является совершенно правомерным.
- эквивалентами этих веществ. Условными их называют потому, что в химических реакциях участвуют реальные частицы (молекулы, атомы, ионы, электроны), а не их доли, но обозначение этого вида указывает долю эквивалентного количества вещества (долю одного моль вещества), и поэтому является совершенно правомерным.
Так как обычно при использовании принципа химической эквивалентности факторы эквивалентности в реакции получаются меньше или равными единице, то эквивалент Э вещества Х обозначают формулой 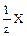 (например,
(например, 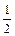 H2SO4,
H2SO4, 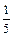 KMnO4):
KMnO4):
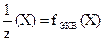 – фактор эквивалентности; z(Х) – число эквивалентности.
– фактор эквивалентности; z(Х) – число эквивалентности.
Дата добавления: 2021-04-24; просмотров: 90; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
