Термодинамические возможности кислородной деполяризации.
Протекание процесса коррозии металла с кислородной деполяризацией согласно уравнения возможно при условии:
V(Me)обр < (VO2)обр
где (VO2)обр - обратимый потенциал кислородного электрода,
равный: (VO2)0обр + (RT/4F)2,303 lg(PO2/OH)
Из последнего уравнения следует, что ( ) зависит от рН среды (а ) и парциального давления кислорода.
Значение обратимых потенциалов кислородного электрода при
различных рН среды и Р
| P (атм) | V ,B, при рН среды | ||
| рН=0 | рН=7 | рН=14 | |
| 0,21 | +1,218 | +0,805 | +0,381 |
| 1 | +1,229 | +0,815 | +0,400 |
Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой Р=0,21 атм. Следовательно, при определении термодинамической возможности протекания коррозионного процесса с кислородной деполяризацией следует производить учитывая реальное парциальное давление кислорода в воздухе (см. табл.). Т.к. значения (V ) очень положительны, то условия соблюдаются в очень многих случаях. В следующей таблице приведены значения ЭДС и изменения изобарно-изотермических потенциалов коррозионных процессов с кислородной деполяризацией:
Me + n/2HO + n/4O = Me(OH)
| Металлы | Твердый продукт ( E )обр = ( VO 2 )-( VMe )обр | 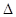 G G
| |||
| коррозии | ( VO2 ) -(VMe) обр | ||||
|
Mn MnO +2,488 -25,6 Zn Zn(OH) +1,636 -37,7 Fe Fe(OH) +1,268 -29,3 Fe Fe(OH) +1,164 -26,3 Cu CuO +0,648 -17,3 Cu Cu(OH) +0,615 -14,2 Ag AgO +0,047 -1,1
| |||||
Сопоставляя эти данные с данными по водороду
 |  |  |

Р (атм) рН=0 рН=7 рН=14

5*10 +0,186 -0,288 -0,642
1 0,000 -0,414 -0,828
позволяет указать на, то что кислородная деполяризация более термодинамически возможна чем водородная деполяризация.
Изучение восстановления кислорода на неблагородных металлах (а именно они представляют наибольший интерес с точки зрения коррозии) затрудняется тем, что при катодной поляризации электрода металл может иметь потенциал более положительный, чем равновесный и, следовательно, подвергается окислению (ионизации).
|
|
|
При катодной поляризации в определенном интервале потенциалов будут происходить одновременно два процесса восстановление кислорода и окисление металла. Окисление металла прекратится когда потенциал металла будет равен или станет отрицательнее равновесного потенциала металла. Эти обстоятельства затрудняют изучение процессов кислородной деполяризации.
Схема кислородной деполяризации.
Каждый процесс с кислородной деполяризацией включает следующие последовательные стадии:
1) Растворение кислорода воздуха в растворе электролита.
2) Транспортировка растворенного кислорода в растворе электролита (за счет диффузии или перемешивания) к слою Прандтля.
3) Перенос кислорода в части слоя Прандтля П(  )в результате движения электролита.
)в результате движения электролита.
4) Перенос кислорода в диффузионном слое электролита толщиной или в пленке продуктов коррозии металла к катодным участкам поверхности.
5) Ионизация кислорода:
а) в нейтральных и щелочных растворах
O2 + 4e + 2 H2O = 4OH- (водн)
б) в кислых растворах
O2 + 4e + 4 H+(водн) = 2Н2O
6) Диффузионный или конвектный перенос ионов ОН от катодных участков поверхности корродирующего металла в глубь электролита.
|
|
|
В реальных условиях коррозии металла наиболее затрудненными стадиями процесса являются:
а) реакция ионизации кислорода на катоде. Возникающую при этом поляризацию называют перенапряжением кислорода. Говорят, что процесс идет с кинетическим контролем.
б) Диффузия кислорода к катоду, либо перенапряжение диффузии. В этом случае, говорят, что процесс идет с диффузионным контролем.
Возможны случаи когда обе стадии - ионизация кислорода и диффузия кислорода оказывают влияние на процесс. Тогда говорят, о кинетически-диффузионном контроле.
Дата добавления: 2021-04-24; просмотров: 55; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!


 Mg Mg(OH) +3,104 -71,6
Mg Mg(OH) +3,104 -71,6