СОЛЯНАЯ КИСЛОТА И ХЛОРОВОДОРОД
АМФОТЕРНОСТЬ. СОЛИ.
ОКСИДЫ
Оксиды – это сложные вещества, образованные двумя элементами, одним из которых является кислород (O).
Оксиды могут находиться в трех агрегатных состояниях,
а именно: в твердом, жидком и газообразном.
Температура плавления зависит от их строения.
CuO, Fe  O
O 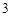
 - твердые вещества, немолекулярного строения.
- твердые вещества, немолекулярного строения.
Оксиды:
MgO – магния
NiO – никеля
SiO  - кремния
- кремния
Fe  O
O 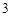
 - железа
- железа
ClO  - хлора
- хлора
CO  - углерода
- углерода
NO  - азота
- азота
ВОДА
Массовая доля воды в организме человека составляет 65%.
Взрослый человек потребляет ежедневно почти 2 л воды.
Плотность воды наибольшая при 4  градусов – 1 г/см в кубе.
градусов – 1 г/см в кубе.
При нуле – лёд, а при 100 – водяной пар.
Вода реагирует:
А) с активными металлами, образуя щелочи и водород(H).
2Na + 2H  O = 2NaOH + H
O = 2NaOH + H 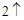
Из этой реакции видим, что водород выделился и образовался
гидроксид натрия NaOH – щелочь.
Если при добавлении фиолетового лакмуса окраска становит-
ся синей – это признак того, что в растворе есть щелочь.
2K + H  O = 2KOH + H
O = 2KOH + H 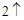
Ca + 2H  O = Ca(OH)
O = Ca(OH)  + H
+ H 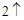
Б) с оксидами активных металлов, образуя растворимые
основания – щелочи.
CaO + H  O = Ca(OH)
O = Ca(OH) 
Оксиды которым соответствуют основания (независимо от того,
реагируют они с водой или нет) называются основными.
Б) еще примеры:
Na  O + H
O + H  O = 2NaOH
O = 2NaOH
BaO + HO = Ba(OH) 
В) со многими оксидами неметаллов, образуя кислоты.
P  O
O 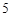 + H
+ H  O = 2HPO
O = 2HPO 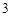
а с горячей водой:
P  O
O 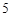 + 3H
+ 3H 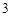 PO
PO 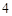 = 2H
= 2H 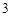 PO
PO 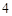
|
|
|
CO  + H
+ H  O = H
O = H  CO
CO 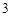
SO 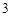 + H
+ H  O = H
O = H  SO
SO 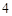
Г) вода разлагается под действие высокой температуры или
электрического тока.
2H  O = 2H
O = 2H 
 + O
+ O 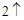
Оксиды которым соответствуют кислоты (независимо от того,
реагируют они с водой или нет) называются кислотными.
КИСЛОТЫ
В формулах кислот на первом месте всегда стоит водород, а
дальше – кислотный остаток. Во время химических реакций он переходит из одного соединения в другое, не изменяясь.
Пример: SO 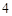 - кислотный остаток.
- кислотный остаток.
Его валентность = 2, поскольку в серной кислоте он соединен с
двумя атомами водорода, которые способны замещаться атомами цинка (к примеру).
Вывод: валентность кислотных остатков определяется числом атомов водорода, способных замещаться атомами металла.
Основность кислот – это количество атомов водорода, способных замещаться атомами металла с образованием соли.
Многие кислородосодержащие кислоты можно получить путем
взаимодействия кислотных оксидов с водой:
SO 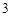 + H
+ H  O = H
O = H  SO
SO 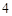
N  O
O 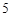 + H
+ H  O = 2HNO
O = 2HNO 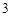
ХИМИЧЕСКИЕ СВОЙСТВА КИСЛОТ
1ое свойство: кислоты действуют на индикаторы.
Вещества, изменяющие свою окраску под действием кислот (или щелочей, называются индикаторами.
Индикаторы: Лакмус, метилоранж, фенолфталеин.
|
|
|
2ое свойство: кислоты реагируют с металлами.
Mg + 2HCl = MgCl  + H
+ H 

Zn + 2HCl = ZnCl  + H
+ H 

Cu + HCl = реакция не происходит!
3е свойство: кислоты реагируют с основными оксидами.
CuO + 2HCl = CuCl  + H
+ H  O - - - - Cu (II)
O - - - - Cu (II)
Реакции обмена: это реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями.
Примечание: Во время взаимодействия азотной кислоты с металлами вместо водорода выделяются другие газы.
СОЛЯНАЯ КИСЛОТА И ХЛОРОВОДОРОД
Получают хлороводород таким образом:
1) слабое нагревание
NaCl + H  SO
SO 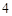 = NaHSO
= NaHSO 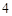 + HCl
+ HCl 
2) сильное нагревание
2NaCl + H  SO
SO 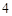 = Na
= Na  SO
SO 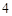 + 2HCl
+ 2HCl 
HCl – бесцветный газ с резким запахом, немного тяжелее воздуха, во влажном воздухе дымит. При 0 градусов в одном объеме воды растворяется 500 объемов хлороводорода.
Химические свойства соляной кислоты:
1ое свойство: изменяет окраску индикаторов: лакмус в соляной кислоте краснеет, метилоранж – розовеет, фенолфталеин остается бесцветным.
2ое свойство: взаимодействует с металлами:
Mg + 2HCl = MgCl  + H
+ H 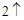
3е свойство: взаимодействует с основными оксиды:
Fe  O
O 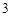 + 6HCl = 2FeCl
+ 6HCl = 2FeCl 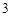 + 3H
+ 3H  O
O
Примечание : HCl + AgNO 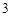 = AgCl
= AgCl 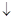 +HNO
+HNO 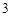
ОСНОВАНИЯ
CaO + H  O = Ca(OH)
O = Ca(OH) 
|
|
|
В этой реакции образовался гидрат оксида кальция, или гидроксид кальция.
Основания состоят из металла и одновалентных гидроксильных
групп (OH), число которых соответсвует валентности металла.
Основания:
NaOH – гидроксид натрия
Mg(OH)  - гидроксид магния
- гидроксид магния
Ba(OH)  - гидроксид бария.
- гидроксид бария.
Fe(OH)  - гидроксид железа (II)
- гидроксид железа (II)
Fe(OH) 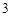 - гидроксид железа (III)
- гидроксид железа (III)
Все основания имеют немолекулярное строение.
По растворимости в воде разделяются на:
А) растворимые (щелочи)
Пример: гидроксид натрия NaOH, гидроксид калия KOH, гидроксид бария Ba(OH)  и т.п.
и т.п.
Б) нерастворимые
Пример: гидроксид меди (II) Cu(OH)  , гидроксид железа (III)
, гидроксид железа (III)
Fe(OH) 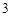 и т.п.
и т.п.
Растворимые основания можно получить при взаимодействии активных металлов с водой и оксидов активных металлов с водой, которые называются основными оксидами:
2Na + 2H  O = 2NaOH + H
O = 2NaOH + H 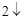
BaO + H  0 = Ba(OH)
0 = Ba(OH) 
Вывод: все основания реагируют с кислотами, образуя соль и воду.
Например:
NaOH + HNO 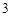 = NaNO
= NaNO 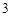 + H
+ H  O
O
Cu(OH)  + 2HCl = CuCl
+ 2HCl = CuCl  + 2H
+ 2H  O
O
Дата добавления: 2021-04-24; просмотров: 46; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
