Перечень цифровых образовательных ресурсов и Web-сайтов Интернет
Группа№23, химия,урок№93
Тема программы: Стоение вещества.
Тема урока: Механизмы образования ковалентной связи: обменный и донорно-акцепторный.
Цель урока: Рассмотреть механизмы образования ковалентной связи: обменный и донорно-акцепторный.
План.
1. Механизм возникновения ковалентной связи на примере образования молекулы водорода.
Обменный механизм.
Донорно-акцепторный механизм.
Опорный конспект
1.Известно, что неметаллы взаимодействуют друг с другом. Рассмотрим механизм возникновения ковалентной связи на примере образования молекулы водорода:
Н+Н=Н2 DH=-436кДж/моль
Представим себе, что мы имеем два отдельных изолированных атома водорода. Ядро каждого из свободных атомов водорода окружено сферическим симметричным электронным облаком, образуемым 1s-электроном (см. рис. 5). При сближении атомов до
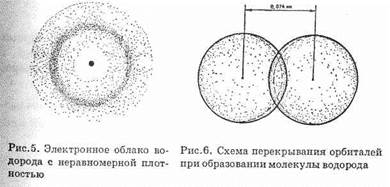
определенного расстояния происходит частичное перекрывание электронных оболочек (орбиталей) (рис. 6).
В результате между центрами обоих ядер возникает молекулярное двухэлектронное облако, обладающее максимальной электронной плотностью в пространстве между ядрами; увеличение плотности отрицательного заряд» благоприятствует сильному возрастанию сил притяжения между ядрами и молекулярным облаком.
Итак, ковалентная связь образуется в результате перекрывания электронных облаков атомов, сопровождающегося выделением энергии. Если у сблизившихся до касания атомов водорода расстояние между ядрами составляет 0,106 нм, то после перекрывания электронных облаков (образования молекулы H2) это расстояние составляет 0,074 нм (рис. 6). Обычно наибольшее перекрывание электронных облаков осуществляется вдоль линии, соединяющей ядра двух атомов. Химическая связь тем прочнее, чем больше перекрывание электронных орбиталей. В результате возникновения химической связи между двумя атомами водорода каждый из них достигает электронной конфигурации атома благородного газа.
|
|
|
2.ОБМЕННЫЙ МЕХАНИЗМ - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. каждый из атомов предоставляет в общее пользование по одному электрону.
3.ДOНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ - образование связи происходит за счет пары электронов атома-донора и вакантной орбитали атома-акцептора.
МВС позволяет различать три механизма образования ковалентной связи: обменный, донорно-акцепторный, дативный.
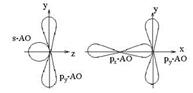
Обменный механизм. К нему относят те случаи образования химической связи, когда каждый из двух связываемых атомов выделяет для обобществления по одному электрону, как бы обмениваясь ими. Для связывания ядер двух атомов нужно, чтобы электроны находились в пространстве между ядрами. Эта область в молекуле называется областью связывания (область наиболее вероятного пребывания электронной пары в молекуле). Чтобы произошел обмен не спаренными электронами у атомов необходимо перекрывание атомных орбиталей (рис. 10,11). В этом и заключается действие обменного механизма образования ковалентной химической связи. Атомные орбитали могут перекрываться только в том случае, если они обладают одинаковыми свойствами симметрии относительно межъядерной оси (рис. 10, 11, 22).
|
|
|
. 
| |
Донорно-акцепторный и дативный механизмы.
Донорно-акцепторный механизм связан с передачей неподеленной пары электронов от одного атома на вакантную атомную орбиталь другого атома.
Вакантная р-АО в атоме бора в молекуле BF3 акцептирует пару электронов от фторид-иона (донор). В образовавшемся анионе четыре ковалентные связи В-F равноценны по длине и энергии. В исходной молекуле все три связи В-F образовались по обменному механизму.
Атомы, внешняя оболочка которых состоит только из s- или р-электронов, могут быть либо донорами, либо акцепторами неподеленной пары электронов. Атомы, у которых валентные электроны находятся и на d-АО, могут одновременно выступать и в роли доноров, и в роли акцепторов. Чтобы различить эти два механизма ввели понятия дативного механизма образования связи.
|
|
|
Список литературы
1. Габриелян О.С. Химия. Методическое пособие. 10-11 классы. М.: «Дрофа», 2005г.
2. Еремин В.В., Кузьменко Н.Е., Тренин В.И., химия. 10 класс: учебник для общеобразовательных учреждений(базовый уровень). – М.: Дрофа, 2009г.
3. Еремин В.В., Кузьменко Н.Е.,Дроздов А.А., химия. 11 класс: учебник для общеобразовательных учреждений базовый уровень). – М.: Дрофа, 2009г.
4. Рудзитис Г.Е., Фельдман Ф.Г, химия. 10 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
5. Рудзитис Г.Е., Фельдман Ф.Г, химия. 11 класс: учебник для общеобразовательных учреждений (базовый уровень). – М.: Просвещение, 2005
Перечень цифровых образовательных ресурсов и Web-сайтов Интернет
1. http://school-collection.edu.ru/. - единая коллекция цифровых образовательных ресурсов:
Дата добавления: 2021-04-23; просмотров: 111; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
