Для выполнения отчета по лабораторной работе использовать исходные данные времени протекания реакции
Лабораторная работа №4
Кинетика химических реакций
Цель работы: изучение скорости химической реакции и её зависимости от различных факторов – природы реагирующих веществ, концентрации, температуры.
В результате освоения материала по теме лабораторной работы студент должен:
Знать
· факторы, определяющие скорость химических реакций;
· зависимости скорости химических реакций от концентрации;
Уметь
· рассчитывать скорость химической реакции;
· наблюдать за протеканием химической реакции во времени;
· осуществлять отчеты времени по секундомеру;
Владеть
· навыками проведения эксперимента по определению скорости химической реакции при изменении условий;
· навыками подбора условий, способствующих проведению химической реакции с требуемой скоростью.
Теоретическое введение
Химическая кинетика – учение о скоростях и механизмах протекания химических реакций. Скорость химической реакции равна изменению концентрации реагирующего вещества в единицу времени. Средняя скорость определяется соотношением
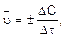
где 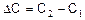 – изменение концентрации вещества за промежуток времени
– изменение концентрации вещества за промежуток времени 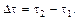 Знак (+) означает, что вещество образуется, а знак (–) – что вещество расходуется в ходе реакции.
Знак (+) означает, что вещество образуется, а знак (–) – что вещество расходуется в ходе реакции.
Истинная (мгновенная) скорость реакции выражается следующим образом:
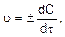
где dC – бесконечно малое изменение концентрации вещества за бесконечно малый промежуток времени 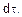
|
|
|
Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания реакции – концентрации реагентов, температуры, наличия катализатора, интенсивности перемешивания и др.
Зависимость скорости реакции от концентрации реагирующих веществ выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам в уравнении реакции.
Для реакции аА + bВ ® rR математическое выражение закона действующих масс имеет вид (называется кинетическим уравнением химической реакции)
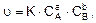
где u – скорость химической реакции; К – константа скорости; СА, СВ – молярные концентрации реагирующих веществ; а, b – стехиометрические коэффициенты.
В кинетическое уравнение реакции не включают концентрации веществ, образующих отдельную конденсируемую фазу, т.к. они являются постоянными величинами и входят в значение константы скорости реакции.
Экспериментальная часть
Опыт 1. Изучение влияния концентрации тиосульфата натрия на скорость реакции
|
|
|
Na2S2O3 + H2SO4 = Na2SO4 + SO2 +H2O +S¯.
Выделяющаяся сера вызывает помутнение первоначально прозрачной реакционной массы. Промежуток времени от момента сливания растворов реагентов до момента помутнения раствора пропорционален скорости реакции.
Для проведения опыта возьмите 3 пробирки, в которые внесите 0,5М раствор тиосульфата натрия и дистиллированную воду следующим образом:
1-я пробирка: 4 капли раствора Na2S2O3 и 8 капель Н2О – перемешайте;
2-я пробирка: 8 капель раствора Na2S2O3 и 4 капли Н2О – перемешайте;
3-я пробирка: 12 капель раствора Na2S2O3.
Таким образом, в каждой пробирке должно находиться по 12 капель раствора тиосульфата натрия с различной концентрацией. Если относительную концентрацию соли (сотн) в 1-й пробирке принять равной 1 (4 капли раствора соли), то во 2-й пробирке концентрация составит 2 (8 капель) и в 3-й – 3 (12 капель).
Добавьте 1 каплю 1н раствора серной кислоты в первую пробирку и встряхните содержимое. С помощью секундомера измерьте время с момента попадания капли кислоты в раствор соли до появления помутнения раствора (t, с). Проделайте поочередно то же самое со 2-й и 3-й пробирками.
Экспериментальные данные занесите в таблицу 1.
Таблица 1. Экспериментальные данные
|
|
|
|
Номер пробирки | Количество капель реагентов |
Относительная концентрация Na2S2O3 |
Время реакции t, с | Относительная скорость реакции 1/t, с-1 | ||
| Na2S2O3 | H2O | H2SO4 | ||||
| 1 | 4 | 8 | 1 | 1 | ||
| 2 | 8 | 4 | 1 | 2 | ||
| 3 | 12 | 0 | 1 | 3 | ||
Постройте график зависимости 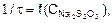 отложив по оси Х значение относительных концентраций тиосульфата натрия, а по оси Y – значения соответствующих относительных скоростей реакции.
отложив по оси Х значение относительных концентраций тиосульфата натрия, а по оси Y – значения соответствующих относительных скоростей реакции.
Концентрация серной кислоты в опыте постоянна, следовательно, кинетическое уравнение будет иметь вид
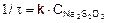
а график будет прямой линией, выходящей из начала координат под углом α к оси Х (рис. 1).
Рассчитайте относительную константу скорости реакции из полученного графика по формуле
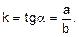
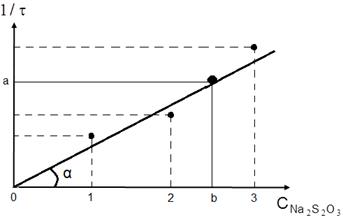
Рис. 1. Зависимость относительной скорости реакции от относительной концентрации тиосульфата натрия.
В выводе отметьте зависимость скорости реакции от концентрации тиосульфата натрия при данных условиях. Укажите возможные причины ошибки опыта.
Для выполнения отчета по лабораторной работе использовать исходные данные времени протекания реакции
|
Время t, с |
Группы
| |||||||||
| 23х | 23хх | 24х | 24хх | 25х | 25хх | 25 вх | 25вхх | |||
| t1 | 33 | 22 | 20 | 14 | 28 | 25 | 20 | 16 | ||
| t2 | 14 | 11 | 9 | 7 | 13 | 12 | 8 | 8 | ||
| t3 | 10 | 7 | 6 | 5 | 9 | 8 | 6 | 5 | ||
|
Время t, с |
Группы | ||||||
| 26х | 26хх | 27х | 27хх | 28х | 28хх |
| |
| t1 | 40 | 21 | 15 | 18 | 28 | 29 | |
| t2 | 20 | 10 | 8 | 9 | 13 | 16 | |
| t3 | 12 | 76 | 5 | 6 | 8 | 11 | |
Контрольные вопросы:
1. Что называется скоростью химической реакции?
2. Какие факторы влияют на скорость реакции?
3. Напишите математическое выражение закона действующих масс для реакций:
а) N2O4(г) = 2NO(г);
б) 2NO(г) + Br2(г) = 2NOBr(г);
в) С(т) + О2(г) = СО2(г).
4. Что называется энергией активации реакции?
Химическое равновесие
Цель работы: изучение влияния различных факторов на химическое равновесие и расчет константы равновесия.
В результате освоения материала по теме лабораторной работы студент должен:
Знать
· сущность обратимости химических реакций;
· характеристики химического равновесия;
· принцип смещения химического равновесия Ле Шателье – Брауна;
Уметь
· вычислять константы химического равновесия;
· определять направление химической реакции в данных условиях и концентрации веществ в состоянии равновесия;
Владеть
· навыками проведения эксперимента по установлению и смещению химического равновесия.
Теоретическое введение
В результате самопроизвольного протекания химической реакции свободная энергия Гиббса системы понижается и может достичь своего минимального значения еще до того, как реагенты будут израсходованы полностью. Тогда в системе установится равновесие между оставшимися реагентами и накопившимися продуктами. Наступившее равновесное состояние изображается знаком обратимости реакции:
пр

 аA + bB rR + qQ.
аA + bB rR + qQ.
обр
Равенство uпрямой р = uобратной р является кинетическим условием химического равновесия.
Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих в реакции.
Согласно закону действующих масс, в условиях равновесия выполняется соотношение
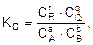
где КС – постоянная величина при данной температуре, называемая константой равновесия; 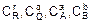 – равновесные молярные концентрации участвующих в реакции веществ; r, q, a, b – стехиометрические коэффициенты уравнения реакции.
– равновесные молярные концентрации участвующих в реакции веществ; r, q, a, b – стехиометрические коэффициенты уравнения реакции.
В общем случае константа равновесия равна отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ в степенях их стехиометрических коэффициентов. Константа равновесия также равна отношению констант скоростей прямой и обратной реакций, т.е.
Кравн = 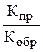
Константа равновесия Кравн зависит только от природы реагентов, температуры и давления и не зависит от концентраций исходных веществ в системе. Чем больше величина Кравн, тем больше образовалось к моменту наступления равновесия продуктов реакции. Химическое равновесие неизменно до тех пор, пока остаются постоянными параметры, при которых установилось равновесие. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, которое характеризуется новыми равновесными концентрациями всех веществ. Переход системы из одного состояния равновесия в другое называется смещением химического равновесия. Равновесие смещается в ту или иную сторону (вправо ® или влево ) из-за различного влияния на скорости прямой и обратной реакций изменения параметров. Равновесие смещается в сторону той реакции, скорость которой при изменении условий стала больше.
В общем случае направление смещения равновесия определяется принципом Ле Шателье – Брауна: если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, изменив один из параметров, то система перейдет в новое состояние равновесия таким образом, чтобы уменьшить эффект произведенного воздействия. Так, увеличение концентрации какого-либо вещества, участвующего в реакции, смещает равновесие в сторону реакции, понижающей его концентрацию, а понижение – в сторону образования этого вещества. При повышении температуры равновесие смещается в сторону эндотермической реакции (DrН > 0), а при понижении температуры – в сторону экзотермической реакции (DrН < 0). Увеличение давления в системе смещает равновесие в сторону реакции, идущей с уменьшением объема газообразных веществ, понижение – в сторону реакции, идущей с увеличением объема. Если в результате реакции не происходит изменения объема газообразных веществ, то изменением давления нельзя сместить равновесие данной реакции. Катализатор не вызывает смещения равновесия, т.к. одинаково увеличивает скорости прямой и обратной реакций.
Экспериментальная часть
Дата добавления: 2021-04-15; просмотров: 116; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
