Оксиды азота(II), (III), (IV); азотная кислота
Водородные соединения азота
Получение аммиака
Внимание, тяга!
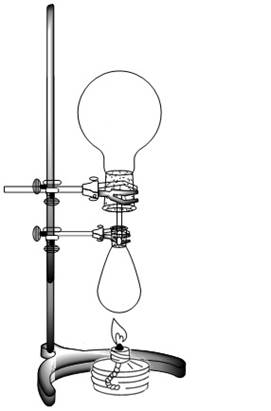
У1. К 2,0 г хлорида аммония добавьте 3,0 г гидроксида кальция, тщательно перемешайте, растирая в фарфоровой ступке. Хорошо перетертую смесь (уже при комнатной температуре она должна сильно пахнуть аммиаком) внесите в грушевидную колбу, закройте пробкой со стеклянной трубкой и закрепите на штативе (рис. 8.1). Над ней горлом вниз разместите круглодонную колбу-приемник (Внимание! Колба-приемник должна быть совершенно сухой!). Нагревайте грушевидную колбу со смесью с помощью спиртовки либо уротропина (сухого горючего). Контролируйте наполнение колбы-приемника аммиаком с помощью: 1) стеклянной палочки, смоченной концентрированной соляной кислотой (появление «дыма») 2) универсального индикатора (посинение бумаги). После заполнения колбы-приемника аммиаком ее необходимо закрыть пробкой с оттянутой трубкой и использовать в опыте У2.
|
|
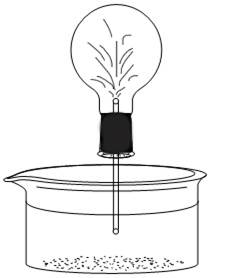
| Рис. 8.1. Установка для получения аммиака. | Рис. 8.2. «Аммиачный фонтан». |
У2. Подготовьте кристаллизатор, наполненный на 2/3 по объему водой (рис. 8.2). Добавьте 10–15 капель раствора фенолфталеина и перемешайте. Не переворачивая колбу с полученным аммиаком, закройте стеклянную трубку пальцем и опустите ее конец в кристаллизатор с водой. Приотпустите палец таким образом, чтобы несколько капель воды попало в трубку. После этого, не отпуская палец с конца трубки, извлеките ее из воды и, аккуратно регулируя нажатие пальца, позвольте каплям в трубке попасть в колбу с аммиаком. После этого встряхните колбу для максимального растворения аммиака в попавшей воде. Повторите такую процедуру введения воды в колбу еще 1–2 раза. Далее опустите конец трубки в воду и полностью отпустите палец. Наблюдайте появление окрашенного «фонтана».
|
|
|
Комментарии. Почему для получения аммиака используют гидроксид кальция, какую он выполняет функцию? Можно ли вместо Ca(OH)2 использовать: гидроксид натрия или калия, оксид кальция? Почему газообразный аммиак собирают в колбу, повернутую горлом вниз?
Каков состав «дыма» при взаимодействии аммиака с хлороводородом? Будет ли наблюдаться появление «дыма», если вместо концентрированной соляной кислоты использовать: а) концентрированную серную кислоту б) концентрированную азотную кислоту?
В чем причина возникновения "фонтана"? Почему колба-приемник должна быть совершенно сухой? Приведите значение растворимости аммиака в воде.
Как протекает термическое разложение нитрата, нитрита, дихромата, сульфата, гидрокарбоната, ортофосфата аммония?
Гидрат аммиака
П1. 1–2 капли разбавленного раствора гидрата аммиака нанесите на полоску универсального индикатора. Наблюдайте изменение цвета индикатора, сделайте вывод о рН раствора гидрата аммиака.
|
|
|
П2. К 2 каплям раствора соли магния добавьте 4 капли разбавленного раствора гидрата аммиака. Наблюдайте выпадение осадка. Отметьте его цвет.
П3. К 2 каплям раствора соли алюминия добавьте 4 капли разбавленного раствора гидрата аммиака. Наблюдайте выпадение осадка. Отметьте его цвет.
П4. К 2 каплям раствора соли железа(III) добавьте 4 капли разбавленного раствора гидрата аммиака. Наблюдайте выпадение осадка. Отметьте цвет образовавшегося метагидроксида железа.
П5. К 6 каплям концентрированного раствора гидрата аммиака добавьте 2 капли бромной воды. Полученный раствор нагрейте. Наблюдайте выделение газа. Как изменяется окраска бромной воды?
П6. К 6 каплям концентрированного раствора гидрата аммиака добавьте 2 капли раствора перманганата калия. Полученный раствор нагрейте. Наблюдайте выделение газа и образование осадка. Отметьте цвет осадка.
Комментарии. Используя значения ПР, охарактеризуйте растворимость гидроксидов магния, алюминия, железа(III).
Выполняется ли критерий протекания ОВР в П5 и П6?
Гидразин и гидроксиламин
|
|
|
П1. К 4 каплям раствора сульфата меди(II) добавьте 2 капли концентрированного раствора гидроксида натрия. Наблюдайте выпадение осадка. Отметьте его цвет. К полученной суспензии добавьте 2 капли концентрированного раствора хлорида гидразиния. Наблюдайте выделение газа и изменение цвета осадка. Немного подогрейте полученную суспензию, наблюдайте дальнейшее изменение цвета осадка.
П2. К 4 каплям раствора перманганата калия добавьте 1 каплю разбавленной серной кислоты и 2 капли концентрированного раствора хлорида гидразиния. Наблюдайте выделение газа и изменение цвета раствора.
П3. К 4 каплям раствора дихромата калия добавьте 1 каплю разбавленной серной кислоты и 2 капли концентрированного раствора хлорида гидроксиламиния. Наблюдайте выделение газа и изменение цвета раствора.
П4. К 4 каплям концентрированного раствора хлорида гидразиния добавьте 2 капли раствора сульфида натрия. Наблюдайте выпадение осадка. Отметьте его цвет.
Комментарии. Изобразите структурные формулы NH3, N2H4 и NH2OH.
Каковы протолитические свойства гидрата аммиака, гидрата гидразина и гидрата гидроксиламина? В каком порядке и почему увеличивается основность этих соединений? Подтвердите свой вывод значениями Kо.
|
|
|
Дайте оценку окислительно-восстановительным свойствам водородных соединений азота, используя значения φ°. Почему при окислении водородных соединения азота основным продуктом является диазот?
Сравните протолитические и окислительно-восстановительные свойства водородных соединений азота и фосфора.
Оксиды
Оксиды азота(II), (III), (IV); азотная кислота
Внимание, тяга!
У1. Соберите установку, изображенную на рис. 8.3.
Внимание! Все части установки до опыта должны быть сухими!
Поместите твердый нитрат свинца(II) в пробирку-реактор (1/10 объема). U-образную трубку поместите в охлаждающую смесь (лед + хлорид натрия технический, соотношение примерно 10:1 по объему). Нагревайте пробирку с нитратом свинца(II), наблюдайте разложение соли и образование газа. Отметьте его цвет. Также наблюдайте накопление газа в пробирке-приемнике для кислорода.
В пробирку с собранным кислородом внесите тлеющую лучинку, наблюдайте ее горение.
Через 5–10 минут, после изменения цвета прокаливаемого вещества (отметьте изменение цвета), аккуратно вытащите U-образную трубку из охлаждающей смеси и проверьте наличие жидкости (цветовая гамма: от бесцветной до сине-зеленой, в зависимости от попавшей в трубку воды и влажности нитрата свинца(II)).
Отсоедините U-образную трубку от установки и добавляйте по каплям воду из промывалки, наблюдая выделение газа и тщательно фиксируя все изменения окраски. После обесцвечивания жидкости добавьте одну ее каплю на полоску универсального индикатора, наблюдайте ее обесцвечивание.
После этого добавьте в U-образную трубку 10 мл воды и добавьте 1 каплю полученного раствора на полоску универсального индикатора, наблюдайте изменение окраски, сделайте вывод об изменении рН.
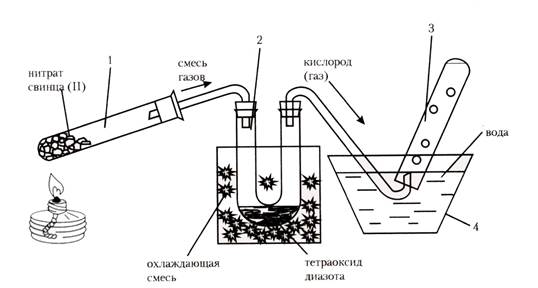
Рис.3. Установка для получения оксидов азота: 1 – пробирка-реактор; 2 – U-образная трубка; 3 – пробирка для сбора кислорода.
Комментарии. Каков состав выделяющихся газообразных и твердого продуктов разложения нитрата свинца(II)? Каков состав жидкости в U-образной трубке в начале эксперимента и как он меняется при постепенном добавлении воды?
Какие свойства газообразных продуктов разложения позволяют их разделить?
Каков характер взаимодействия изучаемых продуктов с водой?
Почему при первом измерении рН универсальный индикатор обесцвечивается?
Как проходит протолиз азотной и азотистой кислоты в водном растворе? Приведите значение Kк для азотистой кислоты.
Сравните кислотно-основные и окислительно-восстановительные свойства оксидов азота и соответствующих им кислот. Изобразите структурные формулы всех оксидов азота.
Дата добавления: 2021-04-15; просмотров: 179; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
