Расчет состава продуктов реакции бромирования 2,2,4-триметилпентана
Контрольная работа № 1
Приведите механизм хлорирования пропана. Рассчитайте теплоты реакций стадии развития цепи, укажите медленную стадию реакции. Какой из галогенов: хлор или бром - более реакционноспособен по отношению к этому углеводороду? Дайте объяснение.
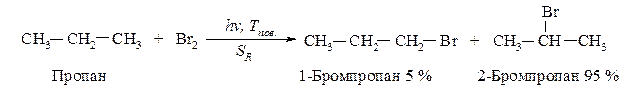
Механизм реакции:
1 стадия
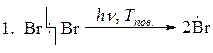 Инициирование, зарождение цепи
Инициирование, зарождение цепи
2 стадия - развитие, рост цепи
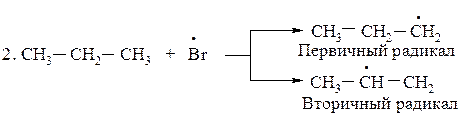
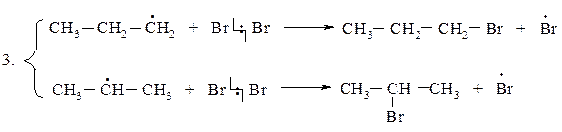
(2),(3),(2),(3),(2),(3)………
3 стадия – обрыв цепи

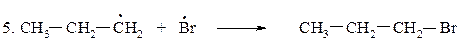
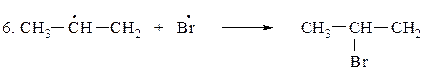
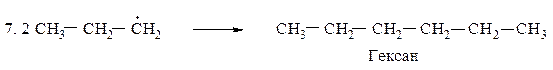
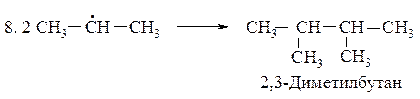
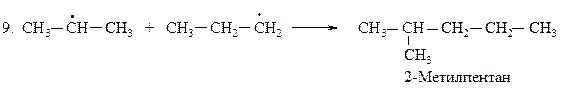
Для определения медленной стадии рассчитываем теплоты реакций стадии развития цепи, поскольку в реакции бромирования на 95 % образуется вторичный бромид, расчёт проводим по вторичному атому углерода.
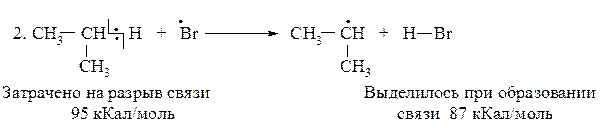
DН(2)Br = 95-87= +8 кКал/моль (эндотермическая реакция)
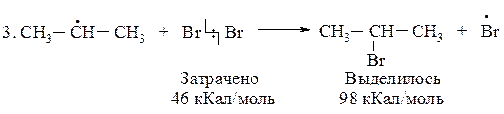
DН(3)Br = 46-68= -22 кКал/моль (экзотермическая реакция)
Реакция (2) образования алкильного радикала в реакции бромирования является эндотермической реакцией, поэтому она протекает с более высокой энергией активации, а значит с меньшей скоростью. Следовательно, эта реакция является медленной скоростьопределяющей стадией. Эта закономерность сохраняется и для других галогенов, поэтому для хлора рассчитываем медленную стадию.
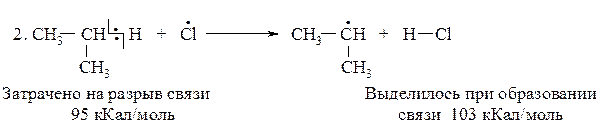
DН(2)Cl = 95-103= -8 кКал/моль (экзотермическая реакция)
Медленная стадия реакции хлорирования является экзотермической реакцией, а реакция бромирования эндотермической реакцией поэтому протекает с большей энергией активации, а значит с меньшей скоростью. Следовательно бром менее реакционноспособнее чем хлор.
Если в условиях задачи требуется. Объясните, почему реакция хлорирования этого углеводорода протекает при комнатной температуре, а реакция бромирования - при повышенной температуре.
Медленная стадия реакции хлорирования является экзотермической реакцией идет с выделением тепла поэтому протекает при комнатной температуре, а реакция бромирования эндотермической реакцией идет с поглощением тепла поэтому протекает при повышенной температуре
Если в условиях задачи требуется. Приведите ряд изменения реакционной способности галогенов в реакции с этаном.
В этом случае рассчитываем для других галогенов медленную стадию
Реакция фторирования
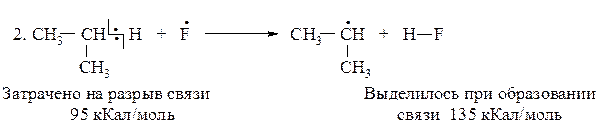
DН(2)F = 95-135= -40 кКал/моль (экзотермическая реакция)
Реакция хлорирования
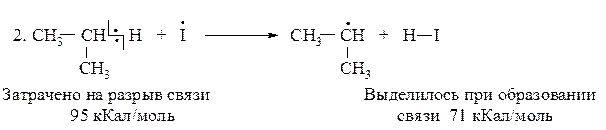
DН(2)I = 95-71= +24 кКал/моль (эндотермическая реакция)
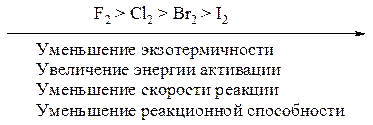
Если в условиях задачи требуется. Объясните, почему бромирование замедляется при добавлении бромоводорода, а добавление хлороводорода почти не влияет на скорость реакции хлорирования метана.
Медленная стадия реакции хлорирования является экзотермической реакцией, поэтому протекает с меньшей энергией активации, следовательно с большей скоростью и поэтому хлор более реакционноспособен чем бром.

Медленная стадия реакции хлорирования протекает с низкой энергией активации. При добавлении НСl протекает обратная реакция, но т.к. она протекает с более высокой энергии активации, поэтому добавление НСl практически не оказывает влияния на скорость реакции.

Медленная стадия реакции бромирования протекает с высокой энергией активации. При добавлении НBr протекает обратная реакция, но т.к. она протекает с более низкой энергии активации, поэтому добавление НBr замедляет скорость реакции.
88. Какие алкильные радикалы могут образовываться в реакции бромирования из молекулы 2,2,4-триметилпентана? Сравните их ус-тойчивость, легкость образования. Укажите наиболее прочную C-H связь в данном соединении. Рассчитайте процентный состав монобромпроизводных, образующихся в реакции.

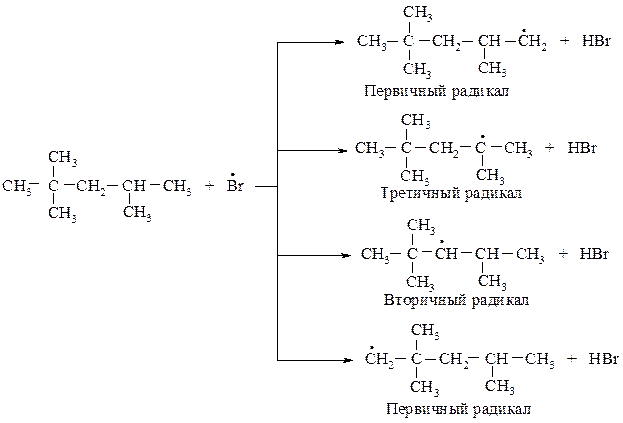
Наиболее прочная связь у первичного атома углерода. Для отрыва третичного атома водорода требуется меньше энергии, чем для отрыва вторичного, т.е. третичный радикал образуется легче, чем вторичный, вторичный радикал образуется легче, чем первичный. Следовательно, относительная легкость отщепления атомов водорода такова: третичный > вторичный > первичный > Н–СН3.
Ряд легкости образования радикалов изменяется в порядке: третичный > вторичный > первичный > · CH3 .
Наиболее устойчив третичный радикал так как в нем в большей степени делокализаван неспаренный электрон в результате его взаимодействия с электронами С-Н-связей соседних атомов углерода.
Устойчивость радикалов соответствует порядку изменения легкости образования радикалов. Отсюда выводим ряд устойчивости радикалов: третичный > вторичный > первичный > · СН3.
Расчет состава продуктов реакции бромирования 2,2,4-триметилпентана
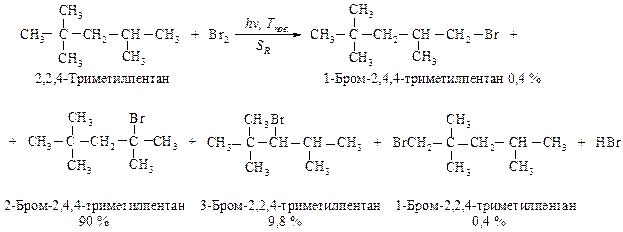
Относительные скорости замещения первичного, вторичного и третичного атомов водорода для реакции бромироваия имеют такие значения:
1:82:1600 Общая активность первичных атомов водорода равна 1•15=15, вторичных составляет 82•2=164, третичных равна 1600•1=1600. Активность всех атомов водорода равна 15+164+1600=1779 и принимается за 100 %. Массовая доля 1-Бром-2,4,4-триметилпентана и 1-Бром-2,2,4-триметилпентана в продуктах реакции составляет 15:1779•100= 0,8 %. Поскольку эта сумма приходится на два соединение делим эту сумму на 2, т.е. по 0,4 %, массовая доля 2-Бром-2,4,4-триметилпентана равна 1600:1779•100=90 %, массовая доля 3-Бром-2,2,4-триметилпентана равна 164:1779•100=9,8 %
Если в задании будет реакция хлорирования. то расчет будет таким все остальное как и при бромировании

Относительные скорости замещения первичного, вторичного и третичного атомов водорода для реакции бромироваия имеют такие значения:
1:3,8:5,0 Общая активность первичных атомов водорода равна 1•15=15, вторичных составляет 3,8•2=7,6, третичных равна 5,0•1=5,0. Активность всех атомов водорода равна 15+7,6+5,0=27,6 и принимается за 100 %. Массовая доля 2,4,4-триметил-1-хлорпентана и 2,2,4-триметил-1-хлорпентана в продуктах реакции составляет 15:27,6•100= 54,4 %. Поскольку эта сумма приходится на два соединение делим эту сумму на 2, т.е. по 27,2 %, массовая доля 2,4,4-триметил-2-хлорпентана равна 5:27,6•100=18,1 % равна, массовая доля 2,4,4-триметил-3-хлорпентана равна 7,6:27,6•100=27,5 %
135. Рассмотрите механизм реакции взаимодействия 3,3-диметил-1-пентена с бромоводородом, укажите условия проведения реакции (образуется два продукта, учтите возможность перегруппировки), сформулируйте правило Марковникова в современной трактовке.
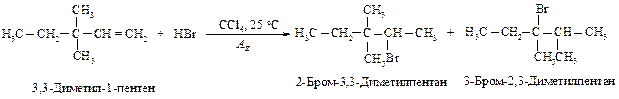
Реакция протекает механизму электрофильного присоединения (АЕ). По этому механизму присоединяются галогены (Cl2 и Br2), галогеноводороды (HI, HBr, HCl), Н2О, RОН, Н2SO4
Реакция протекает по правилу Марковникова Электрофильное присоединение к алкенам происходит через стадию образования более устойчивого карбокатиона
Механизм реакции
Реакция начинается с присоединения электрофила НÅ с образованием карбокатиона.
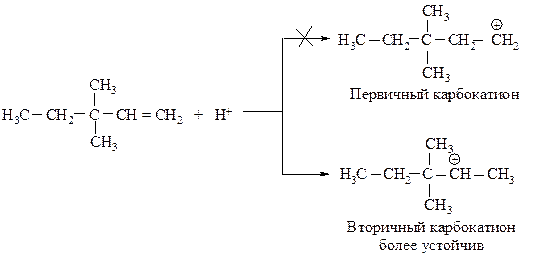
Образовавшийся устойчивый вторичный карбокатион может перегруппировываться в более устойчивый третичный карбокатион. Перегруппировка состоит в переносе метиланиона CH3Ө (СН3 с двумя электронами) к соседнему атому углерода (1,2-сдвиг).

180. При озонолизе соединения C8H16 был получен бутанон CH3CН2СOСН3. Установите строение исходного соединения. Напишите уравнение реакции его полимеризации.
Озонолиз алкена

Полимеризация алкена

Продукт бромирования 2,2,5-триметилгексана обработали спиртовым раствором щелочи при повышенной температуре. Напишите уравнения реакций полученного продукта и назовите соединения, которые образуются при действии на него: а) бромоводорода в отсутствие пероксида б) бромоводорода в присутствии пероксида в) озона, г) разбавленного перманганата калия на холоду, д) концентрированного раствора перманганата калия в присутствии серной кислоты при нагревании. е) гидропероксида бензоила (С6Н5С(О)ООН. Сформулируйте правило Зайцева.


270. Рассмотрите механизм взаимодействия 3,5-диметил-1,3-гексадиена с бромоводородом.
Для сопряженных диенов характерны реакции электрофильного присоединениягалогенов, галогеноводородов. Особенностью этих реакций является присоединение не только по каждой из двойных связей (1,2 - присоединение), но и по концам сопряженной системы (1,4 - присоединение).
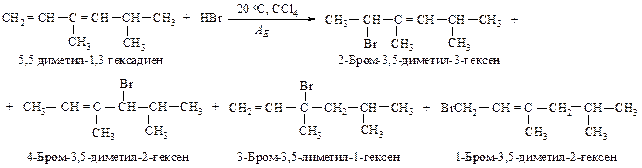
Механизм реакции:
Первая стадия - присоединение протона - протекает с образованием более устойчивого карбокатиона.
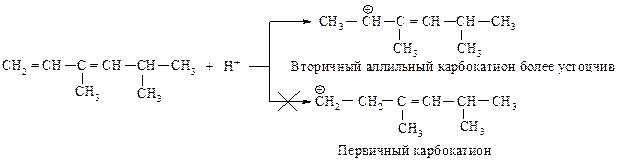
В аллильном карбокатионе положительно заряженный углерод находиться в a -положении по отношению к двойной связи. Такой катион так же устойчив, как третичный, вследствие распределения заряда: половина положительного заряда находиться на одном атоме углерода, а половина - на другом, два p-электрона распределены по р-орбиталям трех атомов углерода:
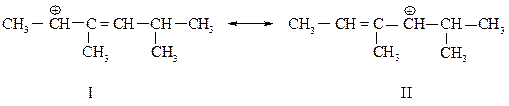
Ни одна из граничных структур с локализованными зарядами (I и II), в которых различно только (!) разделение p-электронов, не показывает правильно строение карбокатиона. Реальная частица представляет собой нечто промежуточное между ними - резонансный гибрид этих структур.

Вторая стадия - присоединение аниона, брома к любому из положительно заряженных атомов углерода.
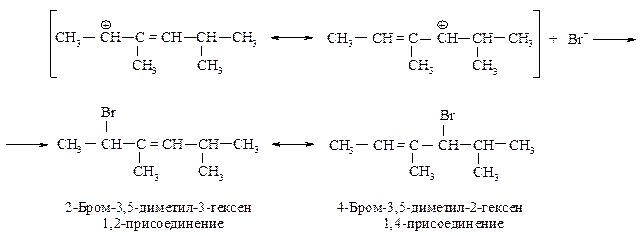
Присоединение по второй двойной связи
Первая стадия:
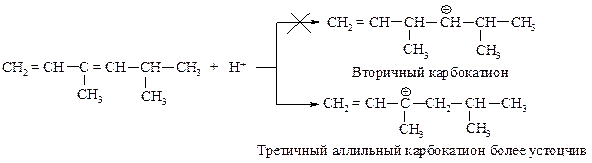
Вторая стадия
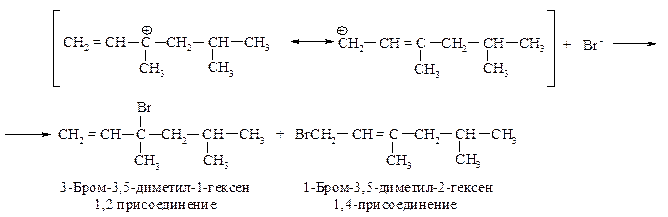
315. Получите по реакции Дильса-Альдера следующее соединение:
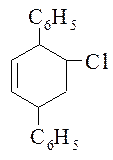
Диеновым синтезом называется реакция сопряженных диенов с ненасыщенными соединениями (реакция Дильса-Альдера). Реакция происходит с большой легкостью при наличии электронодонорных групп в диене и электроноакцепторных групп в диенофиле.
Реакция Дильса-Альдера стереоспецифична : конфигурации диена и диенофила сохраняются в аддукте.
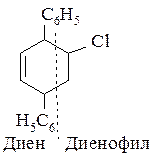
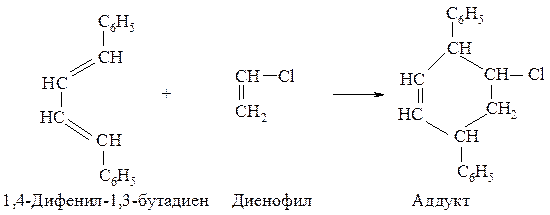
360. Напишите схему полимеризации 2,3-диметил-1,3-гексадиена. Проведите озонолиз полученного полимера.
Полимеризация диенов предпочтительно идет по 1,4-положениям через образование наиболее устойчивых частиц.
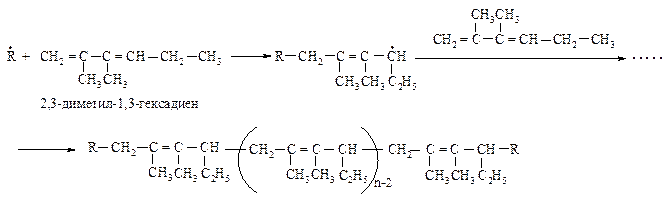
Озонолиз полимера

342. Установите строение полимера, при озонолизе которого образуется соединение ОНС-СН2-СН2-СHО. Напишите уравнение реакции образования этого полимера.
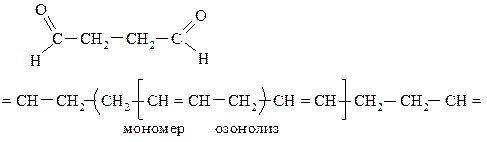
Схема полимеризации
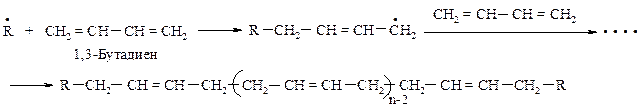
Озонолиз полимера

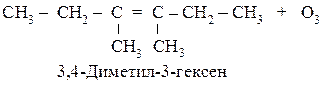

Дата добавления: 2021-04-05; просмотров: 609; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
