Предварительные результаты показывают, что спленосохранные операции улучшают непосредственные результаты лечения и качество жизни больных без ущерба онкологическому радикализму.
ВИДЫ ХИРУРГИЧЕСКИХ ОПЕРАЦИЙ В ОНКОЛОГИИ
Резекция — частичное удаление органа с восстановлением или без восстановления его непрерывности.
Ампутация (-эктомия) — усечение, удаление одного отдела органа. Экстирпация (радикальная -эктомия) полное удаление органа, пораженного раком.
ТИПЫ ОНКОЛОГИЧЕСКИХ ОПЕРАЦИЙ
1. Радикальные операции предусматривают радикализм по отношению к первичной опухоли и к регионарным метастазам. Операция выполняется в зоне местного распространения опухоли. К ним относятся:
а) обычные радикальные операции, при которых удаляют основную опухоль и близлежащие зоны ее метастазирования в лимфатическую систему;
б) расширенные операции, при которых удаляются метастазы из соседних анатомических областей (органов или лимфоузлов)
в) комбинированные операции, в результате которых удаляют часть органа или полностью другой орган, куда проросла опухоль основной локализации.
2. Паллиативные операции — резекция или экстирпация органа с оставлением неудалимых метастазов. При таких операциях устраняется, например, непроходимость, кровотечение, уменьшается интоксикация и создаются условия для последующего лучевого или медикаментозного лечения. К паллиативным операциям можно отнести и удаление солитарных отдаленных метастазов. Затем проводится химиотерапия циторедуктивное лечение.
3. Симптоматические операции — хирургические вмешательства, устраняющие ведущий патологический симптом, приводящий к смерти больного: непроходимость желудочнокишечного тракта, желчных путей, кровотечение из опухоли. В этих случаях операция сводится к устранению данного симптома путем наложения внутренних обходных анастомозов или наружных свищей и к перевязке сосудов.
|
|
|
Иногда для удаления опухоли используют так называемые <методы тканевой деструкции>, к ним относятся электрокоагуляция, криодеструкция и лазерная терапия. При воздействии различными тепловыми режимами и лазерным излучением достигается разрушение самой опухоли и части окружающих тканей. Рассчитывать на радикализм в данном случае трудно, а убедиться, насколько полностью разрушена опухоль, нельзя, так как исследованию можно подвергнуть лишь некротические ткани. Чаще всего, эти методы используют при удалении поверхностных опухолей на ранних стадиях.
По мере совершенствования технических и клинических методов исследования в онкологии необходимое представление о диагнозе формируется до начала лечения. Однако в отдельных случаях приходится прибегать к диагностической (эксплоративной) операции вскрытию полости и непосредственному обследованию пораженного органа.
|
|
|
При этом можно взять материал для морфологического исследования, чем уточняется и характер заболевания, и степень распространенности процесса. Подтверждение диагноза диктует выполнение радикальной, паллиативной или симптоматической операции. Все эти действия хирург обязан заранее оговорить с пациентом.
Современные достижения клинической онкологии позволяют излечить не менее 1/3 больных, страдающих злокачественными новообразованиями. Большинство пациентов (60-70 %) подвергаются хирургическому лечению или операции в сочетании с лучевой или химиотерапией. Около 30 % больных получают только облучение и до 10 % - только цитостатическое лечение. Шансы на благоприятный исход у потенциально излечимых больных значительно возрастают при использовании всех возможностей для установления правильного диагноза и проведения адекватного лечения. Самым важным условием излечения преобладающего большинства злокачественных опухолей является ранняя стадия процесса.
Оптимальными являются лечение и наблюдение онкологических пациентов в специализированных клиниках, оснащенных современным медицинским оборудованием, с высококвалифицированным медицинским персоналом.
|
|
|
Планирование лечения конкретного больного должно осуществляться группой специалистов-онкологов (патоморфолог, хирург, лучевой терапевт и химиотерапевт). При обсуждении лечебной тактики необходимо учитывать все индивидуальные биологические критерии заболевания, к которым относятся как особенности опухолевого процесса (гистологический тип, стадия), так и общее состояние больного, наличие сопутствующей патологии, состояние иммунитета и т.п. Коллективный подход к лечению больного представляется наиболее оптимальным, поскольку обеспечивает преемственность и максимально полный объем лечебной помощи. Возможные варианты лечения включают применение одного из методов воздействия на опухоль (хирургического, лучевого или лекарственного) или, значительно чаще, различных их комбинаций. Последовательность применения лучевого, лекарственного и хирургического методов лечения
варьирует в зависимости от морфологической характеристики опухоли, распространенности злокачественного процесса, чувствительности опухоли к цитостатикам, задач лечения, наличия у больного сопутствующей патологии и др.
В клинической онкологии используют следующие варианты лечения:
|
|
|
• комбинированное лечение - применение у одного больного двух однонаправленных методов лечения (например, локальное воздействие на опухоль путем выполнения радикальной операции с последующим курсом лучевой терапии);
• комплексное лечение - применение локального и системного методов воздействия на опухоль (например, хирургического и лекарственного лечения).
Отдельно выделяют сочетанный вариант лечения, подразумевающий одновременное применение принципиально однородных методов с различным механизмом действия (например, сочетание дистанционного и внутритканевого облучения).
Лечение онкологических больных может быть радикальным, паллиативным и симптоматическим. Радикальным называется такой вид лечения, после проведения которого в организме больного не выявляются клинические, рентгенологические, эндоскопические и морфологические признаки опухолевого процесса. После выполнения паллиативного лечения в организме больного сохраняются проявления опухолевого заболевания. При проведении симптоматического лечения все мероприятия направлены только на устранение тягостных или угрожающих жизни симптомов и осложнений заболевания.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ
Как правило, хирург является первым специалистом, к которому обращается больной, страдающий злокачественным новообразованием. Кроме того, в процессе лечения онкологического пациента возникает необходимость в хирургическом вмешательстве для морфологической верификации диагноза, определения степени распространения опухолевого процесса, для реализации паллиативных задач и т.п. Профессионализм хирурга-онколога заключается также в знании как стандартных, так и нестандартных вариантов лечения злокачественных опухолей, способности объяснить их больному, в адекватном и полном выполнении начальных этапов в диагностике и лечении.
Проведение морфологического исследования позволяет выбрать адекватный объем хирургического вмешательства, а также предоставляет юридические основания для выполнения в случае необходимости калечащей операции.
Хирургические вмешательства подразделяются на диагностические и лечебные.
Диагностические операции (тонкоигольная и трепанобиопсия, ножевая биопсия, видеоассистированные операции) выполняются для верификации диагноза и определения степени распространения опухолевого процесса. Выделяют биопсии лимфатических узлов, опухоли (молочной железы, конечностей, ЖКТ, дыхательных путей).
Лечебные операции подразделяются на радикальные, условнорадикальные или циторедуктивные и паллиативные.
В онкологической практике приняты понятия, характеризующие общие показатели хирургической активности.
1. Операбельность. Понятие операбельности включает так называемые общие критерии, определяющие состояние больного, его возраст, сопутствующие заболевания, функциональные резервы жизненно важных органов, принципиально позволяющие выполнить операцию, а также критерии, характеризующие опухоль и опухолевый процесс в целом. К ним относятся локализация опухоли, анатомо-функциональные нарушения в пораженном органе, степень распространения опухоли, наличие отдаленных метастазов, тип роста опухоли и ее гистологическое строение. Состояние, исключающее возможность проведения хирургического лечения, принято называть иноперабельностью. Решение вопроса о возможности выполнения радикального оперативного вмешательства должно приниматься только после тщательного обследования больного, желательно в условиях стационара. По обобщенным данным, неоперабельными ошибочно признаются до 15-20 % онкологических больных. Необоснованный же отказ от операции значительно уменьшает шансы пациента на излечение.
2. Резектабельность. В отличие от операбельности под резектабельностью понимается техническая возможность удаления опухоли с учетом степени ее распространения, т.е. глубины поражения органа, наличия регионарных и отдаленных метастазов. Резектабельность опухоли определяется клинически, с помощью дополнительных методов обследования и интраоперационно.
Радикальные операции предусматривают радикализм по отношению к первичной опухоли и ее регионарным метастазам. После выполнения радикальной операции в организме не остается опухолевых очагов, определяемых клиническими, рентгенологическими, эндоскопическими или морфологическими методами.
Выделяют:
1) стандартные радикальные операции, при которых удаляют основную опухоль и близлежащие зоны ее метастазирования в лимфатическую систему;
2) расширенные операции, при которых увеличивается объем удаления зон регионарного метастазирования за счет смежных анатомических областей;
3) комбинированные или мультиорганные операции; в результате таких вмешательств удаляют часть органа или полностью другой орган, в которые произошла инвазия первичной опухоли.
В последние годы увеличивается доля комбинированных и расширенных операций в лечении местно-распространенных и метастатических опухолей органов грудной клетки, пищеварительного тракта, мочеполовой системы и опорно-двигательного аппарата. Это обусловлено разработкой и внедрением принципиально новых хирургических приемов. Во многом их применение стало возможным благодаря интегральному развитию анестезиологии и реанимации, а также разработке нового медицинского оборудования (CellSaver, УЗ-скальпель, LigaSure, протезы, гемостатические губки и пр.). Надо отметить, что большинство операций данной категории является практически неклассифицируемыми, требуют высочайшего класса хирургической техники и реанимационноанестезиологического обеспечения, что доступно лишь в крупных специализированных центрах. С учетом высокой заболеваемости раком желудка и частого выявления его местно-распространенных форм особенно актуальным с точки зрения современной онкохирургии является выполнение комбинированных операций - гастрэктомии с резекцией поджелудочной железы, надпочечника, поперечной ободочной кишки, диафрагмы и т.д.
Постепенно увеличивается доля расширенных и комбинированных операций в хирургии опухолей опорно-двигательного аппарата. Нами разработаны и внедрены такие методы оперативного вмешательства, как спондиллэктомия на двух уровнях и более, комбинированная резекция позвоночника и грудной стенки при
опухолях реберно-позвоночного угла, удаление злокачественных новообразований таза и крестца больших размеров с реконструкцией тазового кольца.
Объем оперативного вмешательства определяется локализацией опухоли, стадией заболевания и анатомическим типом роста. При экзофитно растущих, четко отграниченных опухолях допустимо расширение показаний к операции вплоть до комбинированных резекций. При инфильтративном характере роста опухоли расширение показаний к органосохранному оперативному лечению обычно неоправданно.
Радикальное удаление первичной опухоли должно удовлетворять принципам абластики, антибластики, зональности, футлярности.
Абластика является основным принципом радикального хирургического лечения злокачественных новообразований, заключающимся в резекции пораженного органа в пределах здоровых тканей. К основным приемам абластики относятся в первую очередь исключение грубых манипуляций с пораженными органами и тканями, острая препаровка скальпелем или электроножом, предварительное лигирование венозных сосудов, смена инструментов и перчаток после удаления опухоли перед реконструктивным этапом, тщательный гемостаз, хорошее дренирование раны в послеоперационном периоде и т.п. При адекватном выполнении этих мероприятий значительно уменьшается риск попадания опухолевых клеток в рану, их имплантация в здоровые ткани и распространение по кровеносному руслу. Однако рассеивание некоторого количества злокачественных клеток в ране может происходить, несмотря на соблюдение правил абластики, поэтому обеспечение радикализма оперативного вмешательства должно включать комплекс антибластических мер.
Антибластика представляет собой ряд мероприятий, направленных на уничтожение и удаление оставшихся в операционном поле опухолевых клеток. К ним относятся: обильное орошение и промывание раны раствором фурацилина, 3 % раствором перекиси водорода, пред-, интра- и послеоперационное облучение операционного поля.
Принцип зональности базируется на знании особенностей местного распространения опухоли и ее метастазирования в регионарные лимфатические узлы.
Операции при злокачественных опухолях различных локализаций предусматривают удаление пораженного органа и клетчатки с лимфатическими узлами в зонах регионарного метастазирования.
Лимфаденэктомией (лимфодиссекцией) называется иссечение регионарных к удаляемому органу лимфатических узлов и сосудов; данные термины на равных правах применяются в мировой литературе. Следует отметить, что термин «лимфодиссекция», являясь более емким, чем термин «лимфаденэктомия», включает моноблочное удаление не только лимфатических узлов, но и всего лимфатического аппарата (лимфатических сосудов с окружающей жировой клетчаткой) в пределах фасциальных футляров. Впервые такой подход был предложен более 100 лет назад W.S. Halsted при хирургическом лечении рака молочной железы.
Тот факт, что лимфатические узлы и сосуды служат проводником и временным барьером опухолевой генерализации, и предположение, что их раннее хирургическое иссечение может обеспечить излечение, послужили главными предпосылками к выполнению регионарных лимфаденэктомий при злокачественных опухолях разных органов.
Уже в XIX веке существовало понятие о лимфогенном метастазировании злокачественных опухолей. Это привело к осознанию необходимости удаления не только пораженного органа, но и соседних структур, несущих метастазы. Возможности радикального лечения рака определялись развитием хирургической техники и ее обеспечения.
В конце XIX века появились работы по применению лимфаденэктомии при раке шейки матки. Тогда же была разработана классическая техника расширенной экстирпации матки с придатками и принципиальной подвздошно-тазовой лимфаденэктомией.
В 1894 г. W. Halsted описал радикальную мастэктомию с иссечением регионарных подмышечных и в некоторых случаях надключичных лимфатических узлов. В 1948 г. D. Patey, W. Dyson предложили свой вариант радикальной операции, который предусматривал сохранение большой грудной мышцы. В комбинации с лучевой терапией результаты этой операции были не хуже, чем у операции W. Halsted. Вследствие значительно меньшей травматичности и лучших функциональных результатов она стала широко применяться при лечении рака молочной железы. Следующим этапом в развитии щадящих операций было предложение J. Madden в 1965 г. удалять лимфатические узлы подмышечной и межпекторальной областей с сохранением обеих грудных мышц. Если лучевую терапию дополняют сохранением мышц, это не влияет на отдаленные результаты лечения, но обеспечивает лучшие функциональные показатели и резко снижает количество отеков верхней конечности. В 70-е годы прошлого века
работы U. Veronesi позволили уменьшить объем операции без снижения ее радикальности.
В 1908 г. W. Miles впервые предложил осуществлять лимфаденэктомию в хирургии ЖКТ: он выполнял брюшно-промежностную экстирпацию прямой кишки по поводу рака en bloc с прилежащими лимфатическими узлами и клетчаткой. К.П. Сапожков в 1945 г. пропагандировал принципиальную гастрэктомию с расширенной лимфаденэктомией при раке желудка, называя ее «предельно-радикальной» операцией. Широкое выполнение расширенных лимфаденэктомий при раке желудка, имеющее характер хирургической доктрины, началось в 60-е годы XX века в Японии и затем распространилось в других странах.
В то же время широкое иссечение клетчатки с лимфатическими коллекторами достоверно увеличивает частоту осложнений. При раке молочной железы лимфодиссекция часто сопровождается длительной лимфореей, инфицированием раны, а также отеком конечности, болевыми ощущениями, утратой работоспособности, общим дискомфортом. При раке желудка расширенная лимфодиссекция увеличивает количество абсцессов в ложе удаленной селезенки, случаев панкреатита, панкреатических свищей. Все это нередко приводит к инвалидизации больных, не говоря уже об увеличении продолжительности пребывания их в стационаре и увеличении стоимости лечения. В то же время при тщательном гистологическом исследовании удаленных во время лимфодиссекции тканей часто не находят злокачественных клеток, т.е. объем операции превышает необходимый. Поэтому возникло стремление выполнять лимфодиссекцию не профилактически, а при наличии метастазов.
Концепция развития сторожевых лимфатических узлов связана с учением о лимфогенном метастазировании различных опухолей органов и тканей. Она возникла на основе новейших достижений в области анатомии и функции лимфатической системы, в частности методов исследования внеорганных путей транспорта лимфы.
Концепция сторожевых лимфатических узлов может быть объяснена упорядоченным строением путей оттока лимфы от определенных зон разных органов и перекрестным метастазированием при блокаде опухолевыми тромбами части из них - в отдаленные группы узлов. В последнем случае до известной степени нарушается принцип автономности лимфатических сегментов пораженного опухолью органа, и дренаж патологических тканей осуществляется
в разных направлениях. В нормальных условиях лимфатические сегменты до известной степени анатомически и физиологически клинически обособлены. Физиологически лимфатические сегменты - это единые образования в системе функционирования лимфатической системы (как транспортной, так и иммунологической). Клинически опухолевый процесс в одном из лимфатических сегментов органов и тканей приводит к локальным морфофункциональным изменениям лимфатических узлов или только одного узла. Одиночные метастазы в группах узлов всегда свидетельствуют об органической избирательности лимфоидных элементов в ответ на существующую злокачественную опухоль.
Одна из первых практических работ в определении направления путей лимфооттока выполнена в 1960 г. E. Gould. Он показал, что при опухолях околоушной железы метастазами в первую очередь поражается лимфатический узел в месте слияния передней и задней лицевых вен. В 1974 г. В.Ю. Янушкевич на практике при обнаружении одиночного метастаза у больных раком молочной железы отказался от расширенного варианта операции. Автор описал двух больных, которым планировалась подмышечно-грудинная мастэктомия, но применение метода хромолимфографии позволило отказаться от предполагаемого расширения границ операций.
Наряду с выявлением метастазов прижизненная окраска лимфатического аппарата помогла четко определить зоны регионарного лимфооттока, что, в свою очередь, позволило соблюдать принципы анатомической зональности и футлярности оперирования. Работу по индивидуализации объема лимфодиссекции и попытки уменьшить объем удаляемых тканей продолжил R. Cabanac, который в 1977 г. провел исследования у 100 пациентов раком полового члена. Автор, изучив данные лимфангиографии и анатомические срезы удаленной клетчатки, показал, что для рака данной локализации также существует лимфатический центр, в который в первую очередь осуществляется отток лимфы из определенного участка ткани. Этот узел получил название «sentinel lymph node» (в переводе с английского - часовой, страж). Отсюда возник перевод: «сторожевой лимфатический узел», который мы предпочитаем другому термину, иногда появляющемуся в отечественных переводах, - сигнальный узел. Именно этот узел в первую очередь поражается метастазами при раке полового члена и является как бы первым фильтром для опухолевых клеток. Этот лимфатический узел является также фильтром и для контрастных
препаратов - он в первую очередь окрашивается при введении контрастного препарата непосредственно в лимфатические пути или в ткани. В результате данный лимфатический узел хорошо визуализируется на рентгенограммах. R. Cabanac определил наиболее частую локализацию этого лимфатического узла при раке полового члена и рекомендовал его удаление и срочное гистологическое исследование для определения целесообразности дальнейшей лимфаденэктомии. Если в сторожевом лимфатическом узле метастазы не обнаруживались, дальнейшую лимфаденэктомию автор не рекомендовал. Сторожевой узел не обязательно поражается метастазами, но если у больного есть лимфогенные метастазы, то именно сторожевой узел поражается метастазами в первую очередь.
Предложенный R. Cabanac метод ангиолимфографии не получил широкого применения в практике определения сторожевых лимфатических узлов, поскольку был дорогим, технически сложным, не всегда информативным, а кроме того, не позволял во время операции определить, какой именно из нескольких лимфатических узлов является сторожевым.
Поэтому была продолжена работа по использованию красителя для контрастирования сторожевых лимфатических узлов. В 1991 г. D. Morton и соавт. опубликовали результаты экспериментальных исследований по определению эффективности различных красителей для окрашивания с целью визуализации сторожевых лимфатических узлов. Наиболее эффективным оказался краситель Isosulfan blue clue, который с того времени успешно применяется для этих целей. Сторожевые лимфатические узлы прокрашиваются через 30-60 мин после введения препарата по периферии опухоли.
Следующим шагом в развитии концепции сторожевых лимфатических узлов явились исследования J. Alex и D. Krag (1993), которые предложили методику интраоперационного определения лимфатических узлов с использованием гамма-сканера и коллоида, меченного радиоактивным технецием - 99тТе (период полураспада - 6,01 ч). Радиоактивный коллоид вводили в несколько точек вокруг опухоли за несколько часов до операции. Поиск сторожевых лимфатических узлов осуществляли с использованием гамма-камеры и портативного гамма-сканера. Авторы показали преимущества метода. Во-первых, можно определять расположение сторожевых лимфатических узлов непосредственно через кожу, в том числе и парастернальных. Во-вторых, при разрезе тканей можно в любой момент
контролировать локализацию узла и направление разреза. В-третьих, всегда можно удостовериться, что был удален действительно сторожевой лимфатический узел. В-четвертых, метод позволяет выявить остаточные лимфатическе узлы, накапливающие радиоактивный коллоид. Важным преимуществом метода является и то, что сторожевой лимфатический узел может быть удален через небольшой разрез, в отличие от использования красителя, когда нужно рассечь кожу и ткани, чтобы увидеть узел. И наконец, метод прост, легко и быстро выполним, а его чувствительность выше, чем методика с использованием красителя. Проведенные в последующем исследования показали, что наибольшая достоверность интраоперационной индикации сторожевых лимфатических узлов наблюдается при одновременном применении этих методов.
С 1993 г. стали появляться работы по применению красителя и радиоактивного коллоида при раке молочной железы, меланоме кожи, раке вульвы, полового члена, опухолях гортани, а также при раке желудка и толстой кишки.
Сторожевой лимфатический узел не обязательно является ближайшим к опухоли лимфатическим узлом. Проведенные исследования показывают, что нередко сторожевыми являются лимфатические узлы, расположенные на значительном расстоянии от опухоли. Так, D. Krag и соавт. установили, что в 11% случаев сторожевыми при раке молочной железы являются лимфатические узлы 2-3-го уровня без вовлечения узлов 1 уровня. При раке желудка метастатическое поражение лимфатических узлов 2-го уровня без вовлечения 1-го встречается в 1-13 % случаев.
К возможным неудачам при идентификации сторожевых лимфатических узлов относятся отсутствие возможности найти сторожевой узел и ложноотрицательный результат, при котором в сторожевом узле опухолевые клетки не выявляются, но при этом элементы опухоли находят в несторожевых лимфатических узлах. Поэтому с 1999 г. основное внимание исследователей посвящено двум вопросам: как успешнее найти сторожевой лимфатический узел и как избежать ложноотрицательных результатов. Существует 3 возможных объяснения получения ложноотрицательных результатов. Во-первых, это может быть следствием неточной идентификации сторожевых лимфатических узлов, удаления смежного, прилежащего несторожевого лимфатического узла и удаления 1 сторожевого лимфатического узла и более, но оставления других, содержащих метастазы. Во-вторых,
сторожевой лимфатический узел может быть обнаружен, но возможны ошибки при выявлении микрометастазов в ходе срочного гистологического исследования. Удаление такого лимфатического узла, но оставление других, с потенциально возможными микрометастазами, увеличивает риск регионарных рецидивов. В-третьих, правильно идентифицированные и по-настоящему негативные сторожевые лимфатические узлы могут быть удалены в такой стадии развития заболевания, когда опухолевые эмболы находятся между первичной опухолью и сторожевым лимфатическим узлом. При этом также увеличивается риск рецидива.
Следующий вопрос, возникающий при иссечении сторожевого лимфатического узла: «Насколько адекватно производится его срочное гистологическое исследование?» Именно неадекватностью срочного исследования главным образом обусловлены ложноотрицательные результаты (5-15 %) биопсий сторожевых лимфатических узлов. Метастаз может располагаться в любом месте лимфатического узла, и для его выявления явно недостаточно исследования 1-2 срезов со стандартным окрашиванием эозином и гематоксилином. Показано (J. Meyer), что для выявления метастаза размером 0,25 мм необходимо гистологическое исследование 8-10 срезов лимфатического узла.
Хотя при детальном исследовании лимфатических узлов, вначале считавшихся негативными, выявляют скрытые микрометастазы у 10-15 % пациентов, значение этих данных остается спорным. Самый большой отчет по исследованию частоты скрытых метастазов представлен Ludwig Breast Cancer Study Group (1990): приготовление большего количества срезов лимфатических узлов позволило выявить микрометастазы у 83 (9 %) из 921 пациентов.
На сегодняшний день применяются следующие основные виды морфологических исследований:
1) срочное морфологическое исследование сторожевых узлов (гистологическое, цитологическое, иммуногистохимическое);
2) плановое гистологическое исследование фиксированных в 10 % растворе формалина тканей с помощью окрашивания гематоксилином и эозином;
3) плановое иммуногистохимическое исследование срезов лимфатического узла с применением специфических антител;
4) плановое исследование с применением моноклональных антител.
Идеальной, с точки зрения практического онколога, является возможность использовать срочное морфологическое исследование удаленных лимфатических узлов с целью оптимизации объема выполняемого оперативного вмешательства. Однако абсолютное большинство исследователей, начиная с D. Morton, на значительном клиническом материале показывают, что частота ложноотрицательных заключений при выполнении срочного исследования замороженных срезов может достигать 60 %. Средняя чувствительность метода составляет, по разным источникам, от 33 до 38 %. Это отнюдь не является противопоказанием к выполнению данного исследования непосредственно во время операции, однако требует критической оценки.
Выполнение планового гистологического исследования фиксированных срезов с использованием окрашивания гематоксилином и эозином тканей лимфатического узла также должно выполняться по определенным правилам, чтобы получить максимально достоверную информацию о состоянии исследуемого материала. Выше мы приводили данные, полученные при дополнительном гистологическом исследовании лимфатических узлов у пациентов с полной лимфодиссекцией. Процент пропущенных лимфатических узлов, пораженных микрометастазами, достигал, по данным некоторых авторов, 22 %. В этой связи авторы методики поиска сторожевых лимфатических узлов рекомендуют серийное гистологическое исследование сторожевых лимфатических узлов. При этом производят срезы толщиной 4 мкм на расстоянии 500 мкм друг от друга (в среднем с 1 лимфатического узла получается 9-10 срезов). Препараты фиксируют 10 % раствором формалина и окрашивают гематоксилином и эозином. Эти же срезы подвергают иммуногистохимическому исследованию. Описывая найденные указанным способом метастазы в лимфатических узлах, G. Carlson выделяет следующие их типы по объему поражения: макрометастаз (>2 мм), микрометастаз (<2 мм), метастазы в виде групп клеток, расположенных в расширенных синусах (до 10-20 групп), метастазы в виде отдельных изолированных клеток, расположенных в синусах лимфатического узла (от 1 до 20 клеток). Изучив гистологическое строение 134 сторожевых и несторожевых лимфатических узлов, полученных у 104 больных с меланомой при полной лимфодиссекции, он пришел к выводу, что макрометастазы чаще выявляются в несторожевых лимфатических узлах, тогда как все прочие метастатические типы (микрометастазы) - в сторожевых
и составляют около 77 %. Для их адекватной диагностики автор рекомендует параллельное серийное гистологическое и иммуногистохимическое исследование. Сравнивая значимость обычного и серийного гистологических исследований сторожевых лимфатических узлов, автор приводит сведения о расхождениях в диагнозе при применении данных методик в клинических условиях, достигающих 14 и даже 20 % частоты.
В настоящее время методика гистологического изучения сторожевых лимфатических узлов является стандартной. Во время операции производят срочное гистологическое исследование половины удаленного лимфатического узла (либо пополам рассекаются все найденные лимфатические узлы), оставшуюся половину отсылают на плановое серийное исследование. Иммуногистохимическое исследование проводится, если при серийном гистологическом исследовании метастазов в лимфатических узлах не выявлено. В среднем выявляемость микрометастазов в сторожевых лимфатических узлах, по данным комплексных исследований, составляет от 10 до 17 %.
Принцип футлярности предполагает удаление опухоли в едином блоке со всеми анатомическими структурами фасциального футляра, в котором она находится. Соблюдение этого принципа особенно важно при удалении сарком мягких тканей, распространяющихся преимущественно вдоль фасций, которые выполняют функцию естественных барьеров для опухоли.
Паллиативные операции не удовлетворяют всем требованиям радикального удаления опухоли, после их выполнения в организме больного остаются неликвидированные очаги опухоли. Основной целью паллиативных операций являются предотвращение тяжелых осложнений опухолевого процесса (перфорации полого органа, стеноза его просвета, кровотечения из опухоли или магистральных сосудов) и улучшение качества жизни больного. В ряде случаев данный метод хирургического лечения сопровождается увеличением продолжительности жизни. Паллиативные операции могут быть циторедуктивными и симптоматическими.
Циторедуктивные операции обеспечивают относительно полную или частичную циторедукцию, что позволяет в дальнейшем проводить адъювантное лучевое или лекарственное лечение.
Симптоматические операции представляют собой хирургические вмешательства, при которых не предпринимаются попытки воздействовать на опухолевый процесс. Эти операции выполняют с целью
устранения того или иного ведущего патологического симптома, зачастую представляющего непосредственную угрозу жизни больного (непроходимость ЖКТ, кровотечение из опухоли и др.).
Развитие онкохирургии привело к переосмыслению проблемы паллиативных операций. Операция считается паллиативной, если резекция пораженных органов выполнена с оставлением части опухоли на соседних анатомических структурах, включая опухолевые клетки по линии резекции. Аналогичной оценке подлежит операция, при которой резекция первичного очага производится без удаления регионарных лимфогенных метастазов или при удалении первичной опухоли с отдаленными метастазами (вариант циторедуктивной операции).
С современных позиций основной смысл выполнения паллиативных вмешательств заключается в профилактике фатальных осложнений и улучшении качества жизни.
Кроме того, паллиативные операции с циторедуктивной целью на сегодняшний день являются неотъемлемой частью стратегии лечения распространенного колоректального рака и других опухолей, открывая перспективу для проведения дополнительного специализированного лечения, направленного на улучшение отдаленных результатов.
В последние годы при нерезектабельных опухолях пищевода и кардиоэзофагеальной зоны оправданным считается отказ от выполнения таких функционально и морально устаревших вмешательств, как гастростомия и еюностомия.
В зависимости от распространения опухоли по пищеводу и желудку для устранения основного симптома заболевания - дисфагии и восстановления естественного пассажа пищи по пищеварительному тракту целесообразно выполнение разработанных и широко применяющихся в клинике шунтирующих операций, значительно улучшающих качество жизни больных. Следует отметить, что, несмотря на деонтологическую привлекательность, обходные анастомозы можно применять только при условии надежности основного и самого сложного этапа вмешательства - формирования пищеводного соустья, поскольку главным условием выполнения шунтирующих операций является низкая послеоперационная летальность.
К одним из наиболее тяжелых осложнений метастатического поражения позвоночника относятся развитие компрессии спинного мозга и появление соответствующей неврологической симптоматики.
Разработаны и внедрены серии паллиативных хирургических методик, позволяющих достоверно улучшить качество жизни данной категории больных, включая декомпрессивные вмешательства на разных уровнях позвоночника.
Также активно применяется малоинвазивный метод чрескожной вертебропластики.
Органосохраняющие операции
Радикальное хирургическое лечение злокачественных новообразований на ранних стадиях позволяет в большинстве случаев добиться прекрасных результатов. Кроме того, небольшой объем опухоли дает возможность применять менее агрессивный, чем стандартный хирургический подход, без ущерба для выживаемости. В связи с этим на фоне повышения интереса к вопросам сохранения и поддержания удовлетворительного качества жизни онкологических больных постепенно увеличивается доля органосохраняющих операций в хирургии опухолей молочной железы, мягких тканей и опорно-двигательного аппарата, опухолей почки и др.
В хирургии опухолей бронхов в настоящее время активно развиваются ангиобронхопластические операции с выполнением адекватного объема внутрилегочной и медиастинальной лимфодиссекции.
При этом не отмечено снижения выживаемости пациентов, по сравнению с показателем у больных, перенесших стандартные хирургические вмешательства.
В настоящее время разрабатываются методика и техника так называемых спленосохранных операций - гастрэктомии с выполнением полной диссекции ворот селезенки, которую мы считаем равноценной объему D2.
Предварительные результаты показывают, что спленосохранные операции улучшают непосредственные результаты лечения и качество жизни больных без ущерба онкологическому радикализму.
Прослеживается тенденция к снижению доли калечащих операций, выполняемых при опухолях костей и мягких тканей.
Одно из наиболее перспективных направлений данного раздела онкохирургии - разработка технологии широкой резекции и удаления en bloc местно-распространенных опухолей костей и мягких тканей с последующей пластикой магистральных сосудов, нервных стволов и замещением дефекта протезами костей и (или) мягкоткаными лоскутами на микрососудистых анастомозах.
Для выполнения подобных операций необходимы индивидуально подобранные расходные материалы (протезы), специальное оборудование (операционный микроскоп, микрохирургические инструменты) и владение микрохирургической техникой. Выживаемость пациентов после хирургического лечения данного объема не уступает таковой в группе больных, перенесших калечащее лечение, при несоизмеримо лучшем качестве жизни.
Интересным направлением органосохраняющего лечения в онкологии является экстракорпоральная резекция органов. Лечение больных двусторонним раком почки, а также пациентов с единственной функционирующей почкой или заболеванием контралатеральной почки остается серьезной проблемой. Как правило, на стороне большего поражения выполняется нефрэктомия. Однако при наличии нескольких опухолевых узлов или центральной локализации опухоли возможности органосохраняющего хирургического лечения на контралатеральной стороне могут быть резко ограничены. У данной категории пациентов единственным вариантом лечения, позволяющим избежать выполнения двусторонней нефрэктомии с последующим проведением программного гемодиализа, является методика экстракорпоральной резекции почки.
Данный метод подразумевает выполнение нефрэктомии с последующей резекцией почки в условиях холодовой ишемии и ее гетеротопическую аутотрансплантацию в контралатеральную подвздошную область. Непосредственные, отдаленные и функциональные результаты при сроках наблюдения от 10 до 27 мес удовлетворительные.
Экстракорпоральную резекцию печени - процедуру технически и методологически более сложную, выполняют при множественных билобарных метастазах карциноидных и некоторых других опухолей. Разработана также методика так называемых ex-situ резекций печени, когда печень мобилизуется в кавальных воротах без пересечения элементов гепатодуоденальной связки.
Важным направлением онкохирургии является удаление опухолей брюшной полости и забрюшинного пространства с резекцией и протезированием магистральных сосудов. Нами накоплен опыт оперативных вмешательств в объеме удаления опухоли с резекцией и протезированием нижней полой вены (НПВ), удаления опухоли с протезированием инфраренального отдела аорты, комбинированных операций с протезированием подвздошных сосудов. С хорошими отдаленными результатами проводятся операции по поводу
местно-распространенного рака поджелудочной железы в объеме гастропанкреатодуоденальной резекции с пластикой верхней брыжеечной вены.
Довольно распространенным показанием к аналогичным операциям является рак почки, осложнившийся развитием опухолевого тромба, распространяющегося по просвету почечной вены и НПВ вплоть до правых отделов сердца (4-10 % случаев).
Хирургическое удаление опухолевого тромба с пораженной почкой является единственным методом лечения, дающим шанс на выздоровление и продление жизни большинству больных. Наибольшую техническую сложность представляет удаление наддиафрагмальных тромбов.
При больших размерах внутрипредсердного компонента опухоли и ее фиксации к интиме резекция НПВ и тромбэктомия выполняются с использованием кардиопульмонального шунтирования, которое, снижая риск эмболических осложнений, значительно увеличивает объем и травматичность операции, повышает риск коагулопатических кровотечений из-за системной гепаринизации.
С целью снижения частоты осложнений, ассоциированных с применением искусственного кровообращения (ИК), нами разработан трансдиафрагмальный доступ к внутриперикардиальному отделу НПВ, позволяющий быстро и безопасно удалять флоттирующие опухолевые тромбы из правого предсердия; 5-летняя выживаемость пациентов без отдаленных метастазов после радикальной нефрэктомии с тромбэктомией составляет 47-64 %.
Ранее врастание опухолевых масс в стенку НПВ на значительном протяжении, не позволяющее выполнить ее резекцию с сохранением просвета сосуда, являлось абсолютным противопоказанием к операции. В РОНЦ им. Н.Н. Блохина РАМН разработана и внедрена в клиническую практику методика нефрэктомии, тромбэктомии, кавэктомии, предлагающая удаление почки единым блоком с опухолевым тромбом и отделом НПВ, проращенным опухолью, и позволяющая излечивать данную категорию пациентов.
При опухолях правой почки возможно удаление всей НПВ, включая зону устья левой почечной вены, так как отток от левой почки может осуществляться по яичковой (яичниковой) и надпочечниковой венам. При опухолях левой почки резекция области устья правой почечной вены невозможна в связи с отсутствием у последней венозных коллатералей.
Непосредственные и ближайшие результаты кавэктомии удовлетворительные. В случае исходно сохраненного кровотока по НПВ, а также при недостаточно развитых венозных коллатералях оправдано выполнение кавэктомии с последующим протезированием НПВ. Хирургическое вмешательство данного объема выполнено в Центре трем пациентам; непосредственные и ближайшие результаты удовлетворительные.
В ряде случаев циркулярная резекция НПВ и (или) аорты с протезированием требуется при выполнении забрюшинной лимфаденэктомии после индукционной химиотерапии при раке яичка с ретроперитонеальными метастазами, а также первичных и рецидивных неорганных забрюшинных опухолях.
Расширенные хирургические пособия позволили улучшить онкологические результаты лечения этой категории больных, которые еще недавно считались неоперабельными. Таким образом, хирургическое вмешательство - один из наиболее эффективных методов лечения злокачественных новообразований.
Залогом достижения удовлетворительных результатов является рациональное определение показаний, сроков и объема операции, основанное на правильной верификации диагноза и адекватном стадировании опухолевого процесса, а также соблюдении основных принципов онкохирургии, к которым относятся:
1) онкологическая адекватность: мобилизация «острым путем» по принципу «от сосуда к пораженному органу», правильная последовательность мобилизации с целью профилактики интраоперационной диссеминации опухолевых клеток, профилактический принцип моноблочной лимфодиссекции;
2) максимальная безопасность: правильный выбор оперативного доступа и объема хирургического вмешательства, рациональные приемы мобилизации и обработки смежных органов, формирование надежных анастомозов;
3) высокая функциональность: выбор рационального метода пластики, формирование технически простых антирефлюксных анастомозов.
Внедрение новых хирургических технологий (См рис.), с одной стороны, позволило расширить спектр показаний к выполнению органосохраняющих вмешательств в онкологии, с другой - увеличить долю радикальных операций при местно-распространенных и метастатических злокачественных новообразованиях,

 Рис. Принцип работы роботизированной хирургической установки
Рис. Принцип работы роботизированной хирургической установки
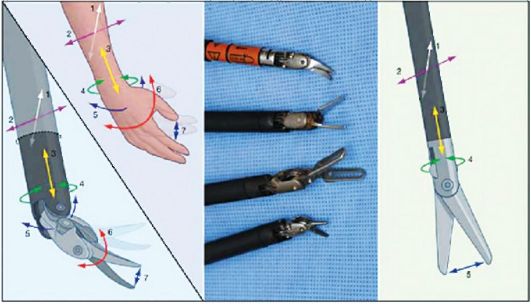 Рис. Инструменты роботизированной хирургической установки
Рис. Инструменты роботизированной хирургической установки
 Рис. Роботизированная хирургическая установка выполняет оперативное вмешательство (а, б)
Рис. Роботизированная хирургическая установка выполняет оперативное вмешательство (а, б)
ранее считавшихся неоперабельными. Разработка новых реконструктивных методов, а также оперативных подходов к паллиативной помощи больным с распространенными опухолями дала возможность существенно улучшить качество жизни данной категории пациентов.
Важный этап в обеспечении хороших послеоперационных результатов - скоординированная работа мультидисциплинарной бригады высококлассных специалистов (рис. 7.8), включающей
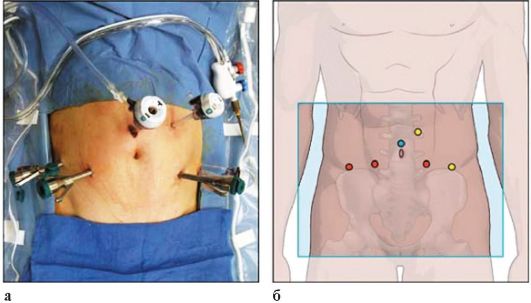 Рис. Доступы при выполнения оперативных вмешательств с помощью роботизированной хирургической установки (а, б)
Рис. Доступы при выполнения оперативных вмешательств с помощью роботизированной хирургической установки (а, б)
 Рис. Лапароскопическая операция
Рис. Лапароскопическая операция
анестезиолога, хирурга и реаниматолога. Кроме того, лечение половины больных со злокачественными новообразованиями требует комплексного подхода с привлечением специалистов в области системной цитотоксической и лучевой терапии. Таким образом, адекватное современное лечение онкологических больных возможно только в крупных специализированных центрах и не должно осуществляться в клиниках общего профиля.
 Рис. 7Современные протезы (а-е)
Рис. 7Современные протезы (а-е)
 Рис. Хирургическая бригада выполняет операцию по поводу колоректального рака
Рис. Хирургическая бригада выполняет операцию по поводу колоректального рака
Дата добавления: 2021-04-06; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
