Выражение для константы равновесия реакции, протекающей в идеальных растворах
Закон действующих масс.
Кинетический вывод (Гульберг и Вааге, 1867г.)
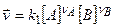 ,
, 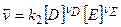 ,
,

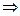

 ,
, 
4. Оценка химического равновесия по величине 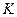 :
: 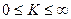
а) 
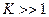
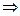 необратимая реакция, идет до конца
необратимая реакция, идет до конца
б) 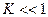
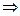 практически не идет
практически не идет
Другие характеристики химического равновесия
а) степень превращения исходного вещества
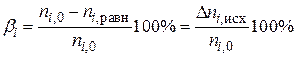
б) равновесный выход продукта
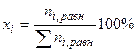
в) степень диссоциации (реакции термического разложения, (диссоциации): 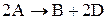
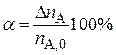
г) химическая переменная (глубина протекания р-ции, 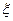 )
)
II. Химическая переменная (степень продвижения реакции)
1. Изменения количества реагирующих веществ в ходе реакции не независимы, но взаимосвязаны между собой. И эта связь определяется уравнением химической реакции (ур-ние реакции).
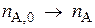 ,
, 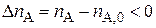
 ,
, 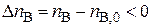
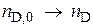 ,
, 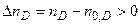
 ,
, 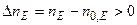
Тогда: 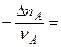

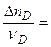
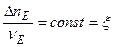
Или в общем случае, 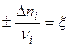 или
или  , где стехиометрическим коэффициентам исходных в-ств приписан знак “+”, а продуктов “-“.
, где стехиометрическим коэффициентам исходных в-ств приписан знак “+”, а продуктов “-“.
2. Химическая переменная - показывает (в эквивалентных количествах, долях к стехиометрическому) изменение количества каждого реагента в ходе реакции к данному моменту времени
3. Число пробегов реакции,
а) 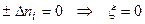 ;
;
б)один пробег реакции: 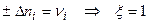 ,
, 
в) пример: 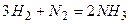 , пусть
, пусть  , тогда
, тогда 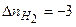 ,
, 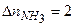
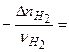

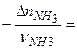
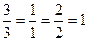 ,
, 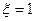
III. Термодинамический вывод закона действующих масс
1. Условие равновесия для химической реакции

1) Для систем переменного состава при 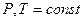 :
:
|
|
|
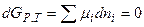

2) Химическая переменная, 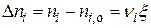
Дифференцируем и получаем : 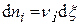
3) Подставляя в приведенное выше уравнение, имеем: 
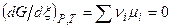 ,
,
Полученное выражение в общей форме выражает условие химического равновесия
4) Откуда для 1-го пробега реакции в присутствии б/б количества реагентов 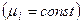 :
:
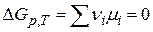 .
.
Вывод уравнения, реагенты – идеальные газы
а)  , где
, где 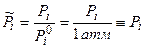 ,атм
,атм
б) 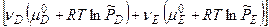 -
- 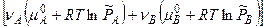
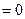
[ 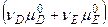 -
-  ]+
]+ 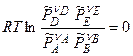
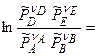
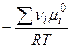
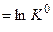
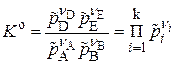 ,
,
 - стандартная константа равновесия (безразмерная вел-на)
- стандартная константа равновесия (безразмерная вел-на)

 , т.к.
, т.к. 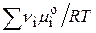
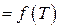
в) Эмпирическая константа равновесия
1)  ,
, 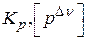 – размерная величина,
– размерная величина,
где 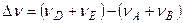
2) 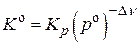
3)  , если
, если 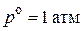 , а
, а 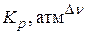
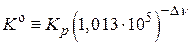 , если
, если 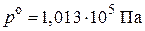 , а
, а 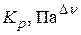
IV. Способы выражения состава равновесной смеси.
Связь между эмпирическими константами равновесия, выраженными различными способами
1. Связь 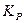 и
и 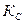
а) K, выраженная через парциальные давления, 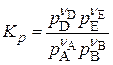
б) K , выраженная через концентрации,
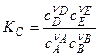

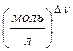
в) связь  и
и 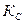 :
:
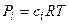
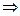
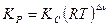 , где:
, где: 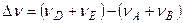
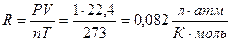 , если
, если  , а концентрация,
, а концентрация, 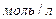
2. Связь  и
и 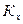
а) К, выраженная через мольные доли,
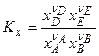
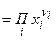
б) связь  и
и 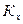 :
: 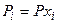
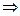
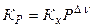
V. Связь т/д константы равновесия с эмпирическими константами равновесия (случай идеальной газовой смеси)
|
|
|
1. 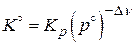 ,
,  ,
, 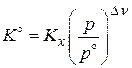 ,
,
2.  , если
, если 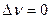
VI. Влияние общего давления и примеси инертного газа на равновесный выход продуктов реакции.
Влияние давления на смещение химического равновесия.
а) вывод соотношения, связывающего 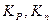 и
и 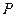 :
:
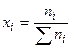
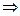

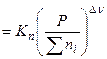
б) 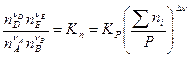
в) анализ этого уравнения:
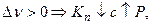

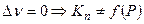
Влияние примесей постороннего газа
а) вывод соотношения, включаюшего 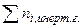 :
:
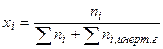
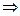
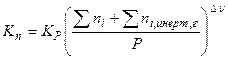
б) анализ уравнения при наличии примеси:
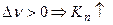
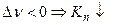
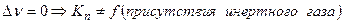
(т.о. разбавление реакционной смеси инертным газом равносильно снижению общего давления)
VII . Константа хим. равновесия. Случай реальной газовой смеси.
1. Зависимость 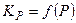 для реакции синтеза аммиака
для реакции синтеза аммиака  :
:
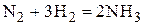
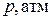
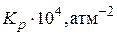

| 1 10 50 100 300
65,3 65,9 68,1 72,8 88,2  65,3 65,3 65,7 65,7 66,2
65,3 65,3 65,7 65,7 66,2 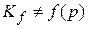
|
2. Необходимость использовать фугитивность ( 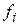 ) вместо
) вместо 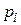 :
:
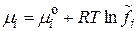 , где
, где 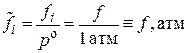
3. Выражение для Kf
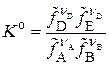
 , где
, где 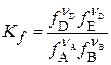
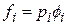 ,
, 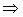
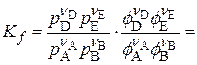
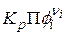 ,
,
где  ,
,  но
но 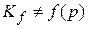
VШ. Реакции в растворах
Выражение для константы равновесия реакции, протекающей в идеальных растворах
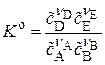 , где
, где 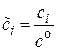 ,
, 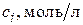 ,
, 
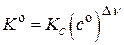 , где
, где 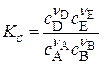
Дата добавления: 2021-04-05; просмотров: 127; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
