Химическая формула, как отображение химического состава
Состав вещества, измерение вещества.
Химический состав – это совокупность компонентов, из которых состоит вещество (или смесь веществ). В зависимости от природы вещества, под компонентами могут подразумеваться различные структурные единицы вещества:
· химические элементы,
· химические соединения,
· ионы,
· радикалы,
· изотопы,
· функциональные группы,
· группы и классы веществ, обладающими определенными свойствами.
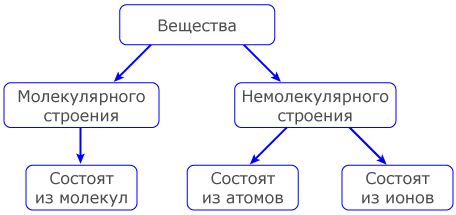
Согласно атомно-молекулярному учению, наименьшими структурными единицами веществ являются атомы, молекулы и ионы.
Из атомов состоят:
· все металлы;
· многие неметаллы (инертные газы, C, Si, B, Se, As, Te).
Из молекул состоят:
· практически все органические вещества;
· небольшое число неорганических: простые и сложные газы (H 2, O 2, O 3, N 2, F 2, Cl 2, NH 3, CO, CO 2, SO 3, SO 2, N 2 O, NO, NO 2, H 2 S), а также H 2 O, Br 2, I 2 и некоторые другие вещества.
Из ионов состоят:
· все соли;
· многие гидроксиды (основания и кислоты).
Простые вещества состоят из атомов или молекул, сложные – из молекул или ионов. Молекулы простых веществ состоят из одинаковых атомов, молекулы сложных веществ – из различных атомов.
Закон постоянства состава
Закон постоянства состава был открыт Ж. Прустом в 1801 году:
Всякое вещество, независимо от способа его получения, имеет постоянный качественный и количественный состав.
К примеру, оксид углерода СО 2 можно получить несколькими способами:
|
|
|
· С + O 2 = t = CO 2
· MgCO 3 +2HCl = MgCl 2 + H 2 O +CO 2
· 2CO + O 2 = 2CO 2
· CaCO 3 = t = CaO + CO 2
Однако, независимо от способа получения, молекула СО 2 всегда имеет один и тот же состав: 1 атом углерода и 2 атома кислорода.
Важно помнить:
· Обратное утверждение, что определенному составу отвечает определенное соединение, неверно. К примеру, диметиловый эфир и этиловый спирт имеют одинаковый качественный и количественный состав, отраженный в простейшей формуле С 2 Н 6 О, однако они являются различными веществами, так как имеют различное строение. Их рациональные формулы в полуразвернутом виде будут разными:
1. СН 3 – О – СН 3 (диметиловый эфир);
2. СН 3 – СН 2 – ОН (этиловый спирт).
· Закон постоянства состава строго применим лишь к соединениям с молекулярной структурой (дальтонидам). Соединения с немолекулярной структурой (бертоллиды) часто имеют переменный состав.
Химический состав по массе и по объему
Состав химических соединений, а также состав смесей различных веществ и растворов выражают в массовых долях (массовых %), а состав смесей жидкостей и газов, кроме того, в объемных долях (объемных %).
Состав сложного вещества, выраженный через массовые доли химических элементов, называется составом вещества по массе.
|
|
|
Например, состав Н 2 О по массе: 
То есть, можно сказать, что химический состав воды (по массе): 11,11% водорода и 88,89% кислорода.
Массовая доля компонента в механической смеси (W) – это число, показывающую, какую часть смеси составляет масса компонента от общей массы смеси, принятой за единицу или 100%.
W 1 = m 1 /m (c м .) , m ( см .) = m 1 + m 2 + …. mn,
Где m 1 – масса 1-го (произвольного)компонента, n – число компонентов смеси, m 1 … m n – массы компонентов, образующих смесь, m (cм.) – масса смеси.
Например, массовая доля основного компонента:
W (осн. комп) = m (осн. комп) /m (см.)
Массовая доля примеси:
W (прим.) = m (прим) /m (см.)
Сумма массовых долей всех компонентов, образующих смесь равна 1 или 100% .
Объемная доля газа (или жидкости) в смеси газов (или жидкостей) – это число, показывающее, какую часть по объему составляет объем данного газа (или жидкости) от общего объема смеси, принятого за 1 или за 100%.
Состав смеси газов или жидкостей, выраженный в объемных долях, называется составом смеси по объему.
Например, состав смеси сухого воздуха :
· По объему: W об (N2) = 78,1% , W об (O2) = 20,9%
· По массе: W (N2) = 75,5% , W (O2) = 23,1%
|
|
|
Этот пример наглядно демонстрирует, что во избежание путаницы, корректно будет всегда указывать, по массе или по объему указано содержание компонента смеси, ведь эти цифры всегда отличаются: по массе в воздушной смеси кислорода получается 23,1 %, а по объему – всего 20,9%.
Растворы можно рассматривать как смеси из растворенного вещества и растворителя. Поэтому их химический состав, как и состав любой смеси, можно выражать в массовых долях компонентов:
W (раств. в-ва) = m (раств. в-ва) /m (р-ра) ,
где
m (р-ра) = m (раств. в-ва) + m (растворителя)
или
m (р-ра) = p (р-ра)· V (р-ра)
Состав раствора, выраженный через массовую долю растворенного вещества (в %), называется процентной концентрацией этого раствора.
Состав растворов жидкостей в жидкостях (например, спирта в воде, ацетона в воде) удобнее выражать в объемных долях:
W об %(раств. ж) = V (раств.ж) · V (р-ра) ·100%;
где
V (р-ра) = m (р-ра) /p (р-ра)
или приближенно
V (р-ра) ≈ V (H2O) + V (раств. ж)
Например, содержание спирта в винно-водочных изделиях указывают не в массовых, а в объемных долях (%) и называют эту цифру крепостью напитка.
Состав растворов твердых веществ в жидкостях или газов в жидкостях в объемных долях не выражают.
Химическая формула, как отображение химического состава
|
|
|
Качественный и количественный состав вещества отображают с помощью химической формулы. К примеру, карбонат кальция имеет химическую формулу « CaCO 3 ». Из этой записи можно почерпнуть следующую информацию:
· Количество молекул – 1.
· Количество вещества – 1 моль.
· Качественный состав (какие химические элементы образуют вещество) – кальций, углерод, кислород.
· Количественный состав вещества:
1. Число атомов каждого элемента в одной молекуле вещества: молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода.
2. Число молей каждого элемента в 1 моле вещества:В 1 моль СаСО 3 (6,02 ·1023 молекулах) содержится 1 моль (6,02 ·10 23 атомов) кальция, 1 моль (6,02 ·10 23 атомов) углерода и 3 моль (3·6,02·10 23 атомов) химического элемента кислорода)
· Массовый состав вещества:
1. Масса каждого элемента в 1 моле вещества: 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода.
2. Массовые доли химических элементов в веществе(состав вещества в процентах по массе):
W (Ca) = (n (Ca) ·Ar (Ca) )/Mr (CaCO3) = (1·40)/100= 0,4 (40%)
W (C) = (n (Ca) ·Ar (Ca) )/Mr (CaCO3) = (1·12)/100= 0,12 (12%)
W ( О ) = (n (Ca) ·Ar (Ca) )/Mr (CaCO3) = (3·16)/100= 0,48 (48%)
· Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества:
1. Молекула СаСО 3 состоит из иона Са 2+ и иона СО 3 2-
2. 1 моль СаСО 3 содержит 1 моль ионов Са 2+и 1 моль ионов СО 3 2-;
3. 1 моль (100г) карбоната кальция содержит 40г ионов Са 2+ и 60г ионов СО 3 2- .
Строение веществ в виде схемы:
Дата добавления: 2021-07-19; просмотров: 56; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
