Номенклатура и изомерия алкенов
Алканы
Алканы (парафины) - насыщенные углеводороды, имеющие линейное или разветвленное строение, содержащие только простые связи. Относятся к алифатическим углеводородам, так как не содержат ароматических связей.
Алканы являются насыщенными соединениями - содержат максимально возможное число атомов водорода. Общая формула их гомологического ряда - CnH2n+2.
Номенклатура алканов
Номенклатура (от лат. nomen - имя + calare - созывать) - совокупность названий индивидуальных химических веществ, а также правила составления этих названий. Названия у алканов формируются путем добавления суффикса "ан": метан, этан, пропан, бутан и т.д.

Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Перечисленные выше алканы, являются по отношению друг к другу гомологами, то есть составляют один гомологический ряд (греч. homólogos - соответственный).
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
- В структурной формуле вещества необходимо выбрать самую длинную (пусть и изогнутую на рисунке!) цепь атомов углерода
- Атомы выбранной цепи нумеруют, начиная с того конца, к которому ближе разветвление (радикал)
- В начале название перечисляют радикалы и другие заместители с указанием номеров атомов углерода, с которыми они связаны. Если в молекуле имеется несколько одинаковых радикалов, то цифрой указывают нахождение каждого из них в главной цепи и перед их названием соответственно ставят частицы ди-, три-, тетра- и т.д.
- Основой названия служит наименование предельного углеводорода с тем же количеством атомов углерода, что и в главной цепи
Внимательно изучите составленные для различных веществ названия ниже.

В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.

Изомерами (греч. isomeros - составленный из равных частей) называют вещества, имеющие одну молекулярную формулу, но отличающиеся по строению (структурная изомерия) или расположению атомов в пространстве (пространственная изомерия).
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.

В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.

Некоторые данные, касающиеся алканов, надо выучить:
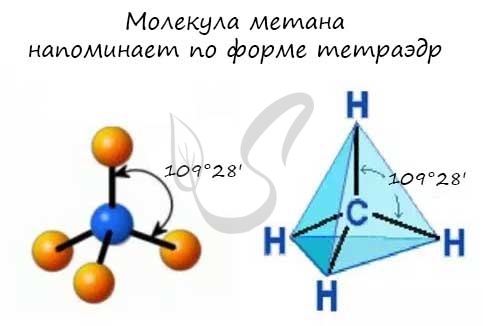
- В молекулах алканов присутствуют одиночные сигма-связи (σ-связи), длина которых составляет 0,154 нм
- Тип гибридизации атомов углерода - sp3
- Валентный угол (между химическими связями) составляет 109°28'
Природный газ и нефть
Алканы входят в состав природного газа: метан 80-97%, этан 0.5-4%, пропан 0.2-1.5% , бутан 0.1-1%, пентан 0-1%. Состав нефти нельзя выразить одной формулой, он непостоянен и зависит от месторождения.
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В промышленности алканы получают путем:
- Крекинга нефти
В ходе крекинга нефти получается один алкан и один алкен.
C8H18 → C4H8 + C4H10
C12H26 → C6H12 + C6H14
- Гидрогенизацией угля (торфа, сланца)
C + H2 → (t, p) CH4
- Гидрированием оксида углерода II
CO + H2 → (t, p, кат.) CH4 + H2O
В лабораторных условиях алканы получают следующими способами:
- Синтез Дюма
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.

- Реакция Вюрца
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.

- Синтез Кольбе
В результате электролиза солей карбоновых кислот может происходить образование алканов.

- Разложение карбида алюминия
В результате разложения карбида алюминия образуется метан и гидроксид алюминия.
Al4C3 + 12H2O → 3CH4 + 4Al(OH)3
- Гидрированием ненасыщенных углеводородов
CH3-CH=CH2 + H2 → (t, p, Ni) CH3-CH2-CH3
CH2=CH2 + H2 → (t, p, Ni) CH3-CH3
Химические свойства алканов
Алканы - насыщенные углеводороды, не вступают в реакции гидрирования (присоединения водорода), гидратации (присоединения воды). Для алканов характерны реакции замещения, а не присоединения.
1. Галогенирование
Атом галогена замещает атом водорода в молекуле алкана. Запомните, что легче всего идет замещение у третичного атома углерода, чуть труднее - у вторичного и значительно труднее - у первичного.

Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.

- Нитрование (реакция Коновалова)
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
CH3-CH3 + HNO3(разб.) → CH3-CH2-NO2 + H2O
Для удобства и более глубокого понимания, азотную кислоту - HNO3 - можно представить как HO-NO2.

- Окисление
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
С3H8 + O2 → CO2 + H2O
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
CH4 + O2 → CH3-OH (метанол)

- Пиролиз
Пиролиз (греч. πῦρ - огонь + λύσις - разложение) - термическое разложение неорганических и органических соединений. Принципиальное отличие пиролиза от горения - в отсутствии кислорода.
CH4 → (t > 1000°С) C + H2
CH4 → (t = 1500-1600°С) CH≡CH + H2↑
CH4 → (t = 1200°С, кат., P) CH2=CH2 + H2↑
C2H6 → (t = 1200°С, кат., P) CH2=CH2 + 2H2↑
- Изомеризация
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.

- Крекинг
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
C8H18 → (t) C4H10 + C4H8
C14H30 → (t) C7H14 + C7H16
Алкены
Алкены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле одну двойную связь С=С. Такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкены также называют этиленовыми углеводородами, по первому члену гомологического ряда - этилену - CH2=CH2. Общая формула их гомологического ряда - CnH2n.
Номенклатура и изомерия алкенов
Названия алкенов формируются путем добавления суффикса "ен" к названию алкана с соответствующим числом: этен, пропен, бутен, пентен и т.д.
При составлении названия алкена важно учесть, что главная цепь атомов углерода должна обязательно содержать двойную связь. Принято начинать нумерацию атомов углерода с того края, к которому ближе двойная связь. В конце названия указывают атом углерода, у которого начинается двойная связь.

Атомы углерода, прилежащие к двойной связи находятся в sp2 гибридизации.
Для алкенов характерна изомерия углеродного скелета, положения двойной связи, межклассовая изомерия с циклоалканами и пространственная геометрическая изомерия в виде существования цис- и транс-изомеров.

Некоторые данные, касающиеся алкены, надо выучить:
- Длина связи между атомами углерода составляет 0,134 нм
- Тип гибридизации атомов углерода (прилежащих к двойной связи) - sp2
- Валентный угол (между химическими связями) составляет 120°
Получение алкенов
Алкены получают несколькими способами:
- Крекинг нефти
В результате крекинга нефти образуется один алкан и один алкен.
C12H26 → C6H12 + C6H14
- Дегидрирование алканов
При наличии катализатора и повышенной температуры от молекул алканов отщепляется водород. Наиболее легко водород отдает третичный атом, чуть труднее - вторичный и заметно труднее - первичный.
CH3-CH3 → (t, кат) CH2=CH2 + H2

- Дегидрогалогенирование галогеналканов
В реакции галогеналкана со спиртовым(!) раствором щелочи образуется алкен. По правилу Зайцева, водород отщепляется от соседнего наименее гидрированного атома углерода.

- Дегалогенирование дигалогеналканов
В подобных реакциях применяется цинк (цинковая пыль) - двухвалентный металл, который связывает расположенные рядом атомы галогенов. Между атомами углерода, которым принадлежали галогены, завязывается двойная связь.

- Внутримолекулярная дегидратация спиртов
При нагревании спиртов c серной кислотой - H2SO4, обладающей выраженными водоотнимающими свойствами, происходит отщепление воды от спирта по правилу Зайцева. В результате образуется алкен.
Внутримолекулярная дегидратация спиртов происходит при t > 140 °C.

Химические свойства алкенов
Алкены - ненасыщенные углеводороды, охотно вступающие в реакции присоединения. Реакции замещения для них не характерны.
- Гидрирование
Водород присоединяется к атомам углерода, образующим двойную связь. Пи-связь (π-связь) рвется, остается единичная сигма-связь (σ-связь).

- Галогенирование
Реакция с бромной водой является качественной для непредельных соединений, содержащих двойные (и тройные) связи. В ходе такой реакции бромная вода обесцвечивается, что указывает на присоединение его по кратным связям к органическому веществу.
Реакция с хлором на свету протекает по свободнорадикальному механизму, так как на свету молекулы хлора расщепляются, образуя свободные радикалы.

- Гидрогалогенирование
Алкены вступают в реакции гидрогалогенирования, протекающие по типу присоединения.
Гидрогалогенирование протекает по правилу Марковникова, в соответствии с которым атом водорода присоединяется к наиболее гидрированному, а атом галогена - к наименее гидрированному атому углерода.

- Гидратация
Присоединение воды, гидратация, происходит по правилу Марковникова. Водород присоединяется к наиболее гидрированному атому углерода, гидроксогруппа - к наименее гидрированному.

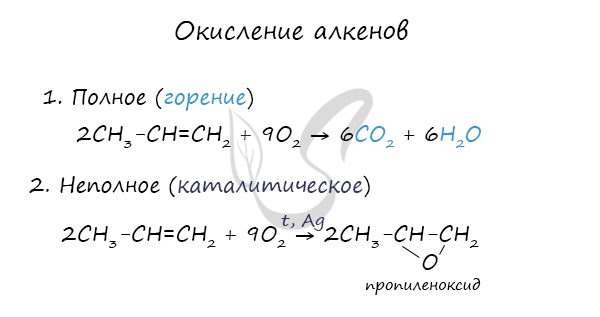
- Окисление
При горении алкены, как и все органические соединения, сгорают с образованием углекислого газа и воды - полное окисление. При неполном окислении образуются окиси.
Окисление алкенов перманганатом калия (марганцовкой) в нейтральной среде является качественной реакцией на алкены в частности, и непредельные углеводороды в целом. В результате реакции фиолетовый раствор марганцовки обесцвечивается и выпадает осадок бурого цвета - MnO2.
В более жестких условиях - при подкислении раствора серной кислотой, реакция идет с полным разрывом в самом слабом месте молекулы - двойной связи.

- Полимеризация
Полимеризация - цепная реакция синтеза полимеров, при котором молекула полимера образуется путем последовательного соединения молекул мономеров.
Индекс "n", степень полимеризации, обозначает число мономерных звеньев, которые входят в состав полимера.

Алкадиены
Алкадиены - непредельные (ненасыщенные) углеводороды, имеющие в молекуле две двойных связи С=С. Каждая такая связь содержит одну сигма-связь (σ-связь) и одну пи-связь (π-связь).
Алкадиены также называют диеновыми углеводородами. Первый член гомологического ряда - пропадиен - CH2=C=CH2. Общая формула их гомологического ряда - CnH2n-2.
Дата добавления: 2021-04-05; просмотров: 628; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
