Возбудимость — — — Исходный уровень
ГЛАВА 9
Функции систем кровообращения и лимфообращения
Система кровообращения
Основное назначение сердечно-сосудистой системы — обеспечение кровообращения, т. е. постоянной циркуляции крови из сердца в сосуды и из них вновь к сердцу. Движущей силой кровотока является энергия, задаваемая сердцем потоку крови в сосудах, и градиент давления — разница давлений между последовательными отделами сосудистого русла: кровь течет от области высокого давления к области низкого давления. Поэтому из аорты (где среднее давление составляет 100 мм рт. ст.) кровь поступает через систему магистральных артерий (80 мм рт. ст.) и артериол (40—60 мм рт. ст.) в капилляры (15—25 мм рт. ст.), откуда продолжает движение в венулы (12— 15 мм рт. ст.), венозные коллекторы — более крупные вены (3—5 мм рт. ст.) и полые вены (1—3 мм рт. ст.).
Центральное венозное давление — давление в устье полых вен — составляет около 0 мм рт. ст. В легочной артерии (в которой течет венозная кровь) кровяное давление равно 18—25 мм рт. ст., в легочной вене —3— 4 мм рт. ст. и в левом предсердии — 2—3 мм рт. ст.
Благодаря постоянному движению крови в сосудах выполняются основные функции системы кровообращения: 1) транспорт веществ, необходимых для обеспечения специфической деятельности клеток организма; 2) доставка к клеткам организма химических веществ, регулирующих их обмен; 3) отвод от клеток продуктов метаболизма; 4) гуморальная, т. е. осуществляемая через жидкость, связь органов и тканей между собой; 5) доставка тканям средств защиты; 6) удаление вредных веществ из организма; 7) обмен тепла в организме. Следовательно, система кровообращения выполняет одновременно две задачи: обеспечивает циркуляцию крови в системе и нутритивную (питательную) функцию клеток всех органов и тканей. При этом к тканям доставляются не только питательные вещества, но также кислород, физиологически активные вещества, в том числе гормоны, вода, соли, а из тканей выводятся углекислота и другие продукты обмена веществ.
|
|
|
Кровоток в организме теплокровных животных осуществляется по двум кругам, соединенным между собой через сердце. Малый (или легочный) круг кровообращения осуществляет прямой контакт с внешней средой, а большой — обеспечивает контакт с органами и тканями.
9.1.1. Функциональные классификации системы кровообращения
Распространено и обосновано деление сердечно-сосудистой системы по уровню кровяного давления: область высокого и область низкого давления. К области высокого давления относят левый желудочек сердца, артерии
крупного, среднего и малого калибра, артериолы; к области низкого давления — остальные отделы системы (от капилляров до левого предсердия).
|
|
|
В функциональной классификации шведского физиолога Б. Фолкова предусмотрено деление системы кровообращения на «последовательно соединенные звенья».
1. Сердце — насос, ритмически выбрасывающий кровь в сосуды.
2. Упруго-растяжимые сосуды, которые превращают периодичный выброс крови из сердца в равномерный кровоток (аорта с ее отделами, легочная артерия).
3. Резистивные сосуды (сосуды сопротивления) — прекапиллярный (в основном артериолы) и посткапиллярный отделы (венулы), которые вместе создают общее сопротивление кровотоку в сосудах органов.
4. Прекапиллярные сфинктеры — специализированный отдел мельчайших артериальных сосудов, сокращение гладкомышечных клеток этих сфинктеров может приводить к перекрытию просвета мелких сосудов. Эти сосуды регулируют объем кровотока в капиллярном русле.
5. Обменные сосуды, или истинные капилляры, где кровь контактирует с тканью благодаря огромным поверхностям капиллярного ложа. Здесь реализуется основная функция сердечно-сосудистой системы — обмен между кровью и тканями.
6. Шунтирующие сосуды (артериовенозные анастомозы), наличие которых доказано не для всех тканей.
|
|
|
7. Емкостные сосуды, в которых изменения просвета, даже столь небольшие, что не оказывают существенного влияния на общее сопротивление, вызывают выраженные изменения распределения крови и величины притока ее к сердцу (венозный отдел системы).
Однако разделение на «резистивные» и «емкостные» сосуды весьма условно, поскольку сопротивлением обладают как артериальные, так и венозные сосуды, хотя в количественном плане эта функция различна для указанных отделов. С другой стороны, емкостью обладают как венозные сосуды, так и артериальные. Весьма расплывчатым является и понятие «емкостные сосуды», поскольку одни авторы относят к ним все венозное ложе, другие — только венулы и мелкие вены. Неудачно выделены в классификации и «прекапиллярные» сфинктеры, поскольку в венозном русле также существуют сосуды с расположением гладкомышечных волокон типа сфинктеров или запирательных образований.
Функциональное назначение различных отделов сердечно-сосудистой системы отражает следующая классификация (Б. И. Ткаченко):
1. Генератор давления и расхода крови — сердце, подающее кровь в аорту и легочную артерию во время систолы.
|
|
|
2. Сосуды высокого давления — аорта и крупные артериальные сосуды, в которых поддерживается характерный для индивидуума уровень кровяного давления.
3. Сосуды — стабилизаторы давления — мелкие артерии и артериолы, которые путем сопротивления кровотоку и во взаимоотношении с сердечным выбросом поддерживают оптимальный для системы уровень артериального давления.
4. Распределители капиллярного кровотока — терминальные сосуды, гладкомышечные образования которых при сокращении прекращают кровоток в капилляре или возобновляют его (при расслаблении), обеспечивая необходимое в данной ситуации число функционирующих и нефункционирующих капилляров.
5. Обменные сосуды — капилляры и частично посткапиллярные участки венул, функция которых состоит в обеспечении обмена между кровью и тканями.
6. Аккумулирующие сосуды — венулы и мелкие вены, активные или пассивные изменения просвета которых ведут к накоплению крови (с возможностью ее последующего использования) или к экстренному выбросу ее в циркуляцию. Функция этих сосудов в основном емкостная, но они обладают и резистивной функцией, хотя и намного меньшей, чем стабилизаторы давления.
7. Сосуды возврата крови — крупные венозные коллекторы и полые вены, через которые обеспечивается подача крови к сердцу.
8. Шунтирующие сосуды — различного типа анастомозы, соединяющие между собой артериолы и венулы и обеспечивающие ненутритивный кровоток.
9. Резорбтивные сосуды — лимфатический отдел системы кровообращения, в котором главная функция лимфатических капилляров состоит в резорбции из тканей белков и жидкости, а лимфатических сосудов — в транспортировке резорбированного материала обратно в кровь.
9.1.2. Общая характеристика движения крови по сосудам
Отличительной особенностью характеристики сердечно-сосудистой системы на современном этапе является требование выражать все составляющие ее параметры количественно. Геометрические (табл. 9.1) и гидродинамические (табл. 9.2) характеристики системы кровообращения свидетельствуют о том, что аорта представляет собой трубку диаметром 1,6—3,2 см с площадью поперечного сечения 2,0—3,5 см2, постепенно разветвляющуюся на 109 капилляров, площадь поперечного сечения каждого из которых равна 5 * 10~7 см2.
Радиус усредненного капилляра может составлять 3 мкм, длина — около 750 мкм (хотя диапазон реальных значений довольно велик). Площадь поверхности стенки каждого усредненного капилляра равна 15 000 мкм2, а площадь поперечного сечения — 30 мкм2. Поскольку доказано, что обмен происходит и в посткапиллярных венулах, можно допускать, что общая обменная поверхность мельчайшего сосуда большого круга составляет 25 000 мкм2. Общее число функционирующих капилляров у человека массой 70 кг должно быть порядка 40 000 млн., тогда общая обменная площадь поверхности капилляров должна составлять около 1000 м2.
В сосудах различают скорость кровотока объемную и линейную.
Объемная скорость кровотока — количество крови, протекающее через поперечное сечение сосуда в единицу времени. Объемная скорость крово-
Таблица 9.1. Геометрические характеристики сосудистого русла большого круга кровообращения
| Сосуд | Диаметр, см | Общее число в организме | Длина, см |
| Аорта | 1,6-3,2 | 1 | 80 |
| Большие артерии | 0,6-0,1 | 103 | 20-40 |
| Малые артерии, артериолы | 0,1-0,02 | 108 | 0,2-5 |
| Капилляры | 0,0005-0,001 | 109 | 0,1 |
| Венулы, малые вены | 0,02-0,2 | 109 | 0,2-1,0 |
| Большие вены | 0,5-1,0 | 103 | 10-30 |
| Полые вены | 2,0 | 2 | 50 |
Таблица 9.2. Гидродинамические характеристики сосудистого русла большого круга кровообращения
| Сосуд | Давление, мм рт. ст. | Объем, см3 | Скорость кровотока, см • с-1 | Сопротивление, дин • с • см-5 |
| Аорта | 100-120 | 30 | 50 | 64 |
| Магистральные артерии | 100-120 | 60 | 13 | 3,9 • 103 |
| Ветвящиеся артерии | 80-90 | 50 | 8 | 1,6- 10s |
| Терминальные артерии | 80-90 | 25 | 6 | 1,2- 10s |
| Артериолы | 40-60 | 25 | 0,3 | 2 ■ 1010 |
| Капилляры | 15-25 | 60 | 0,07 | 3,9-10" |
| Венулы | 12-18 | 110 | 0,07 | 4-10’ |
| Терминальные вены | 10-12 | 130 | 1,3 | 3,2 • 103 |
| Ветвящиеся вены | 5-8 | 270 | 1,5 | 0,5 • 104 |
| Венозные коллекторы | 3-5 | 220 | 3,6 | 250 |
| Полые вены | 1-3 | 100 | 33 | 26 |
тока через сосуд прямо пропорциональна давлению крови в нем и обратно пропорциональна сопротивлению току крови в этом сосуде.
Линейная скорость кровотока отражает скорость продвижения частиц крови вдоль сосуда и равна объемной скорости, деленной на площадь сечения кровеносного сосуда. Линейная скорость различна для частиц крови, продвигающихся в центре потока и у сосудистой стенки. В центре сосуда линейная скорость максимальна, а около стенки сосуда она минимальна в связи с тем, что здесь особенно велико трение частиц крови о стенку.
Под сердечным выбросом понимают количество крови, выбрасываемой сердцем в сосуды в единицу времени.
Исходя из величины сердечного выброса в покое и средней скорости кровотока в капилляре (см. табл. 9.2) подсчитано, что площадь поперечного сечения капиллярного ложа должна в 700 раз превышать площадь поперечного сечения аорты. В покое функционирует только 25—35 % капилляров и общая площадь их обменной поверхности составляет 250—350 м2.
Давление и скорость кровотока в системе кровообращения уменьшаются от аорты до венул (см. табл. 9.2), а кровеносные сосуды становятся все более мелкими и многочисленными. В капиллярах скорость кровотока замедляется наиболее выраженно, что благоприятствует отдаче кровью веществ тканям. Для венозного отдела характерны низкий уровень давления и более медленная по сравнению с артериальным руслом скорость кровотока.
Сопоставление величин давления, кровотока и сопротивления сосудов в различных отделах сосудистого русла (табл. 9.2) свидетельствует о том, что внутрисосудистое давление от аорты до полых вен резко снижается, а объем крови в венозном русле, наоборот, возрастает. Следовательно, артериальное русло характеризуется высоким давлением и сравнительно небольшим объемом крови, а венозное — большим объемом крови и низким давлением.
Считается, что в венозном русле содержится 75—80 % крови, а в артериальном — 15—17 % и в капиллярах — около 5 % (в диапазоне 3—10 %).
Исходя из этого в функциональной схеме сердечно-сосудистой системы (рис. 9.1) выделены 3 области: высокого давления, транскапиллярного обмена и большого объема.
При функциональном единстве, согласованности и взаимообусловлен-
| ОБЛАСТИ |
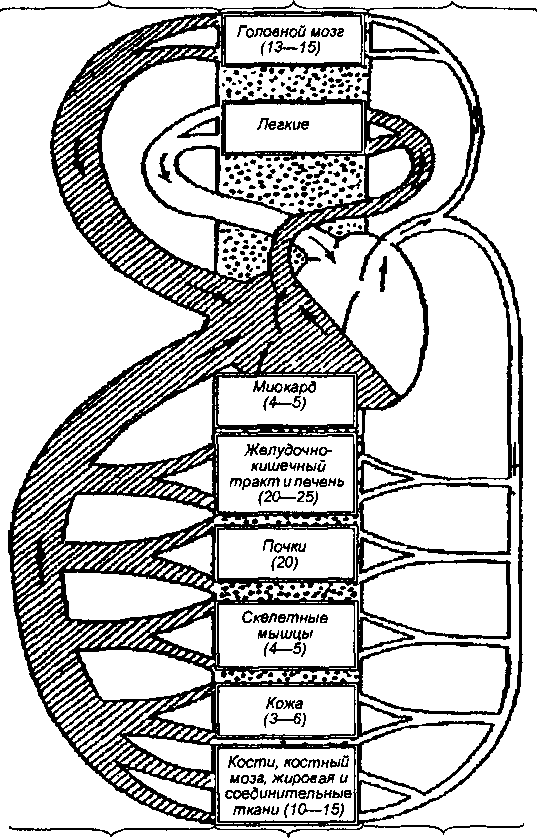
| Большого объема Транскапиллярного Высокогодавления (венозная) обмена (капилляры) (артериальная) |
| 70—80 % 5—10 % 15—20 % ОБЪЕМ СОДЕРЖАЩЕЙСЯ КРОВИ |
Цифры в скобках — величина кровотока в покое (в % к минутному объему), цифры внизу рисунка — содержание крови (в % к общему объему).
Артериальная часть сердечно-сосудистой системы (светлая часть схемы) содержит всего 15—20 % общего объема крови и характеризуется высоким (относительно остальных отделов системы) давлением. В центре схемы находится область транскапиллярного обмена, т. е. капиллярных (обменных) сосудов, для обеспечения оптимальной функции которых служит, в основном, сердечно-сосудистая система. При этом в виде точек обозначено большое число капилляров в организме и огромная площадь их возможной поверхности во время функционирования органа или ткани, хотя цифры внизу указывают на сравнительно небольшой объем содержащейся в них крови в условиях покоя. Наибольшее количество крови содержится в области большого объема, которая обозначена штриховкой. Эта область содержит в 3—4 раза больше крови, чем область высокого давления, в связи с чем и площадь, обозначенная на схеме штриховкой, больше площади светлой части схемы.
ности подразделов сердечно-сосудистой системы и характеризующих их параметров в ней условно выделяют три уровня:
а) системная гемодинамика — обеспечивающая процессы циркуляции крови (кругооборота) в системе;
б) органное кровообращение — кровоснабжение органов и тканей в зависимости от их функциональной потребности;
в) микрогемодинамика (микроциркуляция) — обеспечение транскапиллярного обмена, т. е. нутритивной (питательной) функции сосудов.
9. L3. Системная гемодинамика
Основными параметрами, характеризующими системную гемодинамику, являются: системное артериальное давление, общее периферическое сопротивление сосудов, сердечный выброс, работа сердца, венозный возврат крови к сердцу, центральное венозное давление, объем циркулирующей крови к сердцу.
9.1.3,1. Системное артериальное давление
Внутрисосудистое давление крови является одним из основных параметров, по которому судят о функционировании сердечно-сосудистой системы. Артериальное давление есть интегральная величина, составляющими и определяющими которой являются объемная скорость кровотока (Q) и сопротивление (R) сосудов. Поэтому системное артериальное давление (САД) является результирующей величиной сердечного выброса (СВ) и общего периферического сопротивления сосудов (ОПСС):
САД - СВ • ОПСС.
Давление в крупных ветвях аорты (собственно артериальное) определяется как:
АД = Q • R.
Применительно к артериальному давлению различают систолическое, диастолическое, пульсовое и среднее давления. Систолическое — возникает в артериях в период систолы левого желудочка сердца, диастолическое — в период его диастолы, разница между величиной систолического и диастолического давлений характеризует пульсовое давление (рис. 9.2). Выделяют также среднее давление, которое представляет собой среднюю (не арифметическую) между систолическим и диастолическим давлениями величину, которая была бы способна при отсутствии пульсовых колебаний давления крови дать такой же гемодинамический эффект, какой имеет место при естественном, колеблющемся движении крови. Среднее давление выражает энергию непрерывного движения крови. Поскольку продолжительность диастолического давления больше, чем систолического, то среднее давление ближе к величине диастолического давления и вычисляется как сумма диастолического давления плюс ’/3 пульсового.
Величина внутрисосудистого давления при прочих равных условиях оп-

Рис. 9.2. Систолическое (3), диастолическое (1), среднее (2) и пульсовое (1—3) давление в сосудах.
ределяется расстоянием места его измерения от сердца. Различают поэтому аортальное давление, артериальное давление, артериолярное, капиллярное, венозное (в мелких и крупных венах) и центральное венозное (в устье полых вен) давление.
В биологических и медицинских исследованиях артериальное давление выражают в миллиметрах ртутного столба (мм рт. ст.), а венозного — в миллиметрах водного столба (мм водн. ст.).
У человека в покое наиболее усредненным из всех средних величин считается систолическое давление 120—125 мм рт. ст., диастолическое 70— 75 мм рт. ст. Эти величины зависят от пола, возраста, конституции человека, условий его работы, географического пояса проживания и т. д.
Уровень АД не позволяет, однако, судить о степени кровоснабжения органов и тканей или величине объемной скорости кровотока в сосудах. Выраженные перераспределительные сдвиги в системе кровообращения могут происходить при неизменном уровне АД, поскольку изменения ОПСС могут компенсироваться противоположными сдвигами СВ, а сужение сосудов в одних регионах — сопровождаться их расширением в других. Одним из важнейших факторов, определяющих интенсивность кровоснабжения тканей, является величина просвета сосудов, определяющая их сопротивление кровотоку.
9.1.3.2. Общее периферическое сопротивление сосудов
Под этим термином понимают общее сопротивление всей сосудистой системы выбрасываемому сердцем потоку крови. Это соотношение описывается уравнением:
ОПСС =
Как следует из этого уравнения, для расчета ОПСС необходимо определить величину системного артериального давления и сердечного выброса.
Прямых бескровных методов измерения общего периферического сопротивления не разработано, и его величина определяется из уравнения Пуазейля для гидродинамики:

где R — гидравлическое сопротивление, I — длина сосуда, v — вязкость крови, г — радиус сосудов.
Поскольку при исследовании сосудистой системы животного или человека радиус сосудов, их длина и вязкость крови остаются обычно неизвестными, Франк, используя формальную аналогию между гидравлической и электрической цепями, привел уравнение Пуазейля к следующему виду:
R = Р'~Р2 1 1332,
где Рр—Р2 — разность давлений в начале и в конце участка сосудистой системы, Q — величина кровотока через этот участок, 1332— коэффициент перевода единиц сопротивления в систему CGS.
Уравнение Франка широко используется на практике для определения сопротивления сосудов, хотя оно не всегда отражает истинные физиологические взаимоотношения между объемным кровотоком, АД и сопротивле-
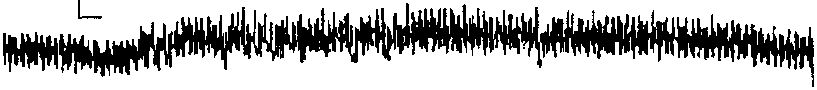
| 20 мм рт. ст. |
| 1 1 J ] |

| Аортальное давление Перфузионное давление в плечеголовной артерии Перфузионное давление в грудной аорте |

Отметка стимуляции
Рис. 9-3. Более выраженная величина повышения сопротивления сосудов бассейна грудной аорты по сравнению с его изменениями в бассейне плечеголовной артерии при прессорном рефлексе.
нием сосудов кровотоку у теплокровных. Эти три параметра системы действительно связаны приведенным соотношением, но у разных объектов, в разных гемодинамических ситуациях и в разное время их изменения могут быть в разной мере взаимозависимыми. Так, в конкретных случаях уровень САД может определяться преимущественно величиной ОПСС или в основном СВ.
В обычных физиологических условиях ОПСС составляет от 1200 до 1700 дин • с ’ см , при гипертонической болезни эта величина может возрастать в два раза против нормы и быть равной 2200—3000 дин • с • см~5.
Величина ОПСС состоит из сумм (не арифметических) сопротивлений регионарных сосудистых отделов. При этом в зависимости от большей или меньшей выраженности изменений регионарного сопротивления сосудов в них соответственно будет поступать меньший или больший объем крови, выбрасываемый сердцем. На рис. 9.3 показан пример более выраженной степени повышения сопротивления сосудов бассейна нисходящей грудной аорты по сравнению с его изменениями в плечеголовной артерии. Поэтому прирост кровотока в плечеголовной артерии будет больше, чем в грудной аорте. На этом механизме базируется эффект «централизации» кровообращения у теплокровных, обеспечивающий в тяжелых или угрожающих организму условиях (шок, кровопотеря и др.) перераспределение крови, прежде всего, к головному мозгу и миокарду.
9.L3.3. Сердечный выброс
В клинической литературе чаще используют понятие «минутный объем кровообращения» (МОК).
Минутный объем кровообращения характеризует общее количество крови, перекачиваемое правым и левым отделом сердца в течение одной минуты в сердечно-сосудистой системе. Размерность минутного объема кровообращения — л/мин или мл/мин. Чтобы нивелировать влияние индивидуальных антропометрических различий на величину МОК, его выражают в виде сердечного индекса. Сердечный индекс — это величина минутного объема кровообращения, деленная на площадь поверхности тела в м. Размерность сердечного индекса — л/(мин • м2).
В системе транспорта кислорода аппарат кровообращения является лимитирующим звеном, поэтому соотношение максимальной величины МОК, проявляющейся при максимально напряженной мышечной работе, с его значением в условиях основного обмена дает представление о функциональном резерве сердечно-сосудистой системы. Это же соотношение отражает и функциональный резерв сердца в его гемодинамической функции. Гемодинамический функциональный резерв сердца у здоровых людей составляет 300—400 %. Это означает, что МОК покоя может быть увеличен в 3—4 раза. У физически тренированных лиц функциональный резерв выше — он достигает 500—700 %.
Для условий физического покоя и горизонтального положения тела испытуемого нормальные величины МОК соответствуют диапазону 4—6 л/ мин (чаще приводятся величины 5—5,5 л/мин). Средние величины сердечного индекса колеблются от 2 до 4 л/(мин • м2) — чаще приводятся величины порядка 3—3,5 л/(мин • м2).
Поскольку объем крови у человека составляет только 5—6 л, полный кругооборот всего объема крови происходит примерно за 1 мин. В период тяжелой работы МОК у здорового человека может увеличиваться до 25— 30 л/мин, а у спортсменов — до 30—40 л/мин.
Факторами, определяющими величину МОК, являются систолический объем крови, частота сердечных сокращений и венозный возврат крови к сердцу.
Систолический объем крови. Объем крови, нагнетаемый каждым желудочком в магистральный сосуд (аорту или легочную артерию) при одном сокращении сердца, обозначают как систолический, или ударный, объем крови.
В покое объем крови, выбрасываемый из желудочка, составляет в норме от трети до половины общего количества крови, содержащейся в этой камере сердца к концу диастолы. Оставшийся в сердце после систолы резервный объем крови является своеобразным депо, обеспечивающим увеличение сердечного выброса при ситуациях, в которых требуется быстрая интенсификация гемодинамики (например, при физической нагрузке, эмоциональном стрессе и др.).
Величина систолического (ударного) объема крови во многом предопределена конечным диастолическим объемом желудочков. В условиях покоя диастолическая емкость желудочков сердца подразделяется на три фракции: ударного объема, базального резервного объема и остаточного объема. Все эти три фракции суммарно составляют конечно-диастолический объем крови, содержащийся в желудочках (рис- 9-4).
После выброса в аорту систолического объема крови оставшейся в желудочке объем крови — это конечно-систолический объем. Он подразделяется на базальный резервный объем и остаточный объем. Базальный резервный объем — это количество крови, которое может быть дополнительно выброшено из желудочка при увеличении силы сокращений миокарда (например, при физической нагрузке организма). Остаточный объем —это то количество крови, которое не может быть вытолкнуто из желудочка даже при самом мощном сердечном сокращении (см. рис. 9.4).
Величина резервного объема крови является одной из главных детерми-
|
| >s S о ф 7 S S Ь га s а: 6 |
Рис. 9.4. Фракции диастолической емкости левого желудочка.
нант функционального резерва сердца по его специфической функции — перемещению крови в системе. При увеличении резервного объема, соответственно, увеличивается максимальный систолический объем, который может быть выброшен из сердца в условиях его интенсивной деятельности.
Регуляторные влияния на сердце реализуются в изменении систолического объема путем воздействия на сократительную силу миокарда. При уменьшении мощности сердечного сокращения систолический объем снижается.
У человека при горизонтальном положении тела в условиях покоя систолический объем составляет от 60 до 90 мл (табл. 9.3).
Таблица 9.3. Некоторые параметры системной гемодинамики и насосной функции сердца у человека (в условиях основного обмена)
| Сердечный выброс, л/мин | 4,0- | -6,0 |
| Частота сердечных сокращений, мин-1 | 60- | -80 |
| Конечно-диастолический объем, мл | 65- | -130 |
| Конечно-систолический объем, мл | 40- | -60 |
| Ударный объем сердца, мл | 60- | -90 |
| Давление, мм рт. ст. | Аорта | Легочный ствол |
| систолическое | 110—120 | 25-30 |
| диастолическое | 60-75 | 6-12 |
| среднее | 70-80 | 9-17 |
| Общее периферическое сопротивление сосу | Большой круг | Малый круг |
| дов, дин • с • см-5 | 1200-1700 | 150-350 |
| Давление, мм рт. ст. | Левое предсердие | Правое предсердие |
| конечно-с истол ическое | 10-12 | 3-7 |
| конечно-диастолическое | 0-6 | 0-2 |
| Давление, мм рт. ст. | Левый желудочек | Правый желудочек |
| конечно-систолическое | 110-120 | 25-30 |
| конечно-диастолическое | 9-12 | 6-10 |
| Максимальная скорость прироста давления | ||
| (dP/dt,nax), мм рт. ст./с | 2000-2500 | 350-400 |
| Работа за систолу, Дж | 0,9-1,0 | 0,2 |
9.1.3.4. Частота сердечных сокращений (пульс)
Частота сердечных сокращений (пульс) в покое составляет от 60 до 80 ударов в минуту. Регуляторные влияния, вызывающие изменения частоты сердечных сокращений, называются хронотропными, а изменения силы сокращений сердца — инотропными.
Повышение частоты сердечных сокращений является важным адаптационным механизмом увеличения МОК, осуществляющим быстрое приспособление его величины к требованиям организма. При некоторых экстремальных воздействиях на организм сердечный ритм может повышаться в 3—3,5 раза по отношению к исходному.
Важным показателем системной гемодинамики и сердечной деятельности является работа сердца за систолу.
9.1.3.5. Работа сердца
Миокард желудочков в период изометрического сокращения сообщает находящейся в них крови потенциальную энергию, которая в период изгнания крови переходит в кинетическую энергию движущейся крови. Большая часть последней переходит в сосудистой системе в потенциальную энергию растянутых эластических стенок аорты и легочной артерии, и лишь небольшое количество ее (2—5 %) сохраняется в виде кинетической энергии движущейся крови.
Поскольку вся полезная работа сердца переходит в энергию крови, полную работу сердца за систолу можно рассчитать как сумму потенциальной и кинетической энергии крови. Потенциальная часть работы сердца вычисляется как произведение ударного объема сердца на среднее артериальное давление. Кинетическая часть работы сердца рассчитывается как половина произведения массы выбрасываемой из сердца крови за систолу на квадрат средней скорости изгнания крови из сердца. В покое кинетическая часть работы сердца составляет лишь 2—5 % от полной работы сердца, поэтому ее обычно не учитывают при расчетах. Однако при физических нагрузках кинетическая часть работы сердца у человека может составлять до 30 % от полной работы сердца за систолу. Рассчитанная таким образом работа характеризует деятельность левой половины сердца. Работа правых отделов сердца составляет около 25 % от этой величины.
9.1.3.6. Сократимость
Сократимость, т. е. способность сокращаться, характерная для всех разновидностей мышечной ткани, реализуется в миокарде благодаря трем специфическим свойствам сердечной мышцы: автоматизм — способность клеток водителей ритма генерировать импульсы без каких-либо внешних воздействий; проводимость — способность элементов проводящей системы к электротонической передаче возбуждения; возбудимость — способность кардиомиоцитов возбуждаться в естественных условиях под влиянием импульсов, передаваемых по волокнам Пуркинье (рис. 9.5). Важной особенностью возбудимости сердечной мышцы является длительный рефракторный период (полное исчезновение или резкое снижение возбудимости кардиомиоцитов после их предыдущего сокращения), гарантирующий ритмический характер последующего сокращения.
9.1.3.6.1. Автоматизм и проводимость миокарда
В области правого предсердия, а также на границе предсердий и желудочков располагаются участки, ответственные за возбуждение сердечной мышцы. Автоматизм сердца имеет миогенную природу и обусловлен спонтанной активностью части клеток его атипической ткани.
Указанные клетки образуют скопления в определенных участках миокарда. Наиболее важным в функциональном отношении из них является синусный, или синоатриальный, узел, расположенный между местом впадения верхней полой вены и ушком правого предсердия. В нижней части межпредсердной перегородки, непосредственно над местом прикрепления септальной створки трехстворчатого клапана, располагается атриовентрикулярный узел. От него отходит пучок атипических мышечных волокон, который пронизывает фиброзную перегородку между предсердиями и переходит в узкий длинный мышечный тяж, заключенный в межжелудочковую перегородку. Он называется атриовентрикулярным пучком, или пучком Гиса. Пучок Гиса разветвляется, образуя две ножки, от которых приблизительно на уровне середины перегородки отходят волокна Пуркинье, также образованные атипической тканью и формирующие субэндокардиальную сеть в стенках обоих желудочков (см. рис. 9.5).
Функция проводимости в сердце имеет электротоническую природу. Она обеспечивается низким электрическим сопротивлением щелевидных контактов (нексусов) между элементами атипического и рабочего миокарда, а также в области вставочных пластинок, разделяющих кардиомиоциты. В результате сверхпороговое раздражение любого участка вызывает генерализованное возбуждение всего миокарда. Это позволяет считать ткань сердечной мышцы, морфологически разделенную на отдельные клетки, функциональным синцитием.
Возбуждение миокарда зарождается в синоатриальном узле, который называют водителем ритма, или пейсмекером первого порядка, и далее
|
|
| Синоатриальный узел Атриовентрикулярный узел |
| Пучок Гиса |
| Правая ножка |
| Левая ножка |
| Передняя ветвь |
| Задняя ветвь |
| Волокна Пуркинье |
| Правое предсердие |
| Рис. 9.5. Проводящая система сердца. |
распространяется на мускулатуру предсердий с последующим возбуждением атриовентрикулярного узла, который является водителем ритма второго порядка. Скорость распространения возбуждения в предсердиях составляет 1 м/с. При переходе возбуждения на атриовентрикулярный узел имеет место так называемая атриовентрикулярная задержка, составляющая 0,04— 0,06 с. Механизм атриовентрикулярной задержки состоит в том, что проводящие ткани синоатриального и атриовентрикулярного узлов контактируют не непосредственно, а через волокна рабочего миокарда, для которых характерна более низкая скорость проведения возбуждения. Последнее распространяется далее по ножкам пучка Гиса и волокнам Пуркинье, передаваясь на мускулатуру желудочков, которую оно охватывает со скоростью 0,75—4,0 м/с. В силу особенностей расположения волокон Пуркинье возбуждение сосочковых мышц происходит несколько раньше, чем оно охватывает стенки желудочков. Благодаря этому нити, удерживающие трехстворчатый и митральный клапаны, оказываются натянутыми раньше, чем на них начинает действовать сила сокращения желудочков. По той же причине наружная часть стенки желудочков у верхушки сердца возбуждается несколько раньше участков стенки, прилежащих к ее основанию. Таким образом, волна возбуждения последовательно охватывает различные отделы сердца в направлении от правого предсердия к верхушке. Однако указанные сдвиги во времени крайне невелики и обычно принимается, что весь миокард желудочков охватывается возбуждением одновременно.
9.1.3.6.2. Мембранная природа автоматии сердца
Возбудимость клеток проводящей системы и рабочего миокарда имеет ту же биоэлектрическую природу, что и в поперечно-полосатых мышцах. Наличие заряда на мембране здесь также обеспечивается разностью концентраций ионов калия и натрия возле ее внешней и внутренней поверхности и избирательной проницаемостью мембраны для этих ионов. В покое мембрана кардиомиоцитов проницаема для ионов калия и почти непроницаема для ионов натрия. В результате диффузии ионы калия выходят из клетки и создают положительный заряд на ее поверхности. Внутренняя сторона мембраны становится электроотрицательной по отношению к наружной.
В клетках атипического миокарда, обладающих автоматией, мембранный потенциал способен спонтанно уменьшаться до критического уровня, что приводит к генерации потенциала действия. В норме ритм сердечных сокращений задается всего несколькими наиболее возбудимыми клетками синоатриального узла, которые называются истинными водителями ритма, или пейсмекерными клетками. В этих клетках во время диастолы мембранный потенциал, достигнув максимального значения, соответствующего величине потенциала покоя (60—70 мВ), начинает постепенно снижаться. Этот процесс называют медленной спонтанной диастолической деполяризацией. Она продолжается до того момента, когда мембранный потенциал достигает критического уровня (40—50 мВ), после чего возникает потенциал действия.
Для потенциала действия пейсмекерных клеток синоатриального узла характерны малая крутизна подъема, отсутствие фазы ранней быстрой реполяризации, а также слабая выраженность «овершута» и фазы «плато». Медленная реполяризация плавно сменяется быстрой. Во время этой фазы мембранный потенциал достигает максимальной величины, после чего вновь возникает фаза медленной спонтанной деполяризации (рис. 9.6).
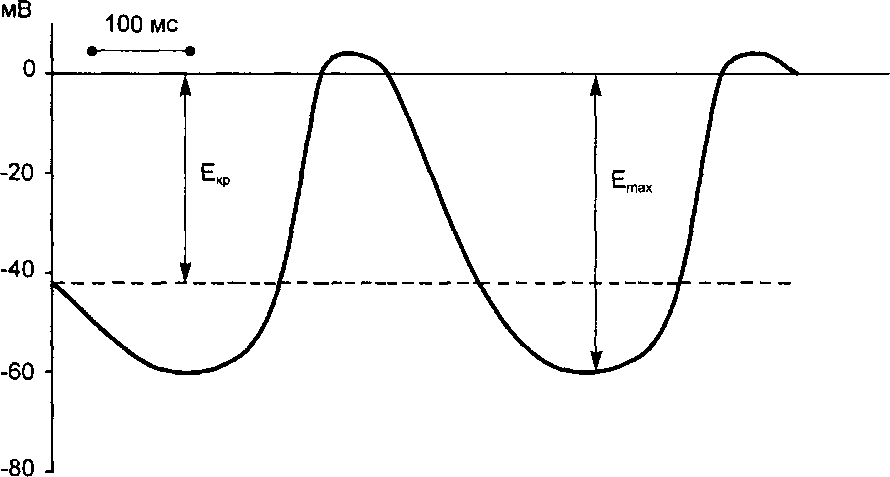
Рис. 9.6. Развитие потенциала действия истинного водителя ритма автоматии сердца.
Во время диастолы спонтанная деполяризация уменьшает мембранный потенциал (Етах) до критического уровня (Екр) и вызывает потенциал действия.

Рис. 9.7. Развитие потенциала действия истинного и латентного водителей ритма автоматии сердца.
Скорость медленной диастолической деполяризации истинного водителя ритма больше, чем у латентного.
Частота возбуждения пейсмекерных клеток у человека составляет в покое 70—80 в минуту при амплитуде потенциала действия 70—80 мВ. Во всех остальных клетках проводящей системы потенциал действия в норме возникает под влиянием возбуждения, приходящего из синоатриального узла. Такие клетки называют латентными водителями ритма. Потенциал действия в них возникает раньше, чем их собственная медленная спонтанная диастолическая деполяризация достигает критического уровня. Латентные водители ритма принимают на себя ведущую функцию только при условии разобщения с синоатриальным узлом. Частота спонтанной деполяризации таких клеток у человека составляет 30—40 в минуту (рис. 9.7),
Спонтанная медленная диастолическая деполяризация обусловлена совокупностью ионных процессов, связанных с функциями плазматических мембран. Среди них ведущую роль играют медленное уменьшение калиевой и повышение натриевой и кальциевой проводимости мембраны во время диастолы, параллельно чему происходит падение активности элек- трогенного натриевого насоса. К началу диастолы проницаемость мембраны для калия на короткое время повышается, и мембранный потенциал покоя приближается к равновесному калиевому потенциалу, достигая максимального диастолического значения. Затем проницаемость мембраны для калия уменьшается, что и приводит к медленному снижению мембранного потенциала до критического уровня. Одновременное увеличение проницаемости мембраны для натрия и кальция приводит к поступлению этих ионов в клетку, что также способствует возникновению потенциала действия. Снижение активности электрогенного насоса дополнительно уменьшает выход натрия из клетки и, тем самым, облегчает деполяризацию мембраны и возникновение возбуждения.
9.1.3.6.3. Возбудимость сердечной мышцы
Клетки миокарда обладают возбудимостью, но им не присуща автоматия. В период диастолы мембранный потенциал покоя этих клеток стабилен, и его величина выше (80—90 мВ), чем в клетках водителей ритма. Потенциал действия в этих клетках возникает под влиянием возбуждения клеток водителей ритма, которое достигает кардиомиоцитов, вызывая деполяризацию их мембран.
Потенциал действия клеток рабочего миокарда состоит из фазы быстрой деполяризации, начальной быстрой реполяризации, переходящей в фазу медленной реполяризации (фаза плато), и фазы быстрой конечной
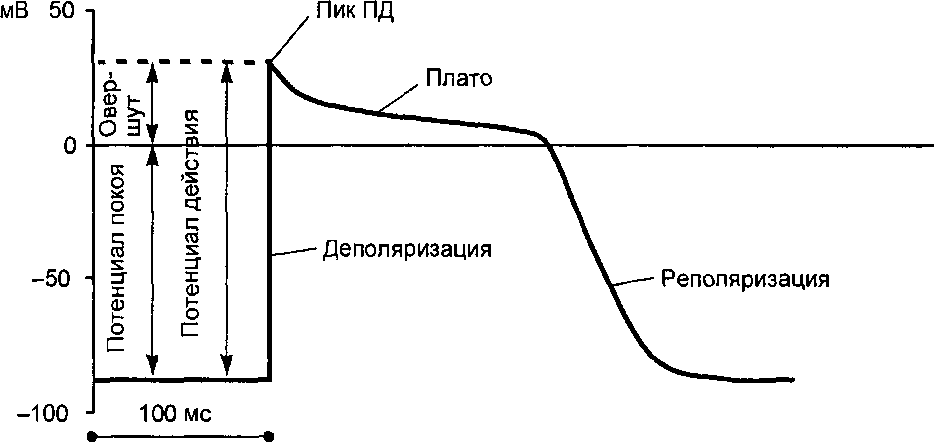
Рис. 9.8. Потенциал действия клетки рабочего миокарда.
Быстрое развитие деполяризации и продолжительная реполяризация. Замедленная реполяризация (плато) переходит в быструю реполяризацию.


Возбудимость — — — Исходный уровень
Рис. 9.9. Сопоставление потенциала действия и сокращения миокарда с фазами изменения возбудимости.
1 — фаза деполяризации; 2 — фаза начальной быстрой реполяризации; 3 — фаза медленной реполяризации (фаза плато); 4 —фаза конечной быстрой реполяризации; 5 — фаза абсолютной рефрактерности; 6 — фаза относительной рефрактерности; 7 — фаза супернормальной возбудимости.
Рефрактерность миокарда практически совпадает не только с возбуждением, но и с периодом сокращения.
реполяризации (рис. 9.8). Фаза быстрой деполяризации создается резким повышением проницаемости мембраны для ионов натрия, что приводит к возникновению быстрого входящего натриевого тока. Последний, однако, при достижении мембранного потенциала 30—40 мВ инактивируется и в последующем, вплоть до инверсии потенциала (около +30 мВ) и в фазу «плато», ведущее значение имеют кальциевые ионные токи. Деполяриза-
ция мембраны вызывает активацию кальциевых каналов, в результате чего возникает дополнительный деполяризирующий входящий кальциевый ток.
Конечная реполяризация в клетках миокарда обусловлена постепенным уменьшением проницаемости мембраны для кальция и повышением проницаемости для калия. В результате входящий ток кальция уменьшается, а выходящий ток калия возрастает, что обеспечивает быстрое восстановление мембранного потенциала покоя. Длительность потенциала действия кардиомиоцитов составляет 300—400 мс, что соответствует длительности сокращения миокарда (рис. 9.9).
9.1.3.6.4. Сопряжение возбуждения и сокращения миокарда
Инициатором сокращения миокарда, как и в скелетной мышце, является потенциал действия, распространяющийся вдоль поверхностной мембраны кардиомиоцита. Поверхностная мембрана волокон миокарда образует впя- чивания, так называемые поперечные трубочки (Т-система), к которым примыкают продольные трубочки (цистерны) саркоплазматического ретикулума, являющиеся внутриклеточным резервуаром кальция (рис. 9.10). Саркоплазматический ретикулум в миокарде выражен в меньшей степени, чем в скелетной мышце. Нередко к поперечной Т-трубочке примыкают не две продольные трубочки, а одна (система диад, а не триад, как в скелетной мышце). Считается, что потенциал действия распространяется с поверхностной мембраны кардиомиоцита вдоль Т-трубочки в глубь волокна и вызывает деполяризацию цистерны саркоплазматического ретикулума, что приводит к освобождению из цистерны ионов кальция.
Следующим этапом электромеханического сопряжения является перемещение ионов кальция к сократительным протофибриллам. Сократительная система сердца представлена сократительными белками — актином и миозином, и модуляторными белками — тропомиозином и тропонином. Молекулы миозина формируют толстые нити саркомера, молекулы актина—тонкие нити. В состоянии диастолы тонкие актиновые нити входят своими концами в промежутки между толстыми и более короткими миозиновыми нитями. На толстых нитях миозина располагаются поперечные мостики, содержащие АТФ, а на нитях актина — модуляторные белки — тропомиозин и тропонин. Эти белки образуют единый комплекс, блокирующий активные центры актина, предназначенные для связывания миозина и стимуляции его АТФазной активности. Сокращение волокон миокарда начинается со связывания тропонином вышедшего из саркоплазматического ретикулюма в межфибриллярное пространство кальция. Связывание кальция вызывает изменения конформации тропонин-тропомиози- нового комплекса. В результате этого открываются активные центры и происходит взаимодействие актиновых и миозиновых нитей. При этом стимулируется АТФазная активность миозиновых мостиков, происходит распад АТФ и выделяющаяся энергия используется на скольжение нитей друг относительно друга, приводящее к сокращению миофибрилл. В отсутствие ионов кальция тропонин препятствует образованию актомиозинового комплекса и усилению АТФазной активности миозина. Морфологические и функциональные особенности миокарда свидетельствуют о тесной связи между внутриклеточным депо кальция и внутриклеточной средой. Так как запасы кальция во внутриклеточных депо невелики, большое значение имеет вход кальция в клетку во время генерации потенциала действия (см. рис. 9.10). Потенциал действия и сокращение миокарда совпадают

Триггерный эффект

Рис. 9.10. Схема соотношений между возбуждением, током Са2+ и активацией сократительного аппарата. Начало сокращения связано с выходом Са2+ из продольных трубочек при деполяризации мембраны. Са2+, входящий через мембраны кардиомиоцита в фазу плато потенциала действия, пополняет запасы Са2+ в продольных трубочках.
по времени. Поступление кальция из наружной среды в клетку создает условия для регуляции силы сокращения миокарда. Большая часть входящего в клетку кальция, очевидно, пополняет его запасы в цистернах саркоплазматического ретикулума, обеспечивая последующие сокращения.
Удаление кальция из клеточного пространства приводит к разобщению процессов возбуждения и сокращения миокарда. Потенциалы действия при этом регистрируются почти в неизменном виде, но сокращения миокарда не происходит. Вещества, блокирующие вход кальция во время генерации потенциала действия, вызывают аналогичный эффект. Вещества, угнетающие кальциевый ток, уменьшают длительность фазы плато и потенциала действия и понижают способность миокарда к сокращению. При повышении содержания кальция в межклеточной среде и при введении веществ, усиливающих вход этого иона в клетку, сила сердечных сокращений увеличивается. Таким образом, потенциал действия играет роль пускового механизма, вызывая освобождение кальция из цистерн саркоплазматического ретикулума, регулирует сократимость миокарда, а также пополняет запасы кальция во внутриклеточных депо.
9.1.3.6.5. Сердечный цикл и его фазовая структура
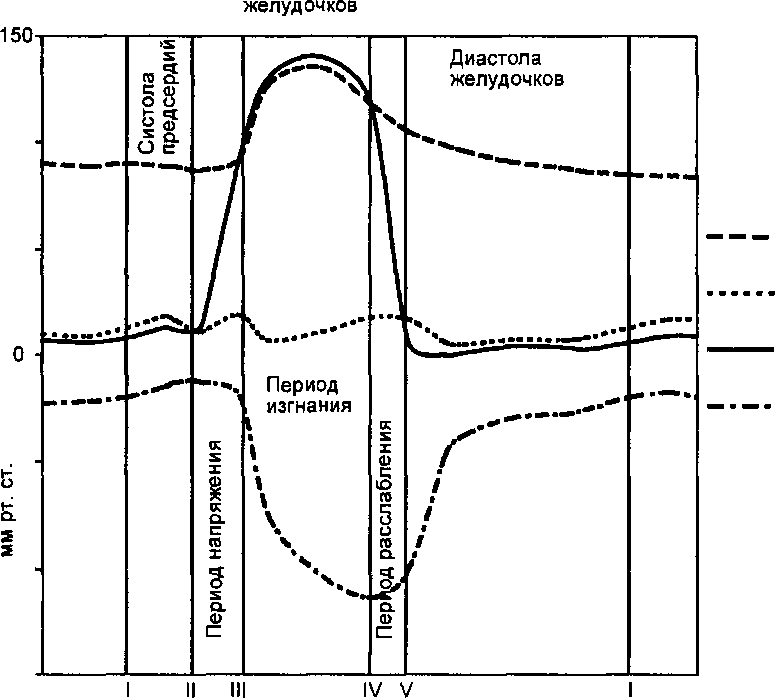
Работа сердца представляет собой непрерывное чередование периодов сокращения (систола) и расслабления (диастола). Сменяющие друг друга систола и диастола составляют сердечный цикл. Поскольку в покое частота сокращений сердца составляет 60—80 циклов в минуту, то каждый из них продолжается около 0,8 с. При этом 0,1 с занимает систола предсердий, 0,3 с — систола желудочков, а остальное время — общая диастола сердца.
К началу систолы миокард расслаблен, а сердечные камеры заполнены кровью, поступающей из вен. Атриовентрикулярные клапаны в это время раскрыты и давление в предсердиях и желудочках практически одинаково. Генерация возбуждения в синоатриальном узле приводит к систоле предсердий, во время которой за счет разности давлений конечно-диастолический объем желудочков возрастает приблизительно на 15 %. С окончанием систолы предсердий давление в них понижается.
Поскольку клапаны между магистральными венами и предсердиями отсутствуют, во время систолы предсердий происходит сокращение кольцевой мускулатуры, окружающей устья полых и легочных вен, что препятствует оттоку крови из предсердий обратно в вены. В то же время систола предсердий сопровождается некоторым повышением давления в полых венах. Большое значение имеет обеспечение турбулентного характера потока крови, поступающего из предсердий в желудочки, что способствует захлопыванию атриовентрикулярных клапанов. Максимальное и среднее давление в левом предсердии во время систолы составляют соответственно 8— 15 и 5—7 мм рт. ст., в правом предсердии — 3—8 и 2—4 мм рт. ст. (рис. 9.11).
С переходом возбуждения на атриовентрикулярный узел и проводящую систему желудочков начинается систола последних. Ее начальный этап (период напряжения) продолжается 0,08 с и состоит из двух фаз. Фаза асинхронного сокращения (0,05 с) представляет собой процесс распространения возбуждения и сокращения по миокарду. Давление в желудочках при этом практически не меняется. В процессе начинающегося синхронного сокращения миокарда желудочков, когда давление в них возрастает до величины, достаточной для закрытия атриовентрикулярных клапанов, но недостаточной для открытия полулунных, наступает фаза изоволюмического, или изометрического, сокращения.
Дальнейшее повышение давления приводит к раскрытию полулунных клапанов и началу периода изгнания крови из сердца, общая длительность которого составляет 0,25 с. Этот период состоит из фазы быстрого изгнания (0,13 с), во время которой давление в желудочках продолжает расти и достигает максимальных значений, и фазы медленного изгнания (0,13 с), во время которой давление в желудочках начинает снижаться, а после окончания сокращения оно резко падает. В магистральных артериях давление снижается значительно медленнее, что обеспечивает захлопывание полулунных клапанов и предотвращает обратный ток крови. Промежуток времени от начала расслабления желудочков до закрытия полулунных клапанов называется протодиастолическим периодом.
После окончания систолы желудочков возникает диастолический период желудочков сердца (диастола), длящаяся 0,47 с. Он включает в себя следующие периоды и фазы (при частоте сердечных сокращений 75 в минуту):
Период расслабления (0,12 с), состоящий из:
|
|
| Систола |
| Давление в аорте Давление в левом предсердии Давление в левом желудочке Объем левого желудочка |
| Рис. 9.11. Изменения объема левого желудочка и колебания давления в левом предсердии, левом желудочке и аорте в течение сердечного цикла. |
I — начало систолы предсердий; II — начало систолы желудочков; III — момент раскрытия полулунных клапанов; IV — конец систолы желудочков и момент закрытия полулунных клапанов; V — раскрытие атриовентрикулярных клапанов.
Опускание линии, показывающей объем желудочков, соответствует динамике их опорожнения.
— протодиастолического интервала — 0,04 с (время от начала расслабления миокарда желудочков до закрытия полулунных клапанов);
— фазы изометрического (изоволюмического) расслабления — 0,08 с (время от закрытия полулунных клапанов до открытия атриовентрикулярных).
Период наполнения (0,35 с) состоящий из:
— фазы быстрого наполнения — 0,08 с (с момента открытия атриовентрикулярных клапанов);
— фазы медленного наполнения — 0,18 с;
— фазы наполнения желудочков, обусловленной систолой предсердий — 0,09 с.
К концу систолы желудочков и началу диастолы (с момента закрытия полулунных клапанов) в желудочках содержится остаточный, или резервный, объем крови (конечно-систолический объем). В это же время начинается резкое падение давления в желудочках (фаза изоволюмического, или изометрического, расслабления). Способность миокарда быстро расслабляться является важнейшим условием для наполнения сердца кровью. Когда давление в желудочках (начальное диастолическое) становится меньше давления в предсердиях, открываются атриовентрикулярные клапаны и начинается фаза быстрого наполнения, во время которой кровь с ускорением поступает из предсердий в желудочки. Во время этой фазы в желудочки поступает до 85 % их диастолического объема. По мере заполнения желудочков скорость их наполнения кровью снижается (фаза медленного наполнения). В конце диастолы желудочков начинается систола предсердий, в результате чего в желудочки поступает еще 15 % их диастолического объема. Таким образом, в конце диастолы в желудочках создается конечно-диастолический объем, которому соответствует определенный уровень конечно-диастолического давления в желудочках. Конечно-диастолический объем и конечно-диастолическое давление составляет так называемую преднагрузку сердца, которая является определяющим условием для растяжения волокон миокарда, т. е. реализации закона Франка—Старлинга (см. «Миогенные механизмы регуляции сердца» в разделе 9.1.3.6.7).
Частота генерации возбуждения клетками проводящей системы и соответственно сокращений миокарда определяется длительностью рефрактерной фазы, возникающей после каждой систолы. Как и в других возбудимых тканях, в миокарде рефрактерность обусловлена инактивацией натриевых ионных каналов, возникающей в результате деполяризации (см. рис. 9.9). Для восстановления входящего натриевого тока необходим уровень реполяризации около 40 мВ. До этого момента имеет место период абсолютной рефрактерности, который продолжается около 0,27 с. Далее следует период относительной рефрактерности (см. рис. 9.9), в течение которого возбудимость клетки постепенно восстанавливается, но остается еще сниженной (длительность 0,03 с). В этот период сердечная мышца может ответить дополнительным сокращением, если стимулировать ее очень сильным раздражителем. За периодом относительной рефрактерности следует короткий период супернормальной возбудимости (см. рис. 9.9). В этот период возбудимость миокарда высока и можно получить дополнительный ответ в виде сокращения мышцы, нанося на нее подпороговый раздражитель.
Длительный рефрактерный период имеет для сердца важное биологическое значение, так как он предохраняет миокард от быстрого или повторного возбуждения и сокращения. Этим исключается возможность тетанического сокращения миокарда и нарушения нагнетательной функции сердца.
К тетаническому сокращению и утомлению в физиологическом понимании этого термина миокард не способен. При раздражении сердечная ткань ведет себя как функциональный синцитий, и сила каждого сокращения определяется по закону «все или ничего», согласно которому при возбуждении, превышающем пороговую величину, сокращающиеся волокна миокарда развивают максимальную силу, не зависящую от величины надпорогового раздражителя.
Преждевременное сокращение всего сердца или его частей в результате дополнительного возбуждения миокарда вызывает экстрасистолу. По месту возникновения дополнительного возбуждения различают синусовые, предсердные, атриовентрикулярные и желудочковые экстрасистолы.
9.1.3.6.6. Механические, электрические и физические проявления деятельности сердца
Запись сокращений сердца, выполненная каким-либо инструментальным способом, называется кардиограммой.
При сокращении сердце изменяет свое положение в грудной клетке.
Оно несколько поворачивается вокруг своей оси слева направо, плотнее прижимаясь изнутри к грудной стенке. Регистрация сердечного толчка определяет механокардиограмму (апекс-кардиограмму), которая находит весьма ограниченное использование на практике.
Более широко в клинике и в научных исследованиях используются различные модификации электрокардиографии. Последняя представляет собой метод исследования сердца, основанный на регистрации и анализе электрических потенциалов, возникающих при деятельности сердца.
Электрокардиограмма. Метод электрокардиографии основан на том, что в процессе распространения возбуждения по миокарду поверхность невозбужденных (поляризованных) кардиомиоцитов несет положительный заряд, а возбужденных (деполяризованных) — отрицательный. При этом возникает электрическое поле, которое можно зарегистрировать с поверхности тела. Поскольку между различными тканями тела создается в этом случае разность потенциалов, изменяющаяся в соответствии с колебаниями величины и направления электрического поля сердца, регистрируемые изменения разности потенциала во времени и составляют суть метода электрокардиографии. Кривая изменений этой разницы потенциалов, определяемая с помощью высокочувствительного вольтметра, называется электрокардиограммой (ЭКГ), а соответствующий прибор для записи этой кривой — электрокардиографом. Важно подчеркнуть, что ЭКГ отражает возбуждение сердца, но не его сокращение.
Для регистрации ЭКГ используют различные схемы наложения электродов — отведения ЭКГ. К обязательно регистрируемым в клинике относятся следующие 12 отведений: 3 стандартных (двухполюсные от конечностей), 3 усиленных (однополюсные от конечностей), 6 грудных (однополюсные от грудной клетки).
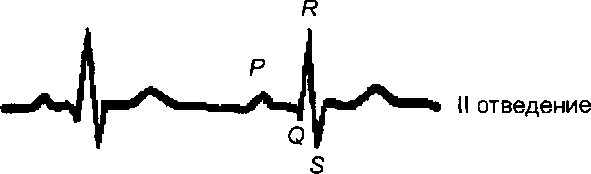
При использовании двухполюсных (биполярных) отведений электроды регистрируют разность потенциалов между двумя точками тела, потенциал каждой из которых меняется в течение сердечного цикла. Электроды по этой схеме накладываются на обе руки и левую ногу, образуя три так называемых стандартных отведения, обозначаемых римскими цифрами I, II, III (рис. 9.12).
I отведение: правая рука (—) — левая рука (+);
II отведение: правая рука (—) — левая нога (+);
III отведение: левая рука (—) — левая нога (+).
Правую руку всегда соединяют с отрицательным, а левую ногу — с положительным полюсом прибора. Левую руку в I стандартном отведении соединяют с положительным полюсом, а в III стандартном — с отрицательным.
При регистрации ЭКГ в однополюсных (униполярных) отведениях один из электродов — активный — накладывают на участок тела с меняющимся электрическим потенциалом и подключают к положительному полюсу измерительного прибора. Потенциал второго электрода, называемого индифферентным, остается практически постоянным и условно принимается за нулевой. Этот электрод подключают к отрицательному полюсу измерительного прибора.
На теле человека трудно найти участок с постоянным электрическим потенциалом, поэтому для получения индифферентного электрода используют искусственные приемы. Один из них состоит в том, что соединяются вместе провода от трех электродов, наложенных на обе руки и левую ногу. Полученный таким способом условный электрод называют объединенным, а производимые с его помощью однополюсные отведения обозначают латинской буквой V (от англ. Voltage). Этот электрод применяют для регист-



| III отведение |
| Рис. 9.12. Двухполюсные (стандартные) отведения электрокардиограммы. |
Концы стрелок соответствуют конечностям, соединяемым с кардиографом в I (вверху), II (посредине) и III (внизу) отведениях. Справа —левые конечности, слева — правые. В правой части — схематическое изображение электрокардиограммы в каждом из этих отведений.
рации однополюсных грудных отведений (Vj—V6).
Другой способ получения индифферентного электрода используется при регистрации однополюсных отведений от конечностей. В этом случае его получают, соединяя электроды только от двух конечностей — тех, на которых не находится активный электрод, и присоединяют к отрицательному полюсу прибора. Амплитуда ЭКГ при этом способе в 1,5 раза больше, чем в предыдущем случае. Поэтому эти однополюсные отведения от конечностей получили название «усиленных» и обозначаются символами aVR, aVL, aVF (от англ, augmented — усиленный, right — правый, left — левый, foot — нога).
При графической записи электрокардиограммы в любом отведении в каждом цикле отмечается совокупность характерных зубцов, которые принято обозначать буквами Р, Q, R, S и Т (см. рис. 9.12). Считается, что зубец Р отражает процессы деполяризации в области предсердия, интервал P—Q характеризует процесс распространения возбуждения в предсердиях и атриовентрикулярном узле, комплекс зубцов QRS — процессы деполяризации в желудочках, а сегмент S—Tw зубец Т— процессы реполяризации в желудочках. Таким образом, комплекс зубцов QRST характеризует распространение электрических процессов в миокарде или электрическую систолу. Важное диагностическое значение имеют временные и амплитудные характеристики составляющих электрокардиограммы. Во втором стандартном отведении в норме амплитуда зубца R составляет 0,8—1,2 мВ, а амплитуда Q не должна превышать */4 этой величины. Длительность интервала P—Q в норме составляет 0,12—0,20 с, комплекса QRS— не более 0,08 с, а сегмент S—T — 0,36—0,44 с.


Рис. 9.13. Нормальная фонокардиограмма.
Римские цифры — тоны сердца; ЭКГ — синхронно регистрируемая электрокардиограмма.
Тоны сердца. Каждый сердечный цикл сопровождается несколькими раздельными звуками, которые называются тонами сердца. Первый тон низкий, он возникает одновременно с началом систолы желудочков и обусловлен вибрацией створок атриовентрикулярных клапанов, включая их сухожильные струны, сокращением мускулатуры желудочков и механическими колебаниями начальных отделов аорты и легочной артерии. Первый тон называют систолическим, его общая продолжительность составляет приблизительно 0,12 с, что соответствует фазе напряжения и началу периода изгнания крови.
Второй тон высокий и продолжается около 0,08 с, его возникновение связано с захлопыванием полулунных клапанов и происходящей при этом вибрацией их стенок. Этот тон называют диастолическим. Интенсивность первого тона зависит от крутизны нарастания давления в желудочках во время систолы, а второго — от давления в аорте и легочной артерии.
Графическая запись тонов сердца называется фонокардиограммой. Фонокардиография позволяет выявить третий и четвертый тоны сердца: менее интенсивные, чем первый и второй, и поэтому неслышные при обычной аускультации. Третий тон отражает вибрацию стенок желудочков вследствие быстрого поступления крови в начале фазы наполнения. Четвертый тон возникает во время систолы предсердий и продолжается до начала их расслабления (рис. 9,13).
Сфигмо- и флебография. Сократительный процесс, протекающий в ходе сердечного цикла, находит отражение в ритмических колебаниях стенок
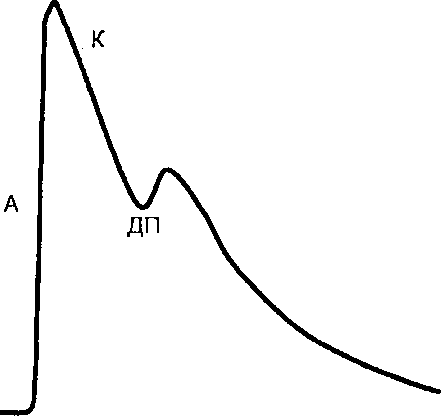
| Рис. 9.14. Графическая запись пульсового колебания давления крови в артерии. |
| А — анакрота; К — катакрота; ДП — дикротический подъем. |
Сфигмограмма сонной артерии (рис. 9.14) характеризуется высокоамплитудной главной волной, крутой восходящий участок которой называется анакротой (А). Этот участок отражает ускоренное поступление крови в артерии из левого желудочка в начале фазы быстрого изгнания, что приводит к увеличению давления в артериях и их растяжению. Вершина этой волны, отражающая примерное равенство между притоком крови в магистральной артерии и ее оттоком в периферические сосуды, переходит в нисходящее колено — катакроту (К). Последняя соответствует по времени фазе медленного изгнания, когда отток крови из растянутых эластических артерий начинает преобладать над притоком. В период катакроты проявляется остроконечный, направленный вниз зубец, который называется инцизурой (вырезкой) и соответствует окончанию систолы левого желудочка, когда давление в нем становится ниже, чем в аорте. Самая низкая точка инцизуры соответствует полному закрытию аортального клапана. Диастолическая часть сфигмограммы начинается дикротической волной (дикротическим подъемом — ДП), которая возникает в результате отражения гидравлической волны от замкнутых кармашков аортального клапана. Последующий плавный спуск кривой соответствует равномерному оттоку крови из центральных сосудов в дистальные во время диастолы.
Косвенная характеристика сократительных процессов, происходящих в правых отделах сердца, может быть получена при помощи югулярной флебографии, отражающей динамику оттока крови из полых вен в правое предсердие. Каждый сердечный цикл на югулярной флебограмме (рис. 9.15) представлен тремя положительными (а, с, v) и двумя отрицательными (х, у) волнами.
Систола правого предсердия вызывает замедление оттока крови из вен, что приводит к возникновению положительной волны флебограммы, обозначаемой символом «а» (от лат. atrium). Следующая положительная волна возникает в начале систолы правого желудочка при закрытии трехстворчатого клапана и обозначается символом «с» (от лат. саг- otis), так как ее появление совпадает с началом подъема каротидной сфигмограммы. Далее следует отрицательная волна «х», которая отражает ускоренный отток крови из центральных вен в расслабляющееся предсердие. Самая глубокая точка этой волны совпадает по времени с закрытием полулунных клапанов.
Наполнение правого предсердия при закрытом трехстворчатом клапане приводит к повышению в нем давления и затруднению оттока крови из вен, что отражается на флебограмме положительной волной «V» (от лат. ventriculus). Последующее быстрое поступление крови из правого предсердия в желудочек в период диастолы сердца проявляется в виде отрицательной волны флебограммы, которая называется волной диастолического коллапса и обозначается символом «у».
9.1.3.6.7. Общие принципы регуляции сердечного выброса
От величины сердечного выброса зависят два условия выполнения адекватной текущим задачам нутритивной функции системы кровообращения: обеспечение оптимального количества циркулирующей крови и поддержание (совместно с сосудами) определенного уровня среднего артериального давления (70—90 мм рт. ст.), необходимого для удержания физиологических констант в капиллярах (25—30 мм рт. ст.). При этом обязательным условием нормальной работы сердца является равенство притока крови по венам и ее выброса в артерии. Решение этой задачи обеспечивается, в основном, механизмами, обусловленными свойствами самой сердечной мышцы. Проявление этих механизмов называют миогенной ауторегуляцией насосной функции сердца. Существуют два способа ее реализации: ге- терометрическая — осуществляется в ответ на изменения исходной длины волокон миокарда, гомеометрическая — происходит при их сокращениях в изометрическом режиме.
Миогенные механизмы регуляции деятельности сердца. Изучение зависимости силы сокращений сердца от растяжения его камер показало, что сила каждого сердечного сокращения зависит от величины венозного притока и определяется конечной диастолической длиной волокон миокарда. Эта зависимость получила название гетерометрическая регуляция сердца и известна как закон Франка-Старлинга: «Сила сокращения желудочков сердца, измеренная любым способом, является функцией длины мышечных волокон перед сокращением», т. е. чем больше наполнение камер сердца кровью, тем больше сердечный выброс (рис. 9.16). Установлена ультраструктурная основа этого закона, заключающаяся в том, что количество актомиозиновых мостиков является максимальным при растяжении каждого саркомера до 2,2 мкм.
Увеличение силы сокращения при растяжении волокон миокарда не сопровождается увеличением длительности сокращения, поэтому указанный эффект одновременно означает увеличение скорости нарастания давления в камерах сердца во время систолы.
Инотропные влияния на сердце, обусловленные эффектом Франка- Старлинга, играют ведущую роль в увеличении сердечной деятельности при усиленной мышечной работе, когда сокращающиеся скелетные мышцы вызывают периодическое сжатие вен конечностей, что приводит к уве-

Центральное венозное давление

Рис. 9.16. Увеличение силы сокращений сердца (амплитуда колебаний верхней кривой) при его растяжении. Опыт на сердечно-легочном препарате.
личению венозного притока за счет мобилизации резерва депонированной в них крови. Отрицательные инотропные влияния по указанному механизму играют существенную роль в изменениях кровообращения при переходе в вертикальное положение (ортостатическая проба). Эти механизмы имеют большое значение для согласования изменений сердечного выброса и притока крови по венам малого круга, что предотвращает опасность развития отека легких.
Термином «гомеометрическая регуляция» обозначают миогенные механизмы. для реализации которых не имеет значения степень конечно-диастолического растяжения волокон миокарда. Среди них наиболее важным является зависимость силы сокращения сердца от давления в аорте (эффект Анрепа) и хроно-инотропная зависимость. Этот эффект состоит в том, что при увеличении давления «на выходе» из сердца сила и скорость сердечных сокращений возрастают, что позволяет сердцу преодолевать возросшее сопротивление в аорте и поддерживать оптимальным сердечный выброс.
Иннервация сердца. Сердце — обильно иннервированный орган. Среди чувствительных образований сердца основное значение имеют две популяции механорецепторов, сосредоточенных, главным образом, в предсердиях и левом желудочке: А-рецепторы реагируют на изменение напряжения сердечной стенки, а В-рецепторы возбуждаются при ее пассивном растяжении. Афферентные волокна, связанные с этими рецепторами, идут в составе блуждающих нервов. Свободные чувствительные нервные окончания, расположенные непосредственно под эндокардом, представляют собой терминали афферентных волокон, проходящих в составе симпатических нервов. Эфферентная иннервация сердца осуществляется при участии обоих отделов вегетативной нервной системы. Тела симпатических пре- ганглионарных нейронов, участвующих в иннервации сердца, располагаются в сером веществе боковых рогов трех верхних грудных сегментов спинного мозга. Преганглионарные волокна направляются к нейронам верхнего грудного (звездчатого) симпатического ганглия. Постганглионарные волокна этих нейронов вместе с парасимпатическими волокнами блуждающего нерва образуют верхний, средний и нижний сердечные нервы, Симпатические волокна пронизывают весь орган и иннервируют не только миокард, но и элементы проводящей системы.
Тела парасимпатических преганглионарных нейронов, участвующих в иннервации сердца, располагаются в продолговатом мозге. Их аксоны идут в составе блуждающих нервов. После вхождения блуждающего нерва в грудную полость от него отходят веточки, которые включаются в состав сердечных нервов.
Отростки блуждающего нерва, проходящие в составе сердечных нервов, представляют собой парасимпатические преганглионарные волокна. С них возбуждение передается на интрамуральные нейроны и далее — преимущественно на элементы проводящей системы. Влияния, опосредованные правым блуждающим нервом, адресованы, в основном, клеткам синоатриального, а левым — клеткам атриовентрикулярного узла. Прямого влияния на желудочки сердца блуждающие нервы не оказывают.
Иннервируя ткань водителей ритма, вегетативные нервы способны менять их возбудимость, тем самым вызывая изменения частоты генерации потенциалов действия и сокращений сердца (хронотропный эффект). Нервные влияния изменяют скорость элекгротонической передачи возбуждения и, следовательно, длительности фаз сердечного цикла. Такие эффекты называют дромотропными.
Поскольку действие медиаторов вегетативной нервной системы заключается в изменении уровня циклических нуклеотидов и энергетического обмена, вегетативные нервы в целом способны влиять и на силу сердечных сокращений (инотропный эффект). В лабораторных условиях получен эффект изменения величины порога возбуждения кардиомиоцитов под действием нейромедиаторов, его обозначают как батмотропный.
Перечисленные пути воздействия нервной системы на сократительную активность миокарда и насосную функцию сердца представляют собой хотя и исключительно важные, но вторичные по отношению к миогенным механизмам модулирующие влияния.
9.1.3.6.8. Нейрогенная регуляция деятельности сердца
Влияние на сердце блуждающих нервов. Результатом стимуляции этих нервов является отрицательный хронотропный эффект сердца (рис. 9.17), на фоне которого проявляются также отрицательные и дромотропный инотропный эффекты. Существуют постоянные тонические влияния на сердце со стороны бульбарных ядер блуждающего нерва: при его двусторонней перерезке частота сердцебиений возрастает 1,5—2,5 раза. При длительном сильном раздражении влияние блуждающих нервов на сердце постепенно ослабевает или прекращается, что получило название «эффекта ускользания» сердца из-под влияния блуждающего нерва.
Различные отделы сердца по-разному реагируют на возбуждение парасимпатических нервов. Так, холинергические влияния на предсердия вызывают значительное угнетение автоматии клеток синусного узла и спонтанно возбудимой ткани предсердий. Сократимость рабочего миокарда предсердий в ответ на стимуляцию блуждающего нерва снижается. Рефрактерный период предсердий при этом также уменьшается в результате значительного укорочения длительности потенциала действия предсердных кардиомиоцитов. С другой стороны, рефрактерность кардиомиоцитов желудочков под влиянием блуждающего нерва, напротив, значительно возрастает, а отрицательный парасимпатический инотропный эффект на желудочки выражен в меньшей степени, чем на предсердия.
Электрическая стимуляция блуждающего нерва вызывает урежение или прекращение сердечной деятельности вследствие торможения автоматической функции водителей ритма синоатриального узла. Выраженность этого


Рис. 9.17. Электрическое раздражение эфферентных нервов сердца.
Вверху — уменьшение частоты сокращений при раздражении блуждающего нерва; внизу — увеличение частоты и силы сокращений при раздражении симпатического нерва.
Стрелками отмечены начало и конец раздражения.
эффекта зависит от силы и частоты раздражения блуждающего нерва. По мере увеличения силы раздражения отмечается переход от небольшого замедления синусного ритма до полной остановки сердца.
Отрицательный хронотропный эффект раздражения блуждающего нерва связан с угнетением (замедлением) генерации импульсов в водителе ритма сердца синусного узла. Поскольку при раздражении блуждающего нерва в его окончаниях выделяется медиатор — ацетилхолин, при его взаимодействии с мускариночувствительными рецепторами сердца повышается проницаемость поверхностной мембраны клеток водителей ритма для ионов калия. Вследствие этого возникает гиперполяризация мембраны, которая замедляет (подавляет) развитие медленной спонтанной диастолической деполяризации, и поэтому мембранный потенциал позже достигает критического уровня. Это приводит к урежению ритма сокращений сердца.
При сильных раздражениях блуждающего нерва диастолическая деполяризация подавляется, возникают гиперполяризация водителя ритма и полная остановка сердца. Развитие гиперполяризации в клетках водителей ритма снижает их возбудимость, затрудняет возникновение очередного автоматического потенциала действия и тем самым приводит к замедлению или даже остановке сердца. Стимуляция блуждающего нерва, усиливая выход калия из клетки, увеличивает мембранный потенциал, ускоряет процесс реполяризации и при достаточной силе раздражающего тока укорачивает длительность потенциала действия клеток водителя ритма.
При вагусных воздействиях имеет место уменьшение амплитуды и длительности потенциала действия кардиомиоцитов предсердия. Отрицательный инотропный эффект связан с тем, что уменьшенный по амплитуде и укороченный потенциал действия не способен возбудить достаточное количество кардиомиоцитов. Кроме того, вызванное ацетилхолином повышение калиевой проводимости противодействует потенциалзависимому входящему току кальция и проникновению его ионов внутрь кардиомиоцита. Холинергический медиатор ацетилхолин может также угнетать АТФ- азную активность миозина и, таким образом, уменьшать величину сократимости кардиомиоцитов. Возбуждение блуждающего нерва приводит к повышению порога раздражения предсердий, подавлению автоматии и замедлению проводимости атриовентрикулярного узла. Указанное замедление проводимости при холинергических влияниях может вызвать частичную или полную атриовентрикулярную блокаду.
Влияние симпатических нервов на сердце проявлется в виде положительного хронотропного и положительного инотропного эффекта. Сведения о наличии тонических влияний симпатической нервной системы на миокард основываются в основном на хронотропных эффектах.
Электрическая стимуляция волокон, отходящих от звездчатого ганглия, вызывает увеличение ритма сердца и силы сокращений миокарда (см. рис. 9.17). Под влиянием возбуждения симпатических нервов скорость медленной диастолической деполяризации повышается, снижается критический уровень деполяризации клеток водителей ритма синоатриального узла, уменьшается величина мембранного потенциала покоя. Подобные изменения увеличивают скорость возникновения потенциала действия в клетках водителей ритма сердца, повышают его возбудимость и проводимость. Эти изменения электрической активности связаны с тем, что выделяющийся из окончаний симпатических волокон медиатор норадреналин взаимодействует с Pj-адренорецепторами поверхностной мембраны клеток, что приводит к повышению проницаемости мембран для ионов натрия и кальция, а также уменьшению проницаемости для ионов калия.
Ускорение медленной спонтанной диастолической деполяризации клеток водителей ритма, увеличение скорости проведения в предсердиях, атриовентрикулярном узле и желудочках приводит к улучшению синхронности возбуждения и сокращения мышечных волокон и к увеличению силы сокращения миокарда желудочков. Положительный инотропный эффект связан также с повышением проницаемости мембраны для ионов кальция. При увеличении входящего тока кальция возрастает степень электромеханического сопряжения, в результате чего увеличивается сократимость миокарда.
Менее изучено участие в регуляции сердечной деятельности интракардиальных ганглиозных нервных элементов. Известно, что они обеспечивают передачу возбуждения с волокон блуждающего нерва на клетки синоатриального и атриовентрикулярного узлов, выполняя функцию парасимпатических ганглиев. Описаны инотропные, хронотропные и дромотропные эффекты, полученные при стимуляции этих образований в условиях эксперимента на изолированном сердце. Значение этих эффектов в естественных условиях остается неясным.
9.1.3.6.9. Механизмы адренергической
и холинергической регуляции деятельности сердца
Симпатические и парасимпатические нервы оказывают влияние на сердце посредством высвобождения нейромедиаторов, которые взаимодействуют с рецепторами, расположенными на наружной мембране миокардиальных клеток. К основным медиаторам, высвобождающимся из симпатических и парасимпатических терминалей, относят соответственно норадреналин и ацетилхолин. Норадреналин взаимодействует с адренорецепторами миокарда, а ацетилхолин — с холинорецепторами.
Адренергические механизмы. В сердце человека содержатся преимущественно pi- и в меньшей степени [32-адренорецепторы, а также al- и а2-ад- ренорецепторы. Поскольку [3-адренорецепторы расположены на поверхности миокардиальных клеток, это делает их легкодоступными как для норадреналина, высвобождающегося из симпатических нервных окончаний, так и для циркулирующего в крови адреналина.
При повышении активности симпатической нервной системы или концентрации катехоламинов в крови количество p-адренорецепторов на поверхности миокардиальной клетки уменьшается, тогда как в случае снижения симпатической активности их количество возрастает. Йодсодержащие гормоны щитовидной железы, особенно тироксин, а также гормон коры надпочечников кортизол увеличивают количество p-адренорецепторов в миокарде, что приводит к усилению эффектов катехоламинов на сердце.
Возбуждение p-адренорецепторов сердца приводит к росту частоты сокращений сердца, сократимости миокарда, значительному увеличению потребления им кислорода и уменьшению длительности диастолы.
Физиологические механизмы, связанные с активацией а(-адренорецепторов миокарда, известны в меньшей степени. а2-Адренорецепторы располагаются на пресинаптических мембранах симпатических и парасимпатических нервных окончаний, их возбуждение тормозит выделение норадреналина и ацетилхолина из нервных терминалей.
Холинергические механизмы. На наружной мембране кардиомиоцитов представлены, в основном, мускаринчувствительные (М-) холинорецепто- ры. Доказано наличие в миокарде и никотинчувствительных (N-) холино- рецепторов, однако их значение в парасимпатических влияниях на сердце менее ясно. Плотность мускариновых рецепторов в миокарде зависит от концентрации мускариновых агонистов в тканевой жидкости.
Возбуждение мускариновых рецепторов тормозит активность пейсме- керных клеток синусного узла и в то же время увеличивает возбудимость предсердных кардиомиоцитов. Эти два процесса могут привести к возникновению предсердных экстрасистол в случае повышения тонуса блуждающего нерва, например ночью во время сна. Таким образом, возбуждение М-холинорецепторов вызывает снижение частоты и силы сокращений предсердий, но повышает их возбудимость.
Ацетилхолин угнетает проводимость в атриовентрикулярном узле. Это связано с тем, что под влиянием ацетилхолина возникает гиперполяризация клеток атриовентрикулярного узла вследствие усиления выходящего калиевого тока.
Таким образом, возбуждение мускариновых холинорецепторов оказывает противоположное, по сравнению с активацией p-адренорецепторов, действие на сердце. При этом снижается частота сердечных сокращений, угнетается проводимость и сократимость миокарда, а также потребление миокардом кислорода. Возбудимость предсердий в ответ на применение ацетилхолина возрастает, тогда как возбудимость желудочков, напротив, уменьшается.
Рефлекторные влияния на сердце. Выделены три категории кардиальных рефлексов: собственные, вызываемые раздражением рецепторов сердечно-сосудистой системы; сопряженные, обусловленные активностью любых других рефлексогенных зон; неспецифические, которые воспроизводятся в ответ на неспецифические влияния (в условиях физиологического эксперимента, а также в патологии).
Наибольшее физиологическое значение имеют собственные рефлексы сердечно-сосудистой системы, которые возникают чаще всего при раздражении барорецепторов магистральных артерий в результате изменения системного давления. Так, при повышении давления в аорте и каротидном синусе происходит рефлекторное урежение частоты сердцебиения.
Особую группу собственных кардиальных рефлексов представляют те из них, которые возникают в ответ на раздражение артериальных хеморецепторов изменением напряжения кислорода в крови. В условиях гипоксемии развивается рефлекторная тахикардия, а при дыхании чистым кислородом — брадикардия. Эти реакции отличаются исключительно высокой чувствительностью: у человека увеличение частоты сердцебиений наблюдается уже при снижении напряжения кислорода всего на 3 %, когда никаких признаков гипоксии в организме обнаружить еще невозможно.
Собственные рефлексы сердца проявляются и в ответ на механическое раздражение сердечных камер, в стенках которых находится большое количество барорецепторов. К их числу относят рефлекс Бейнбриджа, проявляющийся в виде тахикардии в ответ на быстрое внутривенное введение определенного объема крови. Считается, что эта реакция сердца является рефлекторным ответом на раздражение барорецепторов полых вен и предсердия, поскольку она устраняется при денервации сердца. Отрицательные хронотропные и инотропные реакции сердца рефлекторной природы возникают в ответ на раздражение механорецепторов как правых, так и левых отделов сердца. Значение интракардиальных рефлексов состоит в том, что увеличение исходной длины волокон миокарда приводит к усилению сокращений не только растягиваемого отдела сердца (в соответствии с зако-

Рис. 9.18. Эфферентная иннервация сердца.
Гф — гипофиз; Гт — гипоталамус; Пм — продолговатый мозг; Цсд — бульбарный центр сердечно-сосудистой системы; К — кора больших полушарий; Гл — симпатические ганглии; См — спинной мозг; Th — грудные сегменты.
ном Франка—Старлинга), но и к усилению сокращений других отделов сердца, не подвергающихся растяжению.
Рефлексы с сердца изменяют функцию других висцеральных систем. К их числу относят, например, кардиоренальный рефлекс Генри—Гауэра, который представляет собой увеличение диуреза в ответ на растяжение стенки левого предсердия.
Собственные кардиальные рефлексы составляют основу нейрогенной регуляции деятельности сердца, хотя реализация его насосной функции возможна без участия нервной системы.
Сопряженные кардиальные рефлексы представляют собой эффекты раздражения рефлексогенных зон, не принимающих прямого участия в регуляции кровообращения. К числу таких рефлексов относят рефлекс Гольца, который проявляется в форме брадикардии (до полной остановки сердца) в ответ на раздражение механорецепторов брюшины или органов брюшной полости. Возможность проявления такой реакции учитывается при проведении оперативных вмешательств на брюшной полости, при нокауте у боксеров и т. д. При раздражении некоторых экстерорецепторов (резкое охлаждение кожи области живота) может иметь место рефлекторная остановка сердца. Именно такую природу имеют несчастные случаи при нырянии в холодную воду. Сопряженным соматовисцеральным кардиальным рефлексом является рефлекс Данини—Ашнера, который проявляется в виде брадикардии при надавливании на глазные яблоки. Таким образом, сопряженные рефлексы сердца, не являясь составной частью общей схемы нейрогенной регуляции, могут оказывать влияние на его деятельность.
Замыкание большинства кардиорефлекторных дуг происходит на уровне продолговатого мозга, где находятся: 1) ядро солитарного тракта, к которому подходят афферентные пути рефлексогенных зон сердечно-сосудистой системы; 2) ядра блуждающего нерва и 3) вставочные нейроны бульбарного кардиоваскулярного центра. В то же время реализация рефлекторных влияний на сердце в естественных условиях всегда происходит при участии вышележащих отделов центральной нервной системы (рис. 9.18). Существуют различные по знаку инотропные и хронотропные влияния на сердце со стороны мезэнцефальных адренергических ядер (голубое пятно, черная субстанция), гипоталамуса (паравентрикулярное и супраоптические ядра, мамиллярные тела) и лимбической системы. Имеют место и кортикальные влияния на сердечную деятельность, среди которых особое значение придают условным рефлексам — таким, например, как положительный хронотропный эффект при предстартовом состоянии. Достоверных данных о возможности произвольного управления человеком сердечной деятельностью не получено.
9.1.3.6.10. Гуморальные влияния на сердце
Прямое и опосредованное действие на сердце оказывают практически все биологически активные вещества, содержащиеся в плазме крови. В то же время круг фармакологических агентов, осуществляющих гуморальную регуляцию сердца, в подлинном смысле этого слова, достаточно узок. Такими веществами являются катехоламины, выделяемые мозговым веществом надпочечников — адреналин, норадреналин и дофамин. Действие этих гормонов опосредуется p-адренорецепторами кардиомиоцитов, что и определяет конечный результат их влияния на миокард. Он аналогичен симпатической стимуляции и заключается в активации фермента аденилатциклазы и усилении синтеза циклического АМФ (3,5-циклического аденозинмонофосфата), с последующей активацией фосфорилазы и повышением уровня энергетического обмена. Такое действие на пейсмекерную ткань вызывает положительный хронотропный, а на клетки рабочего миокарда — положительный инотропный эффекты. Усиливающим инотропный эффект действием катехоламинов является повышение проницаемости мембран кардиомиоцитов к ионам кальция.
Действие других гормонов (глюкагон, йодсодержащие гормоны щитовидной железы) на миокард неспецифическое и реализуется опосредованно, например через влияние на активность симпатоадреналовой системы. Положительное инотропное действие на сердце оказывают также гормоны коры надпочечников (кортикостероиды), вазопрессин и ангиотензин. Вместе с тем прямые положительные инотропные эффекты последних на сердце скрываются за их непрямыми эффектами, обусловленными повышением давления в аорте и увеличением объема циркулирующей крови.
В регуляции деятельности сердца принимают участие и местные гуморальные факторы, образующиеся в миокарде. К таким веществам относятся аденозин, гистамин и простагландины.
Аденозин, взаимодействуя с аденозиновыми рецепторами кардиомио
цитов, уменьшает пейсмекерную активность клеток синоатриального узла и снижает скорость проведения возбуждения в атриовентрикулярном узле и в проводящей системе сердца. Это свойство аденозина используется в клинической кардиологии — для лечения пароксизмальных желудочковых тахикардий применяются соли аденозинтрифосфорной кислоты.
В миокарде человека имеются два типа гистаминовых рецепторов: Н! и Н2. Активация этих рецепторов вызывает повышение сократимости миокарда. При возбуждении -рецепторов продолжительность потенциала действия кардиомиоцитов желудочков увеличивается, тогда как при возбуждении Н2-рецепторов она, напротив, уменьшается. Однако в случае массивного выброса в кровь гистамина (например, при анафилактическом шоке) происходит резкое снижение ОПСС, падение АД и, следовательно, постнагрузки сердца (давление в аорте, против которого происходит изгнание крови желудочками в систолу). В результате этих гемодинамических сдвигов сократимость миокарда снижается.
В миокарде синтезируются простагландины, которые могут уменьшать симпатические влияния на сердце и коронарные артерии. Синтез простагландинов увеличивается при ишемии миокарда и имеет в этом случае защитный характер.
Сердце проявляет чувствительность и к ионному составу протекающей крови. Катионы кальция повышают возбудимость клеток миокарда как за счет участия в сопряжении возбуждения и сокращения, так и за счет активации фосфорилазы. Повышение концентрации ионов калия по отношению к норме, составляющей 4 ммоль/л, приводит к снижению величины потенциала покоя и увеличению проницаемости мембран для этих ионов. Возбудимость миокарда и скорость проведения возбуждения при этом возрастают. Обратные явления, часто сопровождающиеся нарушениями ритма, имеют место при недостатке в крови калия, в частности в результате применения некоторых диуретических препаратов. Такие соотношения характерны для сравнительно небольших изменений концентрации катионов калия, при ее увеличении более чем в два раза возбудимость и проводимость миокарда резко снижаются. На этом эффекте основано действие кардиоплегических растворов, которые используются в кардиохирургии для временной остановки сердца. Угнетение сердечной деятельности наблюдается и при повышении кислотности внеклеточной среды.
Гормональная функция сердца. Вокруг миофибрилл в клетках миокарда предсердий обнаружены гранулы, подобные тем, которые имеются в щитовидной железе или аденогипофизе. В этих гранулах образуется группа гормонов, которые высвобождаются при растяжении предсердий, стойком повышении давления в аорте, нагрузке организма натрием, повышении активности блуждающих нервов. Отмечены следующие эффекты предсердных гормонов: а) снижение ОПСС, МОК и АД, б) увеличение гематокрита, в) увеличение клубочковой фильтрации и диуреза, г) угнетение секреции ренина, альдостерона, кортизола и вазопрессина, д) снижение концентрации в крови адреналина, е) уменьшение освобождения норадреналина при возбуждении симпатических нервов. Подробнее см. главу 6.
9.1.3.7. Венозный возврат крови к сердцу
Этим термином обозначают объем венозной крови, протекающей по верхней и нижней (у животных, соответственно, по передней и задней) полым венам.
Количество крови, протекающей за единицу времени через артерии и
Таблица 9.4. Комплекс факторов, участвующих в формировании величины венозного возврата

вены, в устойчивом режиме функционирования системы кровообращения остается постоянным, поэтому в норме величина венозного возврата равна величине минутного объема крови, т. е. 4—6 л/мин у человека. Однако вследствие перераспределения массы крови от одной области к другой это равенство может временно нарушаться при переходных процессах в системе кровообращения, вызываемых различными воздействиями на организм как в норме (например, при мышечных нагрузках или перемене положения тела), так и при развитии патологии сердечно-сосудистой системы (например, недостаточности правых отделов сердца).
Величина общего или суммарного венозного возврата между полыми венами как у животных, так и у человека состоит примерно из ’/3 объемного кровотока по верхней (или передней) полой вене и 2/3 — по нижней (или задней) полой вене. Величина кровотока у людей в верхней полой вене составляет примерно 42 %, а в нижней полой вене — 58 % общей величины венозного возврата.
Факторы, участвующие в формировании величины венозного возврата, условно делят на две группы (табл. 9.4) в соответствии с направлением действия сил, способствующих продвижению крови по сосудам большого круга кровообращения.
Первую группу представляет сила «vis a tergo» (т. е. действующая сзади), сообщаемая крови сердцем; она продвигает кровь по артериальным сосудам и участвует в обеспечении ее возврата к сердцу. Если в артериальном русле эта сила соответствует давлению 100 мм рт. ст., то в начале венул общее количество энергии, которой обладает кровь, прошедшая через капиллярное русло, составляет около 13 % от ее начальной энергии. Именно последняя величина энергии и образует «vis a tergo» и расходуется на приток венозной крови к сердцу. К силе, действующей «vis a tergo», относят также ряд других факторов, способствующих продвижению крови к сердцу: сокращения скелетной мускулатуры (так называемый мышечный насос), способствующие «выжиманию» крови из вен; функционирование венозных клапанов (препятствующих обратному току крови); влияние уровня гидростатического давления в системе кровообращения (особенно в вертикальном положении тела).
Ко второй группе факторов, участвующих в венозном возврате, относят силы, действующие на кровоток в полых венах «vis a fronte» (т. е. спереди) и включающие, прежде всего, присасывающую функцию грудной клетки и сердца. Присасывающая функция грудной клетки обеспечивает поступление крови из периферических вен в грудные вследствие существования отрицательного давления в плевральной полости: во время вдоха отрицательное давление в последней еще более снижается, что приводит к ускорению кровотока в нижней полой вене, а во время выдоха давление, напротив, относительно исходного несколько возрастает и кровоток в этой вене замедляется. Для присасывающей функции правых отделов сердца характерно то, что силы, способствующие поступлению в него крови, развиваются не только во время диастолы сердца (вследствие понижения давления в правом предсердии), но также и во время систолы (в результате смещения атриовентрикулярного кольца увеличивается объем предсердия и быстрое падение в нем давления способствует наполнению сердца кровью из полых вен). Однако не все исследователи разделяют мнение о важной роли присасывающей функции грудной клетки и правой половины сердца в формировании величины венозного возврата.
Наряду с этим важное значение имеют взаимоотношения встречных потоков по полым венам, которые при переходных процессах в системе могут изменяться неоднократно, а также констрикторные реакции венозных сосудов, проявляющиеся при действии на систему кровообращения нейрогенных или гуморальных стимулов; изменения транскапиллярного обмена жидкости, обеспечивающие ее переход из интерстиция в кровоток вен.
Повышение артериального давления сопровождается возрастанием величины венозного возврата, что проявляется при прессорных рефлексах (синокаротидном — вызываемом снижением давления в каротидных синусах, при стимуляции афферентных волокон соматических нервов), увеличении объема циркулирующей крови, внутривенном введении вазоактивных веществ (адреналин, норадреналин, простагландин Р2, ангиотензин II). Гормон задней доли гипофиза вазопрессин вызывает на фоне повышения артериального давления уменьшение венозного возврата.
Депрессорные системные изменения могут сопровождаться как уменьшением венозного возврата, так и возрастанием его величины. Совпадение направленности системной реакции с изменениями венозного возврата имеет место при депрессорном синокаротидном рефлексе (повышении давления в каротидных синусах), в ответ на ишемию миокарда, при уменьшении объема циркулирующей крови. Системная депрессорная реакция может сопровождаться и возрастанием притока крови к сердцу по полым венам, как это наблюдается, например, при гипоксии (дыхание газовой смесью с пониженным до 6—10 % содержанием в ней О2), гиперкапнии (6 % СО2), введении в сосудистое русло ацетилхолина, стимулятора р-адренорецепто- ров изопротеренола, местного гормона брадикинина, проста-гландина Е,.
Степень увеличения суммарного венозного возврата крови к сердцу при применении различных препаратов (или нервных влияний на систему) определяется не только величиной, но и направленностью изменений кровотока в каждой из полых вен. Кровоток по передней полой вене у животных
100 -I
|
|
| 70 |
| Рис. 9.19. Разнонаправленные изменения венозного возврата по передней и задней полым венам при прессорном рефлексе. Сверху вниз: системное артериальное давление (мм рт. ст.), кровоток по передней полой вене, кровоток по задней полой вене, отметка времени (10 с), отметка раздражения. Исходная величина кровотока по передней полой вене — 52 мл/мин, по задней полой вене — 92,7 мл/мин. |
в ответ на введение вазоактивных веществ (любой направленности действия) или при нейрогенных стимулах всегда увеличивается. Различная направленность изменений кровотока отмечена только в задней полой вене (рис. 9.19). Эта разнонаправленность изменений кровотока в полых венах и является фактором, обусловливающим относительно небольшое увеличение общего венозного возврата сравнительно с его изменениями при однонаправленных сдвигах кровотоков в полых венах.
Механизм разнонаправленных сдвигов кровотока в полых венах состоит в том, что в результате преобладающего влияния вазоконстрикторных препаратов на артериолы имеет место большая степень увеличения сопротивления сосудов бассейна брюшной аорты по сравнению с изменениями сопротивления сосудов бассейна плечеголовной артерии. Это приводит к перераспределению сердечного выброса между указанными сосудистыми руслами (увеличение доли сердечного выброса в направлении сосудов бассейна плечеголовной артерии и уменьшение — в направлении бассейна брюшной аорты) и вызывает соответствующие разнонаправленные изменения кровотока в полых венах.
Помимо вариабельности кровотока в задней полой вене, зависящей от гемодинамических факторов, на его величину оказывают существенное влияние другие системы организма (дыхательная, мышечная, нервная). Так, перевод животного на искусственное дыхание почти в 2 раза уменьшает кровоток по задней полой вене, а наркоз и открытая грудная клетка еще в большей степени снижают его величину.
Спланхническое сосудистое русло в результате изменений находящегося в нем объема крови вносит наибольший вклад (по сравнению с другими регионами системы кровообращения) в величину венозного возврата. Изменения емкости отдельных сосудистых регионов спланхнического русла неодинаковы, и их вклад в обеспечение венозного возврата различен. Например, при прессорном синокаротидном рефлексе имеет место уменьшение объема селезенки на 2,5 мл/кг массы тела, объема печени — на 1,1 мл/кг, а кишечника — лишь на 0,2 мл/кг (в целом спланхнический объем уменьшается на 3,8 мл/кг). Во время умеренной геморрагии (9 мл/кг) выброс крови из селезенки составляет 3,2 мл/кг (35 %), из печени — 1,3 мл/кг (14 %) и из кишечника — 0,6 мл/кг (7 %), что в сумме составляет 56 % величины изменений общего объема крови в организме.
Указанные изменения емкостной функции сосудов органов и тканей организма участвуют в величине венозного возврата крови к сердцу за счет сдвигов кровотока в нижней полой вене и, тем самым, в преднагрузке сердца (т. е. конечно-диастолическое давление), и в результате оказывают влияние на формирование величины сердечного выброса и уровня системного артериального давления.
9.1.3.8. Центральное венозное давление
Под центральным венозным давлением обычно понимают величину давления в правом предсердии, которая в норме близка к 0 мм рт. ст. Однако в действительности центральному венозному давлению соответствует величина давления в устье полых вен. Между давлением в правом предсердии и в устье полых вен далеко не всегда существует соответствие, особенно в фазу переходных процессов в системе кровообращения, когда давление в правом предсердии нормализуется быстрее, чем центральное венозное давление. Уровень центрального венозного давления (ЦВД) оказывает существенное влияние на величину венозного возврата крови к сердцу. При понижении давления в правом предсердии от 0 до 4 мм рт. ст. приток венозной крови возрастает на 20—30 %, но когда давление в нем становится ниже — 4 мм рт. ст., дальнейшее снижение давления не вызывает уже увеличения притока венозной крови, что обусловлено спадением вен, впадающих в грудную клетку, вызванным резким падением давления крови в этих венах. Если снижение ЦВД увеличивает приток венозной крови к сердцу по полым венам, то его повышение на 1 мм рт. ст. снижает венозный возврат примерно на 14 %. Исходя из сказанного, повышение давления в правом предсердии до 7 мм рт. ст. должно снизить приток венозной крови к сердцу до нуля, что привело бы к катастрофическим нарушениям гемодинамики.
Однако в исследованиях, в которых сердечно-сосудистые рефлексы функционировали, а давление в правом предсердии повышалось медленно, приток венозной крови к сердцу продолжался и при повышении давления в правом предсердии до 12—14 мм рт. ст. (рис. 9.20). Снижение притока
Рис. 9.20. Венозный возврат крови к сердцу при медленном подъеме давления в правом предсердии (когда успевают развиться компенсаторные механизмы).
крови к сердцу в этих условиях приводит к проявлению в системе компенсаторных рефлекторных реакций, возникающих при раздражении барорецепторов артериального русла, а также возбуждению сосудодвигательных центров в условиях развивающейся ишемии центральной нервной системы. Это вызывает увеличение потока импульсов, генерируемых в симпатических сосудосуживающих центрах и поступающих к гладким мышцам сосудов, что определяет повышение тонуса, уменьшение емкости периферического сосудистого русла и, следовательно, увеличение количества крови, подаваемой к сердцу, несмотря на рост ЦВД до уровня, когда теоретически венозный возврат должен быть близким к 0.
Определены минимальные и максимальные пределы изменений ЦВД, ограничивающие область устойчивой работы сердца. Минимально допустимое среднее давление в правом предсердии составляет 5—10, а максимальное — 100—120 мм водн. ст., при выходе за эти пределы ЦВД зависимость энергии сокращения сердца от величины притока крови не наблюдается из-за необратимого ухудшения функционального состояния миокарда.
Средняя величина ЦВД у здоровых людей составляет в состоянии мышечного покоя около 40 мм водн. ст. и в течение дня меняется, нарастая днем и особенно к вечеру на 10—30 мм водн. ст., что связано с ходьбой и мышечными движениями. Увеличение внутриплеврального давления, сопровождаемое сокращением мышц брюшной полости (кашель, натужива- ние), приводит к кратковременному резкому возрастанию ЦВД, а задержка дыхания на вдохе — к его временному падению.
При вдохе ЦВД уменьшается за счет падения плеврального давления, что вызывает дополнительное растяжение правого предсердия и более полное заполнение его кровью. При этом возрастает скорость венозного кровотока и увеличивается градиент давления в венах, что приводит к дополнительному падению ЦВД. Так как давление в венах, лежащих вблизи грудной полости (например, в яремных венах), в момент вдоха является отрицательным, их ранение опасно для жизни, поскольку при вдохе в этом случае возможно проникновение в вены воздуха, пузырьки которого, разносясь с кровью, могут закупорить кровеносное русло (развитие воздушной эмболии).
При выдохе ЦВД растет, а венозный возврат крови к сердцу уменьшается. Это является результатом повышения плеврального давления, увеличивающего венозное сопротивление вследствие спадения грудных вен и сдавливающего правое предсердие, что затрудняет его кровенаполнение.
Для увеличения производительности сердца в клинике часто используют искусственное повышение венозного возврата за счет увеличения объема циркулирующей крови, которое достигается путем внутривенных вливаний кровезаменителей. Однако вызываемое этим повышение давления в правом предсердии эффективно только в пределах соответствующих величин средних давлений, приведенных выше. Чрезмерное повышение венозного притока таким способом и, следовательно, ЦВД не только не способствует улучшению деятельности сердца, но может принести и вред, создавая перегрузки в системе и приводя, в конечном итоге, к чрезмерному расширению правой половины сердца.
9.1.3.9. Объем циркулирующей крови
Объем крови у мужчины массой 70 кг составляет примерно 5,5 л (75— 80 мл/кг), у взрослой женщины он несколько меньше (около 70 мл/кг). Объем крови колеблется в зависимости от пола, возраста, телосложения, условий жизни, степени физического развития и тренированности организма и составляет от 50 до 80 мл на 1 кг массы тела. У здорового человека, находящегося в лежачем положении 1—2 нед, объем крови может снизиться на 9—15 % от исходного.
Из 5,5 л крови у взрослого мужчины 55—60 %, т. е. 3,0—3,5 л, приходится на долю плазмы, остальное количество — на долю эритроцитов. В течение суток по сосудам циркулирует около 8000—9000 л крови. Из этого количества приблизительно 20 л выходит в течение суток из капилляров в ткань в результате фильтрации и возвращается вновь (путем абсорбции) через капилляры (16—18 л) и с лимфой (2—4 л). Объем жидкой части крови, т. е. плазмы (3—3,5 л), существенно меньше, чем объем жидкости во внесосудистом интерстициальном пространстве (9—12 л) и во внутриклеточном пространстве тела (27—30 л); с жидкостью этих «пространств» плазма находится в динамическом осмотическом равновесии.
Общий объем циркулирующей крови (ОЦК) состоит из активно циркулирующей крови по сосудам и той ее части, которая не участвует в данный момент в кровообращении, т. е. депонированной (в селезенке, печени, почке, легких и др.). Последняя может быстро включаться в циркуляцию при соответствующих гемодинамических ситуациях. Количество депонируемой крови более чем в два раза превышает объем циркулирующей. Депонированная кровь не находится в состоянии полного застоя, некоторая ее часть все время включается в циркуляцию, а соответствующая часть быстро движущейся крови переходит в состояние депонирования.
Уменьшение или увеличение объема циркулирующей крови на 5—10 % у человека с нормальным объемом крови компенсируется изменением емкости венозного русла и не вызывает сдвигов ЦВД. Более значительное увеличение ОЦК обычно сопряжено с увеличением венозного возврата и при сохранении эффективной сократимости сердца приводит к увеличению сердечного выброса.
Важнейшими факторами, от которых зависит объем крови, являются: 1) регуляция объема жидкости между плазмой и интерстициальным пространством, 2) регуляция обмена жидкости между плазмой и внешней средой (осуществляется, главным образом, почками), 3) регуляция объема эритроцитной массы. Нервная регуляция этих трех механизмов осуществляется с помощью предсердных рецепторов типа А, реагирующих на изменение давления и, следовательно, являющихся барорецепторами, и типа В — реагирующих на растяжение предсердий и весьма чувствительных к изменению объема в них крови.
Существенное влияние на объем крови оказывает инфузия различных растворов. Вливание в вену изотонического раствора хлорида натрия не повышает длительно объем плазмы на фоне нормального объема крови, так как образующийся в организме избыток жидкости быстро выводится путем усиления диуреза. При дегидратации и дефиците солей в организме указанный раствор, введенный в кровь в адекватных количествах, быстро восстанавливает нарушенное равновесие. Внутривенное введение растворов высокомолекулярных декстранов на длительный период (до 12—24 ч) повышает объем циркулирующей крови.
9.1.3.10. Соотношение основных параметров системной гемодинамики
Параметры системной гемодинамики — системное артериальное давление, периферическое сопротивление сосудов, сердечный выброс, работа сердца, венозный возврат, центральное венозное давление, объем цирку-
Таблица 9.5. Первичные и компенсаторные изменения в системе кровообращения человека при переходе из горизонтального положения в вертикальное
| Первичные изменения | Компенсаторные изменения |
| Дилатация сосудистого русла нижней половины тела как результат повышения внутрисосудистого давления. Уменьшение венозного притока к правому предсердию. Уменьшение сердечного выброса Снижение общего периферического сопротивления. | Рефлекторная веноконстрикция, ведущая к уменьшению емкости вен и увеличению венозного притока к сердцу. Рефлекторное увеличение частоты сердечных сокращений, ведущее к увеличению сердечного выброса. Повышение тканевого давления в нижних конечностях и насосного действия мышц ног, рефлекторная гипервентиляция и увеличение напряжения брюшных мышц: увеличение венозного притока к сердцу. |
| Снижение систолического, диастолического, пульсового и среднего артериального давления. Снижение мозгового кровотока | Снижение сопротивления мозговых сосудов. Увеличение секреции норадреналина, альдостерона, антидиуретического гормона, вызывающего как увеличение сосудистого сопротивления, так и гиперволемию. |
лирующей крови — находятся в сложных тонко регулируемых взаимоотношениях, что позволяет системе обеспечивать выполнение своих функций. Так, снижение давления в синокаротидной зоне вызывает повышение системного артериального давления, учащение сердечного ритма, увеличение общего периферического сопротивления сосудов, работы сердца и венозного возврата крови к сердцу. Минутный и систолический объем крови могут меняться при этом неоднозначно. Повышение давления в синокаротидной зоне вызывает снижение системного артериального давления, замедление частоты сердечных сокращений, снижение общего сосудистого сопротивления и венозного возврата, уменьшение работы сердца. Изменения сердечного выброса при этом выражены, но неоднозначны по направленности.
Переход из горизонтального положения человека в вертикальное сопровождается последовательным развитием характерных изменений системной гемодинамики. Эти сдвиги включают в себя как первичные, так и вторичные компенсаторные изменения в системе кровообращения, которые схематически представлены в табл. 9.5.
Важным является поддержание постоянного соотношения между объемом крови, содержащейся в большом круге кровообращения, и объемом крови, находящейся в органах грудной клетки (легкие, полости сердца). В сосудах легких содержится до 15 %, а в полостях сердца (в фазе диастолы)—до 10% всей массы крови; исходя из сказанного, центральный (внутригрудной) объем крови может составлять до 25 % общего количества крови в организме.
Растяжимость сосудов малого круга, в особенности легочных вен, позволяет аккумулировать в этой области значительный объем крови при увеличении венозного возврата к правой половине сердца. Аккумуляция крови в малом круге имеет место у людей во время перехода тела из вертикального положения в горизонтальное, при этом в сосуды грудной полости из нижних конечностей может перемещаться до 600 мл крови, из которых примерно половина скапливается в легких. Напротив, при переходе тела в вертикальное положение этот объем крови переходит в сосуды нижних конечностей.
Резерв крови в легких используется, когда необходима срочная мобилизация дополнительного количества крови для поддержания должной величины сердечного выброса. Это особенно важно в начале интенсивной мышечной работы, когда, несмотря на включение мышечного насоса, венозный возврат к сердцу еще не достигает уровня, обеспечивающего сердечный выброс в соответствии с кислородным запросом организма.
Одним из источников, обеспечивающих резерв сердечного выброса, является также остаточный объем крови в полости желудочков. В горизонтальном положении человека остаточный объем левого желудочка составляет в среднем 100 мл, а в вертикальном — 45 мл. Близкие к этим величины характерны и для правого желудочка. Увеличение ударного объема, наблюдаемое при мышечной работе или действии катехоламинов, не сопровождающееся увеличением размеров сердца, происходит за счет мобилизации, главным образом, части остаточного объема крови в полости желудочков.
Таким образом, наряду с изменениями венозного возврата к сердцу, к числу факторов, определяющих динамику сердечного выброса, относятся: объем крови в легочном резервуаре, реактивность сосудов легких и остаточный объем крови в’желудочках сердца.
Совместное проявление гетеро- и гомеометрического типов регуляции сердечного выброса выражается в такой последовательности: а) увеличение венозного возврата к сердцу, обусловленное констрикцией артериальных и особенно венозных сосудов в системе циркуляции, ведет к увеличению сердечного выброса; б) последнее, наряду с ростом общего периферического сопротивления сосудов, повышает системное АД; в) это соответственно ведет к увеличению давления в аорте и, следовательно, кровотока в коронарных сосудах; г) гомеометрическая регуляция сердца, основанная на последнем механизме, обеспечивает преодоление сердечным выбросом возросшего сопротивления в аорте и поддержание сердечного выброса на повышенном уровне; д) увеличение сократительной функции сердца вызывает рефлекторное снижение периферического сопротивления сосудов (одновременно с проявлением рефлекторных влияний на периферические сосуды с барорецепторов синокаротидных зон), что способствует уменьшению работы сердца, затрачиваемой на обеспечение необходимого кровотока и давления в капиллярах.
Увеличение количества циркулирующей крови в организме изменяет минутный объем крови, главным образом, вследствие повышения степени наполнения кровью сосудистой системы. Это вызывает усиление притока крови к сердцу, увеличение его кровенаполнения, повышение центрального венозного давления и, следовательно, интенсивности работы сердца. Изменение количества крови в организме влияет на величину минутного объема крови также путем изменения сопротивления притока венозной крови к сердцу, которое находится в обратно пропорциональной зависимости от объема крови, притекающей к сердцу. Между объемом циркулирующей крови и величиной среднего системного давления существует прямая пропорциональная зависимость. Однако повышение последнего, возникающее при остром увеличении объема крови, продолжается около 1 мин, после чего оно начинает снижаться и устанавливается на уровне, лишь немного превосходящем норму. Если объем циркулирующей крови уменьшается, величина среднего давления временно падает и возникающий эффект в сердечно-сосудистой системе прямо противоположен повышению среднего давления при увеличении объема крови.
Возвращение величины среднего давления к исходному уровню является результатом включения компенсаторных механизмов. Известны три из них, которые выравнивают сдвиги, возникающие при изменении объема циркулирующей крови в сердечно-сосудистой системе: 1) рефлекторные компенсаторные механизмы; 2) непосредственные реакции сосудистой стенки; 3) нормализация объема крови в системе.
Рефлекторные механизмы связаны с изменением уровня системного артериального давления, обусловленным влиянием с барорецепторов сосудистых рефлексогенных зон. Однако удельный вес этих механизмов сравнительно небольшой. В то же время при сильном кровотечении возникают другие очень мощные нервные влияния, которые могут привести к компенсаторным сдвигам этих реакций в результате ишемии центральной нервной системы. Так, снижение системного артериального давления ниже 55 мм рт. ст. вызывает изменения гемодинамики, которые в 6 раз превышают сдвиги, возникающие при максимальной стимуляции симпатической нервной системы через сосудистые рефлексогенные зоны. Таким образом, нервные влияния, возникающие при ишемии центральной нервной системы, могут играть чрезвычайно важную роль в качестве «последней линии обороны», предотвращающей резкое снижение минутного объема крови в терминальных состояниях организма после массивной кровопотери и значительного падения артериального давления.
Компенсаторные реакции самой сосудистой системы возникают вследствие ее способности растягиваться при повышении давления крови и спадаться, когда давление крови снижается. В наибольшей мере этот эффект присущ венозным сосудам. Считается, что указанный механизм является более действенным, нежели нервный, особенно при сравнительно небольших изменениях давления крови. Главное различие этих механизмов состоит в том, что рефлекторные компенсаторные реакции включаются в действие через 4—5 с и достигают максимума через 30—40 с, в то время как расслабление самой сосудистой стенки, возникающее в ответ на усиление ее напряжения, лишь начинается в этот период, достигая максимума через минуты или десятки минут.
Нормализация объема крови в системе в случае ее изменений достигается следующим образом. После переливания больших объемов крови давление во всех сегментах сердечно-сосудистой системы, включая капилляры, повышается, что приводит к фильтрации жидкости через стенки капилляров в интерстициальные пространства и через капилляры клубочков почек в мочу. При этом величины системного давления, периферического сопротивления и минутного объема крови возвращаются к исходным значениям.
В случае кровопотери возникают противоположные сдвиги. При этом большое количество белка из межклеточной жидкости поступает через лимфатическую систему в сосудистое русло, повышая уровень белков плазмы крови. Кроме того, значительно возрастает количество белков, образующихся в печени, что также приводит к восстановлению уровня белков плазмы крови. Одновременно нормализуется объем плазмы, компенсирующий сдвиги, возникающие вследствие кровопотери. Восстановление объема крови до нормы является медленным процессом, но тем не менее через 24—48 ч у человека объем крови становится нормальным, в результате нормализуется и гемодинамика. Долгосрочная нормализация объема циркулирующей крови осуществляется гормонами эндокринной системы (ренин-альдостероновая, АДГ).
Следует особо подчеркнуть, что ряд параметров системной гемодинами-
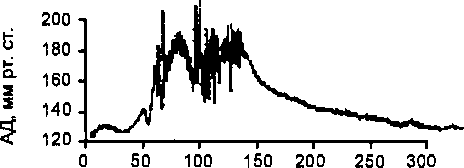


| Время, с |
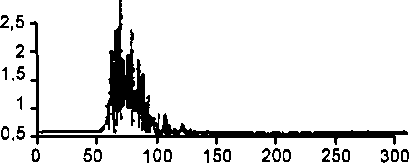
| Время, с |

| О 50 100 150 200 250 300 |

| Время, с |
| Рис. 9.21. Соотношение параметров системной гемодинамики при внутривенном введении норадреналина (10 мкг/кг). |

| Время, с |
АД — артериальное давление; ВВ — суммарный венозный возврат; ОПС — общее периферическое сопротивление; ПГА —кровоток по плечеголовной артерии; ППВ —кровоток по передней полой вене; ЦВД — центральное венозное давление; СВ — сердечный выброс; УО — ударный объем сердца; НГА — кровоток по грудной аорте; ЗПВ — кровоток по задней полой вене.
ки или их взаимоотношений у человека в настоящее время практически невозможно исследовать, особенно в динамике развития реакций в сердечно-сосудистой системе. Это связано с тем, что человек не может быть объектом экспериментирования, а число датчиков для регистрации величин указанных параметров, даже в условиях торакальной хирургии, явно недостаточно для выяснения этих вопросов, тем более в условиях нормального функционирования системы. Поэтому изучение сдвигов всего комплекса параметров системной гемодинамики и механизмов их регуляции возможно в настоящее время только у животных.
В результате сложнейших технических подходов, использования специальных датчиков, применения физических, математических и кибернетических приемов сегодня можно представить изменения параметров системной гемодинамики количественно, в динамике развития процесса у одного и того же животного (рис. 9.21). Как следует из рисунка, однократное внутривенное введение норадреналина вызывает значительное повышение артериального давления, не соответствующее ему по длительности — кратковременное повышение общего периферического сопротивления сосудов и соответствующее ему увеличение центрального венозного давления. Сердечный выброс и ударный объем сердца при этом в момент повышения периферического сопротивления снижаются, а затем — резко возрастают, соответствуя во второй фазе сдвигам артериального давления. Кровоток в плечеголовной и грудной аорте изменяется соответственно сердечному выбросу, хотя в последней эти сдвиги более выражены (очевидно, в связи с высоким исходным кровотоком). Венозный возврат крови к сердцу, естественно, соответствует по фазам сердечному выбросу, однако в передней полой вене он увеличивается, а в задней — вначале снижается, потом несколько возрастает. Вот эти сложные, взаимоподкрепленные сдвиги параметров системной гемодинамики и обусловливают повышение ее интегрального показателя — артериального давления.
Изучение соотношения венозного возврата и сердечного выброса при применении прессорных вазоактивных веществ (адреналин, норадреналин, ангиотензин) показало, что при качественно единообразном изменении венозного возврата, который в этих случаях, как правило, увеличивается, характер сдвигов сердечного выброса варьирует: он может как увеличиваться, так и уменьшаться, При этом имеют место два основных варианта различий между этими параметрами: дефицит величины сердечного выброса по сравнению с величиной притока крови к сердцу по полым венам и избыток сердечного выброса над величиной венозного возврата. На основании данных о депонирующей функции сосудов малого круга кровообращения можно полагать, что первый вариант различий между сердечным выбросом и венозным возвратом обусловлен депонированием крови в малом круге, а второй — дополнительным выбросом крови из малого в большой круг кровообращения.
9.1.4. Общие закономерности органного кровообращения
9.1.4.1. Функционирование органных сосудов
Под тонусом органа, ткани, сосуда или клетки понимают состояние длительно поддерживаемого возбуждения, выражающегося специфической для этого образования деятельностью, без развития утомления.
Сосудистый тонус создается в своей основе периферическими механизмами, а нервные импульсы корригируют его, обеспечивая перераспределение крови между различными сосудистыми областями.
Регионарное кровообращение — термин, принятый для характеристики движения крови в органах и системе органов, относящихся к области тела (региону). На уровне органа или региона могут быть определены такие параметры, как величина и скорость кровотока; давление крови в артерии, капилляре, венуле; сопротивление кровотоку в различных отделах органного сосудистого русла; объем крови в органе. Именно эти параметры, характеризующие движение крови по сосудам органа, и подразумеваются, когда используют термин «органное кровообращение».
Согласно формуле Пуазейля скорость кровотока в сосудах определяется (помимо нервных и гуморальных влияний) соотношением пяти местных факторов: упомянутого в начале главы градиента давления (который зависит от артериального давления и венозного давления) и рассмотренного выше сопротивления сосудов (которое зависит от радиуса сосуда, длины сосуда, вязкости крови).
Повышение давления в артерии органа ведет к увеличению градиента давления и, следовательно, к увеличению кровотока в нем. Снижение артериального давления вызывает замедление кровотока. Повышение давления в вене влечет за собой уменьшение градиента давления, в результате чего кровоток уменьшается. При снижении венозного давления градиент давления увеличится, что будет способствовать увеличению кровотока.
Изменения радиуса сосудов могут происходить активно и пассивно. Изменения радиуса сосуда, которые возникают не в результате изменений сократительной активности их гладких мышц, являются пассивными. Последние могут быть следствием как интраваскулярных, так и экстравас- кулярных факторов.
Интраваскулярным фактором, вызывающим в организме пассивные изменения просвета сосуда, является внутрисосудистое давление. Повышение артериального давления вызывает пассивное расширение просвета сосудов, которое может даже нивелировать активную констрикторную реакцию артериол в случае их малой выраженности. Аналогичные пассивные реакции могут возникать в венах при изменении венозного давления.
Экстраваскулярные факторы, способные вызвать пассивные изменения просвета сосудов, присущи не всем сосудистым областям и зависят от специфической функции органа. Так, сосуды сердца могут пассивно изменять свой просвет в результате: а) изменений частоты сердечных сокращений, б) степени напряжения сердечной мышцы при ее сокращениях, в) изменений внутрижелудочкового давления. Бронхомоторные реакции влияют на просвет легочных сосудов, а двигательная или тоническая активность отделов желудочно-кишечного тракта или скелетной мускулатуры изменит просвет сосудов этих областей. Следовательно, степень сжатия сосудов внесосудистыми элементами может определить величину их просвета.
Активными реакциями сосудов обозначаются те из них, которые возникают в результате сокращения гладкой мускулатуры стенки сосуда. Многие стимулы вызывают активные изменения просвета сосудов. К их числу относятся, прежде всего, физические, нервные и химические влияния.
Одним из физических факторов является внутрисосудистое давление, изменения которого сказываются на степени напряжения (сокращения) гладкой мускулатуры сосудов. Так, повышение внутрисосудистого давления влечет за собой увеличение сокращения гладких мышц сосудов, и наоборот, его снижение вызывает уменьшение напряжения сосудистых мышц (эффект Остроумова—Бейлисса). Этот механизм обеспечивает ауторегуляцию кровотока в сосудах.
Под ауторегуляцией кровотока понимают тенденцию к сохранению его величины в органных сосудах. Это, конечно, не значит, что при резких изменениях артериального давления (от 70 до 200 мм рт. ст.) органный кровоток сохраняется постоянным. Речь идет о том, что указанные сдвиги ар-
Таблица 9.6. Регионарные особенности ауторегуляции кровотока и постокклюзионной (реактивной) гиперемии
| Регион | Ауторегуляция кровотока при изменениях артериального давления | Реактивная гиперемия | ||
| пороговая длительность окклюзии | максимальная кратность увеличения кровотока | основной фактор развития | ||
| Мозг ♦ | Хорошо выражена, Дс« 80-160 | 3-5 с | 1,5-2 | Механизм реагирования на растяжение |
| Миокард | Хорошо выражена, дс « 75-140 | 2-20 с | 2-3 | Аденозин, ионы калия и др. |
| Скелетные мышцы | Выражена при высоком исходном тонусе сосудов, Дс ~ 50—100 | 1-2 с | 1,5-4 | Механизм реагирования на растяжение, метаболические факторы, недостаток О2 |
| Кишечник | По общему кровотоку не столь четко выражена. В слизистой оболочке выражена полнее, Дс^ 40-125 | 30-120 с | 1,5—2 | Метаболиты. Местные гормоны |
| Печень | Не обнаружена. | Не изучена | Слабо выражена. Гиперемия, вторая фаза реакции на окклюзию артерии. | Простагландины |
| Кожа | ? | 0,5- 6 мин | 1,5-4 | Метаболиты |
Примечание. Д. — диапазон величин артериального давления (мм рт.ст.), в котором стабилизируется кровоток.
термального давления вызывают меньшие изменения кровотока, чем они могли бы быть в пассивно-эластической трубке.
Ауторегуляция кровотока высокоэффективна в сосудах почек и мозга (изменения давления в этих сосудах почти не вызывают сдвигов кровотока), несколько меньше — в сосудах кишечника, умеренно эффективна — в миокарде, относительно неэффективна — в сосудах скелетных мышц и весьма слабо эффективна — в легких (табл. 9.6).
Несколько теорий объясняют механизм ауторегуляции кровотока: а) миогенная, признающая за основу передачу возбуждения по гладкомышечным клеткам; б) нейрогенная, предполагающая взаимодействие между гладкомышечными клетками и рецепторами в сосудистой стенке, чувствительными к изменению внутрисосудистого давления; в) теория тканевого давления, основывающаяся на данных о сдвигах капиллярной фильтрации жидкости при изменении давления в сосуде; г) обменная теория, предполагающая зависимость степени сокращения гладких мышц сосудов от обменных процессов (сосудоактивных веществ, выделяющихся в кровоток в процессе метаболизма).
Физическим фактором, также способным изменять просвет сосудов, является температура. На повышение температуры крови сосуды внутренних органов отвечают расширением, но на повышение температуры окружающей среды — сужением, сосуды же кожи при этом расширяются.
Длина сосуда в большинстве регионов относительно постоянна, од-
нако в органах, выполняющих периодическую или ритмичную деятельность (легкие, сердце, желудочно-кишечный тракт), длина сосуда может играть роль в изменениях сопротивления сосудов и кровотока в них. Так, например, увеличение объема легких (на вдохе) вызывает повышение сопротивления легочных сосудов как в результате их сужения, так и удлинения. В этом случае изменения длины сосуда участвуют в дыхательных вариациях легочного кровотока.
Вязкость крови также влияет на кровоток в сосудах. При высоком показателе гематокрита сопротивление кровотоку может быть значительным.
Сосуды, лишенные нервных и гуморальных влияний, как оказалось, со- 1 храняют (хотя и в меньшей мере) способность оказывать сопротивление кровотоку. Денервация сосудов скелетных мышц, например, увеличивает кровоток в них примерно в два раза, но последующее введение ацетилхолина в кровоток этой сосудистой области может вызвать дальнейшее десятикратное увеличение в ней кровотока, свидетельствующее о сохраняю- ( щейся в этом случае способности сосудов к вазодилатации. Для обозначе- I ния этой особенности денервированных сосудов оказывать сопротивление I кровотоку введено понятие «базальный тонус сосудов».
I Базальный тонус сосудов определяется структурными и миогенными
! факторами. Структурная часть его создается жесткой сосудистой «сумкой», образованной коллагеновыми волокнами, которая определяет сопротивление сосудов, если активность их гладких мышц полностью исключена. Миогенная часть базального тонуса обеспечивается напряжением гладких 1 мышц сосудов в ответ на растягивающее усилие артериального давления.
Следовательно, изменения сопротивления сосудов под влиянием нервных или гуморальных факторов наслаиваются на базальный тонус, который для определенной сосудистой области более или менее постоянен. Ес- ( ли нервные и гуморальные влияния отсутствуют, а нейрогенный компонент сопротивления сосудов равен нулю, сопротивление их кровотоку определяется базальным тонусом.
Поскольку одной из биофизических особенностей сосудов является их I способность к растяжению, то при активной констрикторной реакции со- I судов изменения их просвета находятся в зависимости от двух противопо- I ложно направленных влияний: сокращающихся гладких мышц сосудов, которые уменьшают их просвет, и повышенного давления в сосудах, кото- i рое их растягивает. Растяжимость сосудов различных органов значительно отличается. При повышении артериального давления только на 10 мм рт. ст. (со 110 до 120 мм рт. ст.) кровоток в сосудах кишечника увеличивается на 5 мл/мин, а в сосудах миокарда в 8 раз больше — на 40 мл/мин.
На величине реакций сосудов могут сказываться и различия их исход- * ного просвета. При этом имеет значение отношение толщины стенки сосуда к его просвету. Чем выше указанное отношение (стенка/просвет), т. е. чем больше масса стенки находится внутри «линии силы» укорочения гладких мышц, тем более выражено сужение просвета сосудов. В этом случае при одной и той же величине сокращения гладких мышц в артериальных и венозных сосудах уменьшение просвета всегда будет более выражено в артериальных сосудах, так как структурные «возможности» уменьшения , просвета в большей степени присущи сосудам с высоким отношением стенка/просвет. На этой основе строится одна из теорий развития гипертонической болезни у человека.
Изменения трансмурального давления (разность внутри- и внесосудисто- го давлений) влияют на просвет кровеносных сосудов и, следовательно, на их сопротивление кровотоку и содержание в них крови, что особенно сказывается в венозном отделе, где растяжимость сосудов велика и значительные изменения объема содержащейся в них крови могут иметь место при небольших сдвигах давления. Поэтому изменения просвета венозных сосудов будут -вызывать соответствующие изменения трансмурального давления, что может привести к пассивно-эластической отдаче крови из этой области.
Следовательно, выброс крови из вен, возникающий при усилении им- пульсации в вазомоторных нервах, может быть обусловлен как активным сокращением гладкомышечных клеток венозных сосудов, так и их пассивно-эластической отдачей. Относительная величина пассивного выброса крови в этой ситуации будет зависеть от исходного давления в венах. Если исходное давление в них низкое, дальнейшее его уменьшение может вызвать спадение вен, ведущее к весьма выраженному пассивному выбросу крови. Нейрогенная констрикция вен в этой ситуации не вызовет сколько- нибудь значительного выброса из них крови и в результате может быть сделано ошибочное заключение, что нервная регуляция этого отдела незначительна. Напротив, если исходное трансмуральное давление в венах высокое, то уменьшение этого давления не повлечет за собой спадение вен и пассивно-эластическая их отдача будет минимальной. В этом случае активная констрикция вен вызовет значительно больший выброс крови и покажет истинное значение нейрогенной регуляции венозных сосудов.
Пассивный компонент мобилизации крови из вен при низком давлении в них очень выражен, но становится весьма малым при давлении 5—10 мм рт. ст. В этом случае вены имеют циркулярную форму и выброс крови из них при нейрогенных влияниях обусловлен активными реакциями указанных сосудов. Однако при подъеме венозного давления выше 20 мм рт. ст. величина активного выброса крови вновь уменьшается, что является следствием «перенапряжения» гладкомышечных элементов венозных стенок.
Во время спокойного стояния человека объем вен, расположенных ниже уровня сердца, увеличивается примерно на 500 мл и даже больше, если расширены кожные вены. Именно это может быть причиной головокружения или даже обморока при продолжительном стоянии, особенно в тех случаях, когда при высокой температуре окружающей среды имеет место расширение сосудов кожи. Недостаточность венозного возврата при этом обусловлена не тем, что «кровь должна подниматься вверх», а повышенным трансмуральным давлением и обусловленным этим растяжением вен, а также застоем в них крови. Гидростатическое давление в венах тыльной поверхности стопы в этом случае может достигать 80—100 мм рт. ст. Однако уже первый шаг создает наружное давление скелетных мышц на вены, и кровь устремляется к сердцу, так как клапаны вен препятствуют обратному току крови. Это приводит к опорожнению вен в скелетных мышцах конечностей и снижению в них венозного давления, которое возвращается к первоначальному уровню со скоростью, зависящей от кровотока в этой конечности. Растяжение вен органов брюшной полости в положении стоя сводится к минимуму в результате того, что при переходе в вертикальное положение давление внутри брюшной полости повышается.
К числу основных феноменов, присущих органному кровообращению, помимо ауторегуляции кровотока, зависимости реакции сосудов от их исходного тонуса, от силы раздражителя, относятся функциональная (рабочая) гиперемия, а также реактивная (постокклюзионная) гиперемия. Эти феномены свойственны регионарному кровообращению во всех областях.
Рабочая (или функциональная) гиперемия — увеличение органного кровотока, сопровождающее усиление функциональной активности органа. Так, в сокращающейся скелетной мышце увеличиваются кровоток и кровенаполнение, саливация также сопровождается резким увеличением кровотока по расширенным сосудам слюнной железы. Гиперемия возникает в поджелудочной железе в момент пищеварения, а также в кишечной стенке в период усиления моторики и секреции. Увеличение сократительной активности миокарда ведет к росту коронарного кровотока, активация зон головного мозга сопровождается усилением их кровоснабжения, усиленное кровоснабжение ткани почки регистрируется при увеличении натрийуреза.
Реактивная (или постокклюзионная) гиперемия — увеличение кровотока в сосудах органа после временного прекращения кровотока. Она проявляется в скелетных мышцах и в конечности человека и животных, хорошо выражена в почке и в головном мозге, имеет место в коже и кишечнике.
Установлена связь изменений кровотока в органе с химическим составом среды, окружающей внутриорганные сосуды. Выражением этой связи являются местные вазодилататорные реакции в ответ на искусственное введение в сосуды продуктов тканевого обмена (СО2, лактат) и веществ, изменения концентрации которых в межклеточной среде сопутствуют сдвигам функции клеток (ионы, аденозин и др.). Отмечена органная специфичность этих реакций: особая активность СО2, ионов К в церебральных сосудах, аденозина — в коронарных.
Ауторегуляторная реакция на понижение давления, в принципе, соответствует «реактивной» гиперемии, вызванной временной окклюзией артерии. В соответствии с этим данные табл. 9.6 свидетельствуют, что наиболее кратковременные пороговые окклюзии артерий регистрируются в тех же самых регионах, где эффективна ауторегуляция.
Функциональная гиперемия органов является веским доказательством основного постулата физиологии кровообращения, согласно которому регуляция кровообращения необходима для осуществления нутритивной функции движения крови по сосудам. Данные табл. 9.7 свидетельствуют о том, что усиление деятельности практически каждого органа сопровождается увеличением кровотока по его сосудам.
В большей части сосудистых регионов (миокард, скелетные мышцы, кишечник, пищеварительные железы) функциональная гиперемия выявляется как существенное увеличение общего кровотока (максимально до 4— 10-кратного) при усилении функции органа. К этой группе относится и мозг, хотя общее увеличение его кровоснабжения при усилении активности «всего мозга» не установлено, но локальный кровоток в зонах повышенной нейрональной активности существенно возрастает. Функциональная гиперемия не обнаружена в печени — главном химическом реакторе тела. Возможно, это связано с тем, что печень не бывает в функциональном «покое», либо с тем, что она и без того обильно снабжается кровью из печеночной артерии и воротной вены. В другом химически активном «органе» — жировой ткани — функциональная гиперемия выражена. Функциональная гиперемия проявляется также и в мозговом веществе почки, работающей «безостановочно», где кровоснабжение коррелирует со скоростью реабсорбции натрия, хотя диапазон изменений кровотока невелик. Применительно к коже понятие «функциональная гиперемия» не используется, хотя обусловленные ею изменения кровоснабжения происходят здесь постоянно. Основная функция теплообмена организма со средой обеспечивается кровоснабжением кожи, но и другие (не только нагревание) виды стимуляции кожи (ультрафиолетовое облучение, механические воздействия) обязательно сопровождаются гиперемией.
Таблица 9.7. Регионарные особенности функциональной гиперемии
| Орган | Показатель усиления функциональной активности | Изменение кровотока | Основной фактдр (факторы) механизма |
| Мозг | Локальная нейронная активность мозговых зон. Общая | Локальное увеличение на 20—60 %. В коре увеличение в | Начальный «быстрый» фактор (нервный или химический: калий, аденозин и др.). После |
| активность коры | 1,5—2 раза | дующий «медленный» фактор (РСО22, pH и др.) | |
| Миокард | Увеличение частоты и силы сокращений сердца | Увеличение до 6-кратного | Аденозин, гиперосмия, ионы калия и другие гистомеханиче- ские влияния |
| Скелет- | Сокращения мы- | Увеличение до | Ионы калия, водорода. Гисто- |
| ные мышцы | шечных волокон | 10-кратного в двух режимах | механические влияния |
| Кишеч- | Усиление секре- | Увеличение до 2— | РО2, метаболиты, интестиналь |
| ник | ции, моторики и всасывания | 4-кратного | ные гормоны, серотонин, местный рефлекс |
| Поджелудочная железа | Усиление экзосекреции | Увеличение | Метаболиты, интестинальные гормоны, кинины |
| Слюнные | Усиление слюноот | Увеличение до | Влияние импульсации парасим |
| железы | деления | 5-кратного | патических волокон, кинины, гистомеханические влияния |
| Печень | Усиление обменных реакций | Локальное увеличение (?) | Мало исследовано |
| Почка (мозговое вещество) | Увеличение реабсорбции натрия | Увеличение до 2-кратного | Брадикинин, гиперосмия |
| Костный мозг | Стимуляция эритропоэза | Увеличение | Аденозин |
| Кость | Ритмическая деформация кости | Увеличение до 2-кратно го | Механические влияния |
| Жир | Нейрогенное усиление липолиза через циклический АМФ | Увеличение | Аденозин, адренергические влияния |
| Кожа | Повышение температуры, УФ-облучение, механическая стимуляция | Изменение до 5-кратного | Уменьшение констрикторной импульсации, метаболиты, активные вещества из дегранули- рованных тучных клеток, ослабление чувствительности к симпатической импульсации |
Табл. 9.7 показывает также, что все известные механизмы регуляции регионарного кровотока (нервные, гуморальные, местные) могут быть причастны к механизмам функциональных гиперемий, причем в разной комбинации для различных органов.
9.L4.2. Нервные и гуморальные влияния на органные сосуды
Нейрогенное сужение сосудов осуществляется путем возбуждения адренергических волокон, которые действуют на гладкие мышцы сосудов путем высвобождения в области нервных окончаний медиатора адреналина. Торможение импульсов в симпатических нервных волокнах влияет на гладкие мышцы сосудов путем снижения их тонуса.
Парасимпатические вазодилататорные волокна холинергической природы доказаны для группы волокон сакрального отдела, идущих в составе п. pelvicus. В блуждающих нервах отсутствуют сосудорасширяющие волокна для органов брюшной полости.
В скелетных мышцах доказано наличие симпатических вазодилататор- ных нервных волокон, которые являются холинергическими. Внутрицен- тральный путь этих волокон начинается в моторной зоне коры мозга. Тот | факт, что эти волокна могут возбуждаться при стимуляции двигательной области коры мозга, позволяет предположить, что они вовлекаются в системную реакцию, способствующую увеличению кровотока в скелетных мышцах в начале их работы. Гипоталамическое представительство этой системы волокон указывает на их участие в эмоциональных реакциях орга- ' низма.
У теплокровных отсутствует «дилататорный» центр с особой системой «дилататорных» волокон. Вазомоторные сдвиги бульбоспинального уровня осуществляются исключительно путем изменения числа возбужденных констрикторных волокон и частоты их разрядов, т. е. сосудодвигательные эффекты возникают только путем возбуждения или торможения констрикторных волокон симпатических нервов.
Адренергические волокна при электрической стимуляции могут передавать импульсацию с частотой 80—100 в 1 с. Однако в физиологическом покое частота импульсов в них составляет 1—3 в 1 с и может увеличиваться при прессорном рефлексе только до 12—15 имп/с. Из сказанного ясно, что практически весь диапазон величин сосудистых реакций, которые можно I получить при электрической стимуляции нервов, соответствует увеличению частоты импульсов всего лишь на1—12в1си что вегетативная нервная система в норме функционирует при частоте разрядов значительно меньшей 10 имп/с.
Электрическая стимуляция соответствующих симпатических волокон | приводит к достаточно сильному повышению сопротивления сосудов скелетных мышц, кишечника, селезенки, кожи, печени, почки, жира; эффект выражен слабее в сосудах мозга, сердца. В сердце и почке этой вазоконст- ( рикции противостоят местные вазодилататорные влияния, опосредованные активацией функций основных или специальных клеток ткани, одновременно запускаемые нейрогенным адренергическим механизмом. В результате такой суперпозиции двух механизмов выявление адренергической , нейрогенной вазоконстрикции в сердце и почке составляет более слож- 1 ную, чем для других органов, задачу. Общая закономерность все же состоит в том, что во всех органах стимуляция симпатических волокон вызывает активацию гладких мышц сосудов, иногда маскируемую одновременными или вторичными тормозными эффектами.
При рефлекторном возбуждении симпатических нервных волокон, как правило, имеет место повышение сопротивления сосудов всех изученных областей (рис. 9.22). При торможении симпатической нервной системы (рефлексы с полостей сердца, депрессорный синокаротидный рефлекс) наблюдается обратный эффект. Различия между рефлекторными вазомоторными реакциями органов в основном количественные, качественные — обнаруживаются значительно реже. Одновременная параллельная регистрация сопротивления в различных сосудистых областях свидетельствует о ка- I чественно однозначном характере активных реакций сосудов при нервных влияниях.
Учитывая небольшую величину рефлекторных констрикторных реакций сосудов сердца и мозга, можно полагать, что в естественных условиях кровоснабжения этих органов симпатические вазоконстрикторные влияния на
Рис. 9.22. Величины изменений сопротивления сосудов (активные реакции) в различных областях системы кровообращения при прессорном рефлексе у кошки.
По оси ординат — изменения сопротивления (в процентах к исходному); по оси абсцисс: 1 — коронарные сосуды; 2 — мозговые; 3 — печеночные; 4 — таза и задних конечностей; 5 — задней конечности; 6 — обеих задних конечностей; 7 — мышц таза; 8 — почки; 9 — толстой кишки; 10 — селезенки; 11 — передней конечности; 12 — желудка; 13 — подвздошной кишки; 14 — печени.
них нивелируются метаболическими и общими гемодинамическими факторами, в результате чего конечным эффектом может быть расширение сосудов сердца и мозга. Этот суммарный дилататорный эффект обусловлен сложным комплексом влияний на указанные сосуды, а не только нейрогенных. Кроме того, эти отделы сосудистой системы обеспечивают обмен веществ в жизненно важных органах, поэтому слабость вазоконстрикторных рефлексов в этих органах обычно интерпретируют тем, что выраженные симпатические констрикторные влияния на сосуды мозга и сердца биологически нецелесообразно, так как это значительно уменьшало бы их кровоснабжение.
Сосуды легких, обеспечивающих кислородом органы и ткани и выведение из них углекислоты, т. е. выполняющих функцию, жизненная важность которой бесспорна, на том же основании не должны подвергаться выраженным констрикторным влияниям симпатической нервной системы, поскольку это вело бы к нарушению соответствия их основному физиологическому значению. Такое суждение относится и к сосудам печени и почек, функционирование которых определяет жизнеобеспечения организма менее «экстренно», но не менее ответственно.
В то же время при вазомоторных рефлексах сужение сосудов скелетных мышц и органов брюшной полости значительно больше, чем рефлекторные реакции сосудов сердца, мозга и легких (см. рис. 9.22). Аналогичная величина вазоконстрикторных реакций в скелетных мышцах больше, чем в чревной области, а увеличение сопротивления сосудов задних конечностей больше, чем сосудов передних конечностей.
Причинами неодинаковой выраженности нейрогенных реакций отдельных сосудистых зон могут быть: различная степень симпатической иннер- вированности; количество, распределение в тканях и сосудах и чувствительность а- и p-адренорецепторов; местные факторы (особенно метаболиты); биофизические особенности сосудов; неодинаковая интенсивность импульсов к различным сосудистым областям.
Применение катехоламинов показывает, что во всех органах активация а-адренорецепторов сопровождается констрикцией артерий и вен. Активация p-адренорецепторов (обычно связь их с симпатическими волокнами существенно менее тесная, чем у а-адренорецепторов) приводит к вазодилатации; для кровеносных сосудов некоторых органов р-адренорецепция не обнаружена. Следовательно, в качественном отношении регионарные адренергические изменения сопротивления кровеносных сосудов первично однотипны.
Большое количество химических веществ вызывает активные изменения просвета сосудов. Концентрация этих веществ определяет выраженность вазомоторных реакций. Небольшое увеличение концентрации ионов калия в крови вызывает дилатацию сосудов, а при более высоком уровне — они суживаются, ионы кальция вызывают артериальную констрикцию, ионы натрия и магния — являются дилататорами, равно как и ионы ртути и кадмия. Ацетаты и цитраты также являются активными вазодилататорами, значительно меньшим эффектом обладают хлориды, бифосфаты, сульфаты, лактаты, нитраты, бикарбонаты. Ионы соляной, азотной и других кислот вызывают обычно расширение сосудов. Прямое действие адреналина и норадреналина на сосуды вызывает преимущественно их констрикцию, а гистамина, ацетилхолина, АДФ и АТФ — дилатацию. Ангиотензин и вазопрессин — сильные местные констрикторы сосудов. Влияние же серотонина на сосуды зависит от их исходного тонуса: если последний высок — серотонин расширяет сосуды и, наоборот, при низком тонусе — действует сосудосуживающе. Кислород может быть высокоактивным в органах с интенсивным обменом веществ (мозг, сердце) и значительно меньшее действие оказывать на другие сосудистые области (например, конечности). То же относится и к углекислоте. Снижение концентрации кислорода в крови и соответственно увеличение углекислоты ведет к расширению сосудов.
Простагландины (ПГ) относятся к физиологически активным веществам, связанным происхождением с арахидоновой кислотой, и эту группу веществ называют эйкозаноидами. ПГ выделяются в процессе тканевого обмена и отличаются от остальных эйкозаноидов тем, что способны влиять на тонус сосудов. При этом важно отметить, что вазоактивны такие же их концентрации, которые образуются во внеклеточной среде, окружающей кровеносные сосуды в условиях их нормального функционирования. Дистанционность действия на сосуды веществ рассматриваемой группы невелика. ПГ типа Е способны в очень малых концентрациях вызывать снижение сопротивления кровотоку сосудов практически всех органов. Содержание ПГ в венозной крови интенсивно работающих мышц повышается, и это дает основание предполагать участие данного фактора в развитии рабочей гиперемии. Доказана роль ПГ в регуляции выхода трансмиттера (норадреналин) из нервных окончаний. Так, ПГ группы Е тормозят как количество освобождающего норадреналина, так и действие его на рецепторы, а ПГ группы F производят противоположный эффект. Следовательно, ПГ принимают участие и в нервном контроле тонуса сосудов.
Кинины (действующее начало калликреин-кининовой системы) подобно ПГ относят к биологически активным веществам местного действия. Активным компонентом этой системы является брадикинин. При введении в кровоток брадикинин расширяет сосуды большинства органов. Он вызывает увеличение кровотока в скелетных мышцах в 15 раз более сильное, чем ацетилхолин в такой же концентрации.
9.1.4.3. Роль эндотелия сосудов в регуляции их просвета
Эндотелий сосудов обладает способностью синтезировать и выделять факторы, вызывающие расслабление или сокращение гладких мышц сосудов в ответ на разного рода стимулы. Общая масса эндотелиоцитов, монослойно выстилающих кровеносные сосуды изнутри (интима), у человека приближается к 500 г. Общая масса, высокая секреторная способность эндотелиальных клеток позволяют рассматривать эту «ткань» как своеобразный эндокринный орган (железу). Распределенный по сосудистой системе эндотелий, очевидно, предназначен для вынесения своей функции непосредственно к гладкомышечным образованиям сосудов. Период полужизни выделяемого эндотелиоцитами инкрета очень мал — 6—25 с (вследствие быстрого перехода его в нитраты и нитриты), но он способен сокращать и расслаблять гладкие мышцы сосудов, не оказывая влияния на эффекторные образования других органов (кишечник, бронхи, матка).
Выделяемые эндотелием сосудов расслабляющие факторы (ЭРФ) — нестабильные соединения, одним из которых является оксид азота (NO). В эндотелиальных клетках сосудов NO образуется из а-аргинина при участии фермента — синтетазы окиси азота.
NO рассматривается как некоторый общий путь передачи сигнала от эндотелия к гладким мышцам сосудов. Выделение из эндотелия NO ингибируется гемоглобином и потенцируется ферментом — дисмутазой.
Участие эндотелия в регуляции тонуса сосудов общепризнанно. Для всех магистральных артерий показана чувствительность эндотелиоцитов к скорости кровотока, выражающаяся в выделении ими расслабляющего гладкие мышцы сосудов фактора, приводящего к увеличению просвета этих артерий. Таким образом, артерии непрерывно регулируют свой просвет соответственно скорости течения по ним крови, что обеспечивает стабилизацию давления в артериях в физиологическом диапазоне изменений величин кровотока. Этот феномен имеет большое значение в условиях развития рабочей гиперемии органов и тканей, когда происходит значительное увеличение кровотока, а также при повышении вязкости крови, вызывающей рост сопротивления кровотоку в сосудистой сети. Повреждение механочувствительности сосудистых эндотелиоцитов может быть одним из этиологических (патогенетических) факторов развития облитерирующего эндоартериита и гипертонической болезни.
9.1.5. Особенности кровоснабжения органов и тканей
9.1.5.1. Головной мозг
Интенсивность кровотока в сосудах мозга высока и составляет в состоянии покоя человека 55—60 мл/100 г/мин, т. е. около 15 % сердечного выброса. При относительно небольшой массе (2 % от массы тела) мозг потребляет до 20 % всего кислорода и 17 % глюкозы, которые поступают в организм человека. Интенсивность потребления кислорода мозгом составляет в среднем 3—4 мл/100 г/мин. В отличие от других органов мозг практически не располагает запасами кислорода.
При относительном постоянстве общего мозгового кровотока локальный кровоток в различных отделах мозга не постоянен и зависит от интенсивности их функционирования. Так, при напряженной умственной работе локальный кровоток в коре головного мозга человека может возрастать в 2—3 раза по сравнению с состоянием покоя.
В условиях герметичности и жесткости черепа общее сопротивление сосудистой системы головного мозга мало зависит от изменений давления в его артериях. Так, при повышении АД происходит расширение мозговых артерий, что ведет к повышению давления ликвора, сжатию вен мозга и оттоку ликвора в спинальную полость. При этом сопротивление артерий падает, а вен — возрастает, так что общее сопротивление сосудистой системы мозга в целом практически не меняется.
Миогенная регуляция мозгового кровотока осуществляется за счет реакции гладких мышц артериальных сосудов мозга на изменение давления в них. Повышение АД приводит к возрастанию тонуса миоцитов и сужению артерий, снижение АД —- к снижению тонуса и расширению артерий. Миогенная регуляция мозгового кровообращения считается центральным звеном системы ауторегуляции кровообращения в мозге.
Гуморальная регуляция. Мощным регулятором мозгового кровотока является уровень напряжения углекислого газа в артериальной крови и связанный с этим уровень pH спинномозговой жидкости. На каждый миллиметр изменения напряжения СО2 величина мозгового кровотока изменяется примерно на 6 %. Возрастание напряжения СО2 в крови (гиперкапния) сопровождается расширением мозговых сосудов, а гипокапния — их сужением, столь значительным, что достигается порог кислородной недостаточности мозга (одышка, судороги, потеря сознания). Увеличение мозгового кровотока при гиперкапнии обеспечивает быстрое «вымывание» углекислоты и возвращение уровня напряжения СО2 и концентрации водородных ионов к исходной величине.
Метаболическая реакция клеток мозга играет существенную роль при локальных перераспределениях крови между областями мозга, имеющими разный уровень функциональной активности в каждой конкретной ситуации. Локальное повышение функциональной активности нервных клеток приводит к росту в межклеточной среде концентрации аденозина и ионов калия, что ведет к местному расширению сосудов и усилению в них кровотока.
Поскольку уровень концентрации ионов калия в межклеточной среде головного мозга может меняться в течение долей секунды от момента усиления функциональной активности нейронов, описанный механизм считается быстрым контуром регуляции. Более медленный контур регуляции мозгового кровотока связан с повышением напряжения СО2 в мозговом веществе вследствие активного потребления кислорода работающими клетками. Это вызывает локальное снижение pH в межклеточной среде и приводит к расширению сосудов активно функционирующей области мозга.
Биологически активные вещества и гормоны могут оказывать как прямое, так и опосредованное влияние на сосуды мозга. К внутрисосудистым вазоконстрикторам относятся: вазопрессин, ангиотензин, простагландины группы F, катехоламины. Сосудорасширяющий эффект оказывают: ацетилхолин, гистамин (средние и крупные артерии), брадикинин (мелкие артерии).
Нейрогенная регуляция сосудов головного мозга менее эффективна, чем метаболическая. Основной зоной приложения нейрогенных влияний являются мелкие артериальные мозговые сосуды диаметром до 25—30 мкм. Доказано существование адренергических, холинергических, серотонинергических и пептидергических нервных волокон, обеспечивающих регуляцию тонуса мозговых сосудов, Нервные влияния на стенку сосудов головного мозга опосредуются через а- и p-адренорецепторы (норадреналин), М-холинорецепторы (ацетилхолин, вазоинтестинальный пептид), D-рецепторы (серотонин).
Основной источник нервных влияний на сосуды мозга — постганглионарные симпатические волокна, начинающиеся в верхних шейных ганглиях. Существование парасимпатических влияний на мозговые сосуды не доказано.
Нейрогенные влияния на кровоснабжение мозга во многом зависят от выраженности ауторегуляции, исходного тонуса сосудов, напряжения СО2, О2, состава и концентрации ионов, присутствия биологически активных веществ в спинномозговой жидкости и тканях мозга. Именно поэтому конечный эффект нейрогенных влияний на мозговой кровоток не однозначен.
9.1.5.2. Миокард
В состоянии покоя у человека через коронарные сосуды протекает 200— 250 мл крови в минуту (60 мл/100 г/мин), это составляет 4—5 % минутного объема крови. При интенсивной мышечной работе коронарный кровоток может возрастать до 400 мл/мин на 100 г ткани.
В период систолы желудочков, расположенные в них сосуды частично пережимаются, кровоток к миокарду резко ослабевает (до 15 %). Во время диастолы напряжение в стенке миокарда падает и кровоток увеличивается до 85 %.
Несмотря на резкое снижение кровотока в миокарде во время систолы, коронарное кровообращение полностью удовлетворяет высокие метаболические потребности миокарда. Это достигается большой объемной скоростью кровотока, растяжимостью сосудов сердца, фазными колебаниями кровотока в коронарных венах (во время систолы ускоряется отток крови из коронарного синуса, в диастолу он понижается), наличием густой капиллярной сети (сердечная мышца богато снабжена капиллярами — на каждое мышечное волокно приходится капилляр; малое диффузное расстояние от капилляра до кардиомиоцита облегчает доставку кислорода и питательных веществ к кардиомиоцитам), высокой экстракцией кислорода миокардом [в состоянии покоя миоглобин сердечной мышцы извлекает из артериальной крови 60—75 % кислорода (в мозге — 25—30 %)]. Миокард потребляет в покое кислорода до 10 мл/100 г/мин. При интенсивной мышечной работе экстракция кислорода в миокарде возрастает примерно в 6 раз.
Миогенная регуляция. Для коронарных сосудов характерен высокий тонус, величина которого находится в обратно пропорциональной зависимости от интенсивности обменных процессов миокарда.
Гуморальная регуляция. Наиболее мощным регулятором коронарного кровотока является напряжение кислорода в крови: расширение коронарных сосудов проявляется при снижении содержания кислорода в крови на 5 %. Взаимосвязь между потреблением кислорода и уровнем кровотока осуществляется через метаболические механизмы. «Аденозиновая теория» метаболической регуляции коронарного кровообращения является общепризнанной. Аденозин блокирует захват Са2+ гладкими мышцами. При физической нагрузке имеет место увеличение концентрации ионов
калия, водородных ионов, молочной кислоты, повышение концентрации двуокиси углерода, появление в межклеточной жидкости вазоактивных веществ (гистамин, кинины, простагландины группы Е, пептиды) что ведет к расширению сосудов и увеличению кровотока в миокарде. Ацетилхолин ’ через М-холинорецепторы расширяет коронарные артерии. Адреналин и
1 норадреналин через а-адренорецепторы вызывают сужение, через р-адре-
норецепторы — расширение коронарных артерий и вен. Ангиотензин и ва- j зопрессин только в больших дозах приводят к сужению коронарных артерий. Тироксин, кортизол и другие гормоны усиливают кровоснабжение миокарда через метаболические посредники.
Нервная регуляция. Нейрогенный тонус сосудов сердца невелик I (около 20 %). Симпатические нервы содержат сосудосуживающие волокна, тормозные процессы в них вызывают коронародилатацию. Нервные влияния находятся в конкурентных отношениях с метаболическими, которые ; представляют более мощный контур регуляции.
! 9.1.5.3. Легкие
Легочная артерия и ее ветви, имеющие диаметр более 1 мм, относятся к артериям эластичного типа, они демпфируют (смягчают) пульсовые толчки крови, выбрасываемой в момент систолы правого желудочка. Артериолы в легких тесно связаны с окружающей альвеолярной паренхимой, это определяет непосредственную зависимость уровня кровоснабжения легких от ' режима вентиляции.
I В отличие от большого круга кровообращения, капилляры которого
имеют диаметр около 7—8 мкм, в легких имеются два типа капилляров — широкие (20—40 мкм) и узкие (6—12 мкм). Общая площадь капиллярного русла легких у человека составляет 35—40 м2. Стенка капилляров легких и стенка альвеол представляют в совокупности функциональное целое, обо- ’ значаемое как альвеоло-капиллярная мембрана.
Если функциональное значение сосудов малого круга кровообращения заключается, главным образом, в поддержании адекватного легочного газообмена, то бронхиальные сосуды обеспечивают питание тканей самих легких. Венозная бронхиальная сеть дренирует кровь как в систему большого круга кровообращения (верхняя непарная вена, правое предсердие), I так и малого — в легочные вены и левое предсердие. Только 30 % крови, { поступающей в бронхиальные артерии по системе большого круга кровообращения, достигает правого желудочка, основная же часть кровотока направляется через капиллярные и венозные анастомозы в легочные вены. Указанная особенность бронхиального кровотока формирует так называемый физиологический дефицит напряжения кислорода в артериальной I крови большого круга. Примесь бронхиальной венозной крови к артериа- лизированной крови легочных вен понижает на 6—10 мм рт.ст. напряжение кислорода по сравнению с его напряжением в крови легочных капилляров, что практически не сказывается на кислородном режиме в процессе обычной жизнедеятельности организма.
Основным условием, определяющим степень оксигенации крови в легких, являются величины легочной вентиляции и кровотока, а также сте- I пень их соответствия друг другу. Минутный объем кровообращения через легкие соответствует МОК в большом круге и составляет в условиях покоя 5—6 л/мин. Сопротивление сосудистого русла малого круга при этом приблизительно в 8—10 раз меньше, чем в системе большого круга кровообра- i щения. Легочные сосуды характеризуются высокой растяжимостью, поскольку их сосудистая стенка значительно тоньше, чем у соответствующих по калибру сосудов скелетной мускулатуры и спланхнической области. Это определяет роль легочных сосудов как депо крови.
Важной особенностью кровоснабжения легких является то, что сосуды малого круга кровообращения — это система низкого давления. Среднее давление в легочной артерии у человека составляет 15—25 мм рт. ст., а давление в легочных венах — 6—8 мм рт. ст. Таким образом, градиент давления, определяющий движение крови по сосудам малого круга, составляет 9—15 мм рт. ст., что значительно меньше градиента давления в большом круге кровообращения. Отсюда понятен физиологический смысл высокой растяжимости легочных сосудов: значительное увеличение кровотока в системе малого круга (например, при физической нагрузке) не будет сопровождаться повышением давления крови в силу указанных свойств сосудов легких.
Другим следствием низкого градиента давления в малом круге является неравномерность кровоснабжения легких от их верхушки к основанию. В вертикальном положении тела кровоснабжение верхних долей несколько меньше, чем нижних.
Нервная регуляция. Легочные сосуды имеют двойную иннервацию: вагусную (афферентную) и симпатическую (эфферентную). Основным источником афферентной иннервации легочных сосудов являются блуждающие нервы (волокна, идущие от чувствительных клеток узлового ганглия). Главными источниками эфферентной иннервации являются шейные и верхние грудные симпатические узлы.
Влияние нервной системы на легочные сосуды, в отличие от сосудов большого круга кровообращения, выражено намного меньше.
Крупные легочные сосуды (особенно легочная артерия и область ее бифуркации) являются рефлексогенной зоной, обеспечивающей рефлекторные реакции сосудов малого круга. Так, повышение давления в легочных сосудах приводит к рефлекторному падению системного артериального давления, замедлению ритма сердечных сокращений, увеличению кровенаполнения селезенки и вазодилатации в скелетных мышцах. Расширение периферических сосудов уменьшает приток крови в малый круг кровообращения и, тем самым, «разгружает» легочные капилляры и предохраняет их от отека. Описанный комплекс рефлекторных реакций с барорецепторов малого круга получил в литературе обозначение как рефлекс Швигка— Ларина.
Рецепторный аппарат сосудов в малом круге представлен преимущественно p-адренорецепторами (хотя плотность их распределения значительно меньше, чем сосудов большого круга), Д-серотониновыми, Нггистами- новыми рецепторами и в меньшей степени М-холинорецепторами.
Гуморальная регуляция. В реализации гуморального контроля легочного кровообращения катехоламины и ацетилхолин играют значительно меньшую роль, чем в большом круге кровообращения. Повышение концентрации ацетилхолина в крови сопровождается умеренной дилатацией легочных сосудов. Гуморальная регуляция легочного кровотока определяется серотонином, гистамином, ангиотензином-П, простагландином F.
9.1.5.4. Желудочно-кишечный тракт (ЖКТ)
В состоянии покоя на ЖКТ приходится до 20 % сердечного выброса. Кровоток в различных отделах ЖКТ неодинаков: в желудке человека он достигает 40 мл/100 г/мин, в тонкой кишке — 35 мл/100 г/мин, в толстой —
| 20 мл/100 г/мин. При максимальной дилатации сосудов кишечника кровоток в нем увеличивается в 8— 10 раз, причем более 90 % дополнительной крови поступает в слизисто-подслизистую сеть. В первые минуты после еды происходит увеличение кровотока в сосудах ЖКТ (отчасти за счет выпрямления спиралевидных артерий), причем лишь в отделах, функциональная активность которых усилена. Эта фаза реакции сосудистой системы ЖКТ на прием пищи продолжается 5—30 мин. Через 30 мин после приема пищи кровоток в брыжеечной артерии значительно возрастает (на 30—130 % по сравнению с состоянием «натощак») и сохраняется на таком уровне в те- |

| 80 |
| Рис. 9.23. Различная величина изменений сопротивления в сосудах селезенки и тонкой кишки при прессорном синокаротидном рефлексе. Сверху вниз: системное артериальное давление, перфузионное давление в сосудах селезенки, тощей кишки, отметка раздражения, отметка времени (5 с). Шкалы — в мм рт. ст. |
чение 3—7 ч. Степень увеличения кровотока после приема пищи определяется ее химическим составом и исходным функциональным состоянием органов ЖКТ.
Нервная регуляция сосудов ЖКТ осуществляется симпатическими вазоконстрикторными волокнами. Возбуждение этих волокон вызывает сужение артериальных (рис. 9.23) и венозных сосудов, а также прекапиллярных сфинктеров, что приводит к увеличению регионарного сопротивления и уменьшению кровотока в органе. При снижении частоты импульсов в симпатических волокнах возникает обратный эффект — расширение сосудов ЖКТ.
В артериальных сосудах кишечника широко представлены а- и [3-адре- норецепторы. В венозных сосудах p-адренорецепторов значительно меньше. В сосудистом русле ЖКТ при выделении катехоламинов р-адреноре- цепторы ограничивают констрикторный эффект, возникающий при возбуждении а-адренорецепторов. Это служит механизмом обеспечения необходимого кровоснабжения кишечника при активации симпатоадреналовой системы. Холинергические сосудорасширяющие волокна в кишечнике и в желудке не обнаружены. При длительном возбуждении симпатических вазоконстрикторных нервов в кишечнике происходит «ауторегуляторное ускользание» из-под влияния сосудосуживающих волокон нервной системы. Значение его в поддержании постоянного кровотока и защите тканей ЖКТ (например, от ишемии при стрессорных воздействиях) велико.
Гуморальная регуляция. Объектом гуморальных влияний агентов в сосудах ЖКТ являются, главным образом, артериолы и прекапиллярные сфинктеры. Велика роль в регуляции кровотока в ЖКТ таких метаболитов, как СО2, Н+ и др. Эти вещества, как и недостаток кислорода, оказывают вазодилататорное действие. Метаболиты снижают тонус гладких мышц артериол и тем самым понижают сопротивление в системе брыжеечной артерии, увеличивая кровоток в сосудах ЖКТ. В ЖКТ существует ряд специфических механизмов вазодилатации, не связанных с изменением содержания в тканях истинных метаболитов. Так, функциональная гиперемия ЖКТ после приема пищи обусловлена действием на сосуды ряда гастроинтестинальных гормонов, например гастрина и гистамина. Противоположное действие на них оказывают вазопрессин, гастрон, простагландин Е. Большое значение отводится веществам, высвобождающимся в активно работающем органе. В тонкой кишке расширение артериальных сосудов и прекапиллярных сфинктеров вызывают секретин и холицистокинин.
Миогенная регуляция. Сосуды ЖКТ отличаются высокой способностью к ауторегуляции кровотока. В тонкой кишке проявляется вено-артериолярный рефлекс, который состоит в том, что при локальном увеличении венозного давления в этом участке повышается тонус прекапиллярных сфинктеров, что уменьшает местный капиллярный кровоток и создает возможности для «разгрузки» вен и снижения давления на них.
9.1.5.5. Главные пищеварительные железы
Слюнные железы при активации вырабатывают за 2 мин количество слюны, равное по массе самим железам. Возбуждение парасимпатических нервов вызывает гиперемию слюнных желез. При этом артериолы и прекапиллярные сфинктеры расслабляются, а проницаемость капилляров возрастает, что создает благоприятные условия для транспорта веществ в железистые клетки. При активной работе желез имеющиеся в них артериовенозные шунты не функционируют и вся кровь проходит через капилляры. В создании функциональной гиперемии участвуют: 1) вазодилататор- ные волокна, которые способствуют выработке сосудорасширяющих кининов, 2) метаболиты, 3) гистомеханический фактор — снижение трансмурального давления на стенку сосуда вследствие фильтрации части слюны в интерстиций. Симпатические влияния на сосуды слюнных желез вызывают их сужение. Вазоконстрикторный эффект осуществляется через /7-адренорецепторы.
Поджелу донная железа. Кровоснабжение эндокринных и экзокринных тканей железы осуществляется через одни и те же сосуды. Капилляры снабжают кровью а-, а затем р-клетки островков Лангерганса и далее эндокринные ткани. Железа иннервирована симпатическими и парасимпатическими нервами, сосуды железы — только симпатическими. Возбуждение симпатических нервов приводит к сужению сосудов и торможению секреции. Увеличение кровотока в железе вызывают вещества, расслабляющие гладкие мышцы сосудов (АТФ, АДФ, брандикинин, холицистокинин и др.).
Функциональная гиперемия железы, возникающая при приеме пищи, связана с активацией центров вагуса, выделением соляной кислоты в желудке и эвакуацией пищи в двенадцатиперстную кишку. Высвобождающиеся в дуоденум секретин и холицистокинин стимулируют выделение местных метаболитов, увеличивающих панкреатический кровоток. Допускают возможность выделения под влиянием парасимпатических нервов кининов, которые способствуют увеличению кровотока и проницаемости капилляров в поджелудочной железе.
9.1.5.6. Печень
В печени кровь протекает по печеночной артерии (25—30 %) и воротной вене (70—75 %). По прохождении капиллярной сети кровь дренируется в систему печеночных вен, которые впадают в нижнюю полую вену. Важной особенностью сосудистого русла печени является наличие большого количества анастомозов между сосудами систем воротной вены, печеночной артерии и печеночных вен.
Давление в печеночной артерии соответствует давлению в других магистральных сосудах — 100—120 мм рт. ст. В воротной вене оно в 10 раз меньше и составляет около 10 мм рт. ст., в синусоидах — 3—5 мм рт. ст., в печеночных венах — 2—3 мм рт. ст. Такая небольшая разница между портальным давлением и давлением в печеночных венах оказывается достаточной для портального кровотока вследствие низкого сопротивления портальных сосудов.
Величина кровотока через печень человека составляет около 100 мл/ 100 г/мин, т. е. 20—30 % от величины сердечного выброса. На долю портального кровотока приходится 70—80 % этого объема, а на долю кровотока в печеночной артерии 20—30 %. При максимальной вазодилатации кровоток в печени может возрастать до 5000 мл/мин.
Печень является одним из органов, выполняющих функцию депо крови в организме (в норме в печени содержится свыше 500 мл крови). За счет этого может поддерживаться определенный объем циркулирующей крови (например, при кровопотере) и обеспечиваться необходимая каждой конкретной гемодинамической ситуации величина венозного возврата крови к сердцу.
Миогенная регуляция обеспечивает высокую степень ауторегуляции кровотока в печени. Даже небольшое увеличение объемной скорости портального кровотока приводит к сокращению гладких мышц воротной вены, что ведет к уменьшению ее диаметра, а также включает миогенную артериальную констрикцию в печеночной артерии. Оба этих механизма направлены на обеспечение постоянства кровотока и давления в синусоидах.
Гуморальная регуляция. Адреналин вызывает сужение воротной вены, активируя расположенные в ней а-адренорецепторы. Действие адреналина на артерии печени сводится, преимущественно, к вазодилатации вследствие стимуляции преобладающих в печеночной артерии р-адреноре- цепторов. Норадреналин при действии как на артериальную, так и на венозную систему печени приводит к сужению сосудов и повышению сосудистого сопротивления в обоих руслах, что ведет к уменьшению кровотока в печени. Ангиотензин суживает как портальные, так и артериальные сосуды печени, значительно уменьшая при этом кровоток в них. Ацетилхолин расширяет артериальные сосуды, увеличивая приток артериальной крови к печени, но сокращает печеночные венулы, ограничивая отток венозной крови из органа, что приводит к увеличению портального давления и увеличению объема крови в печени.
Метаболиты и тканевые гормоны (двуокись углерода, аденозин, гистамин, брадикинин, простагландины) вызывают сужение портальных венул, уменьшая портальный кровоток, но расширяют печеночные артериолы, усиливая приток артериальной крови к печени (артериализация печеночного кровотока). Другие гормоны (глюкортикостероиды, инсулин, глюкагон, тироксин) вызывают увеличение кровотока через печень вследствие усиления метаболических процессов в печеночных клетках.
Нервная регуляция выражена сравнительно слабо. Вегетативные нервы печени идут от левого блуждающего нерва (парасимпатические) и от чревного сплетения (симпатические). Электрическая стимуляция блуждающего нерва существенно не влияет ни на скорость печеночного кровотока, ни на его распределение в органе. Стимуляция печеночных симпатических нервов повышает сосудистое сопротивление в печеночной артерии и в воротной вене.
9.1.5.7. Кожа
Кожа в большей степени, чем другие органы, подвержена прямому действию высоких и низких температур, ультрафиолетовых лучей, механических факторов и т. д. Кровоток по ее сосудам значительно превышает собственные нутритивные потребности. Это объясняется тем, что выполнение важнейшей функции кожи человека — участие в терморегуляции — определяется не активностью метаболических процессов в ней, а теплопереносящей функцией кровотока.
В покое при нейтральной температуре внешней среды кожа получает от 5 до 10 % сердечного выброса. Суммарный кожный кровоток взрослого человека при этом составляет 200—500 мл/мин. В различных частях поверхности тела кожный кровоток значительно отличается. Например, в коже спины он составляет 9,5 мл/100 г/мин, на передней поверхности тела 15,5 мл/100 г/мин. Наиболее интенсивный кровоток отмечается в коже пальцев рук и ног, где находится большое количество артериовенозных анастомозов.
Диапазон возможного возрастания кровотока в коже велик: отношение объемной скорости кровотока в покое к максимальной его величине составляет 1:8. Максимальной величины кожный кровоток у человека достигает при тепловом стрессе. В условиях высокой внешней температуры он может возрастать с 200—500 мл/мин до 2,5—3 л/мин, а при продолжительном нагревании организма человека (температура кожи 42 °C) увеличивается до 8 л/мин, составляя 50—70 % сердечного выброса.
Нервная регуляция кровоснабжения кожи обеспечивается широко представленной иннервацией ее сосудов (особенно артериовенозных анастомозов) симпатическими адренергическими сосудосуживающими волокнами. Повышение их активности обусловливает сужение кожных сосудов, а торможение — приводит к вазодилатации.
Главным фактором в регуляции кожного кровотока является температура тела, снижение которой приводит к рефлекторному сужению как артериальных, так и венозных сосудов кожи, что способствует перемещению крови в глубокие вены и сохранению тепла. При общем охлаждении снижается кровоток как через артериовенозные анастомозы, так и через капилляры кожи. Эта реакция опосредована через гипоталамус, а эффекторными ее путями являются адренергические нервные волокна. При общем воздействии на организм высоких температур происходит увеличение кожного кровотока за счет, главным образом, раскрытия артериовенозных анастомозов, кровоток через которые увеличивается в 3—3,5 раза. Раскрытие анастомозов является следствием угнетения сосудосуживающей импульсации к кожным сосудам по симпатическим адренергическим волокнам, обусловливающим стимуляцию p-адренорецепторов. Медиаторами активной кожной вазодилатации являются гистамин и допамин.
Гуморальная регуляция. В коже имеется большое количество тучных клеток — источника вазоактивных веществ. Дегрануляция тучных клеток и выделение вазоактивных веществ (гистамина, серотонина и др.) происходит при непосредственном воздействии на кожу ультрафиолетового облучения, механических и других факторов. В сосудах кожи имеются Нг и Н2-гистаминовые рецепторы, опосредующие вазодилататор ное действие эндогенного и экзогенного гистамина. Расширение сосудов кожи вызывает субстанция Р, оказывая при этом как прямое влияние на гладкую мышцу сосудов, так и опосредованное — через гистамин, выделяющийся из тучных клеток. В коже происходит биосинтез простагландинов. Внутрикожное введение простагландинов Е2 и Н2 вызывает расширение кожных сосудов, а простагландина F2a — сужение их.
Температура самой крови является фактором, играющим важную роль в локально действующих механизмах контроля сосудистых функций в коже. При локальном нагревании кожи имеет место увеличение капиллярного кровотока без существенных изменений кровотока через артериовенозные анастомозы. В механизме вазодилатации при локальном нагревании кожи большую роль играет освобождение вазоактивных веществ (АТФ, субстанция Р, гистамин) и накопление метаболитов. Однако большее значение в развитии гиперемии в этом случае имеет прямое действие тепла на гладкомышечные элементы кожных сосудов. При повышении температуры крови снижается миогенный тонус и уменьшаются реакции гладких мышц сосудов кожи на симпатическую импульсацию и вазоконстрикторные вещества, в частности на норадреналин. Снижение адренореактивности гладких мышц кожных сосудов под влиянием гипертермии связано с уменьшением чувствительности их а-адренорецепторов.
При локальном действии на кожу низких температур имеют место вазоконстрикции и снижение кожного кровотока, что обусловлено как повышением сосудистого тонуса, так и увеличением вязкости крови.
9.1.5.8. Почка
Почка является одним из наиболее снабжаемых кровью органов — 400 мл/ 100 г/мин, что составляет 20—25 % сердечного выброса. Удельное кровоснабжение коркового вещества значительно превышает кровоснабжение мозгового вещества почки. У человека через корковое вещество почки протекает 80—90 % общего почечного кровотока. Медуллярный кровоток мал только в сравнении с корковым, однако если сравнивать его с другими тканями, то он, например, в 15 раз выше, чем в покоящейся скелетной мышце.
Гидростатическое давление крови в капиллярах клубочков значительно выше, чем в соматических капиллярах и составляет 50—70 мм рт. ст. Это обусловлено близким расположением почек к аорте и различием диаметров афферентных и эфферентных сосудов корковых нефронов.
Метаболизм в почках протекает более интенсивно, чем в других органах, включая печень, головной мозг и миокард. Интенсивность его определяется величиной кровоснабжения почек. Эта особенность характерна именно для почек, поскольку в других органах (мозг, сердце, скелетные мышцы) наоборот — интенсивность метаболизма определяет величину кровотока.
Гуморальная регуляция. Ангиотензин II (ATII) является мощным констриктором для сосудов почек, он влияет на почечный кровоток также опосредованно, стимулируя выброс медиатора из симпатических нервных окончаний. АТП стимулирует также выработку альдостерона и антидиуре- тического гормона, которые, в свою очередь, усиливают констрикторный эффект в сосудах почек.
Простагландины оказывают на сосуды почки выраженное дилататорное действие. В состоянии покоя простагландины практически не участвуют в регуляции почечного кровотока, однако их активность резко возрастает при любых вазоконстрикторных эффектах, что и обусловливает ауторегуляцию почечного кровотока.
Кинины являются местным гуморальным фактором регуляции коркового кровотока в почках. Действуя на кининовые рецепторы в сосудах, они вызывают вазодилатацию, увеличивая почечный кровоток и активируя на- трийурез.
Катехоламины через а-адренорецепторы сосудов почек вызывают их констрикцию, преимущественно в корковом слое. Допамин в малых дозах, воздействуя на допаминовые рецепторы, вызывает в почках вазодилатацию. При больших концентрациях допамин, влияя на адренорецепторы, вызывает вазоконстрикцию, наиболее выраженную в корковом слое почки.
Вазопрессин, наряду со специфическим влиянием на канальцы почек, вызывает констрикцию артериол, усиливает действие катехоламинов, перераспределяет кровоток в почке, повышая корковый и снижая мозговой кровоток. Вазопрессин подавляет секрецию ренина и стимулирует синтез простагландинов. Ацетилхолин, воздействуя на гладкие мышцы артериол и повышая активность внутрипочечных холинергических нервов, увеличивает почечный кровоток. Секретин также вызывает увеличение общего почечного кровотока. Накопление продуктов метаболизма (СО2), состояние гипоксии ведет к снижению кортикального кровотока без изменения медуллярного кровотока. Аденозин вызывает вазоконстрикцию, уменьшая общий почечный кровоток, при этом происходит перераспределение кровотока в пользу мозгового вещества почки.
Нервная регуляция. По сравнению с гуморальными факторами нервная регуляция почечного кровотока выражена меньше. Постганглионарные симпатические нервные волокна локализованы в перивазальной ткани основной, междолевых, междольковых артерий и достигают артериол коркового слоя, реализуя констрикторные эффекты через а-адренорецепторы. Сосуды почки, особенно мозгового слоя, иннервируются симпатическими холинергическими нервными волокнами, которые оказывают вазодилататорный эффект.
Миогенная регуляция обеспечивает в основном ауторегуляцию кровоснабжения почек. Миогенными реакциями прегломерулярных сосудов обусловливается относительно постоянный уровень коркового кровотока в диапазоне колебаний системного артериального давления крови в пределах от 70 до 180 мм рт. ст.
9.1.5.9. Скелетные мышцы
Большая масса скелетных мышц (около 40 % массы тела) обусловливает необходимость обеспечения значительного кровотока в мышцах при их работе. В покое интенсивность кровотока в скелетных мышцах колеблется от 2 до 5 мл/100 г/мин, что составляет 15—20 % величины сердечного выброса. Функциональный резерв для увеличения кровотока в мышцах при физической работе обеспечивается высоким исходным базальным тонусом сосудов скелетных мышц. Кровоток в мышцах при их интенсивной работе может возрасти более чем в 30 раз, достигая величины 100—120 мл/100 г/ мин (80—90 % сердечного выброса). Потребление кислорода мышцами при этом увеличивается с 0,3 до 6 мл/100 г/мин. Возросшая интенсивность метаболических процессов обеспечивается значительным увеличением числа функционирующих капилляров. В покое открыто 20—30 % имеющихся в мышце капилляров. При работе скелетных мышц число функционирующих в них капилляров увеличивается в 2—3 раза.
Миогенная регуляция. Высокий исходный тонус сосудов скелетных мышцах обусловлен, главным образом, миогенной активностью сосудистой стенки и в меньшей степени — влиянием симпатических вазоконстрикторов (15—20 % тонуса в покое нейрогенного происхождения).
Нервная регуляция сосудов скелетных мышц осуществляется через симпатические адренергические вазоконстрикторы. В артериях скелетных мышц имеются а- и p-адренорецепторы, в венах — только а-адренорецеп- торы. Активизация а-адренорецепторов приводит к сокращению миоцитов и сужению сосудов, активизация p-адренорецепторов — к расслаблению миоцитов и расширению сосудов. Сосуды скелетных мышц иннервируются также симпатическими холинергическими нервными волокнами, возбуждение которых оказывает дилататорный эффект. В покое сосуды скелетных мышц находятся под тоническим влиянием симпатических вазоконстрикторов.
Гуморальная регуляция. Наиболее мощным фактором гуморальной регуляции тонуса сосудов являются метаболиты, накапливающиеся в работающей мышце. В межклеточной жидкости и в оттекающей от мышцы венозной крови при этом резко падает содержание кислорода, растет концентрация угольной и молочной кислот, аденозина. Среди факторов, обеспечивающих снижение тонуса сосудов в мышце при ее работе, ведущими являются быстрое повышение внеклеточной концентрации ионов калия, гиперосмолярность, а также снижение pH тканевой жидкости.
Серотонин, брадикинин, гистамин оказывают сосудорасширяющее действие в скелетных мышцах. Адреналин при взаимодействии с а-адреноре- цепторами вызывает констрикцию, с p-адренорецепторами—дилатацию мышечных сосудов, норадреналин обладает сосудосуживающим действием через а-адренорецепторы. Ацетилхолин и АТФ приводят к выраженной дилатации сосудов скелетных мышц.
9.1.5.10. Сопряженные функции сосудов
Органным сосудам присущи три сопряженные функции: резистивная, емкостная и обменная. Резистивная функция присуща сосудам всех органов и тканей и определяет величину сопротивления кровотоку. В естественных условиях циркуляции изменения резистивной функции гладких мышц сосудов в регионах определяет степень перераспределения кровотока между ними.
В артериальном отделе сосудистого русла, играющем наиболее существенную роль в резистивной функции сосудов, содержится только 15—18 % циркулирующей крови. В то же время в области большого объема (или, по другой классификации, — низкого давления) находится 70—75 % крови. В связи с этим для понимания механизмов и закономерностей органного кровообращения немаловажное значение имеет емкостная функция сосудов.
Главной отличительной особенностью венозных сосудов по сравнению с артериальными является то, что они имеют по крайней мере две четко выраженные функции: емкостную и резистивную, тогда как артериальным сосудам присуща лишь резистивная функция, а емкостная практически сведена к минимуму. Емкостная функция венозных сосудов направлена на формирование венозного возврата крови к сердцу и объема циркулирующей крови.
9.1.6. Микроциркуляция (микрогемодинамика)
К микроциркуляторному руслу относят сосуды: распределители капиллярного кровотока (терминальные артериолы, метартериолы, артериовенуляр- ные анастомозы, прекапиллярные сфинктеры) и обменные сосуды (капил-
|
|
| Эндотелиальные клетки |
| Капиллярная мембрана |
| Межклеточный цемент Поры |
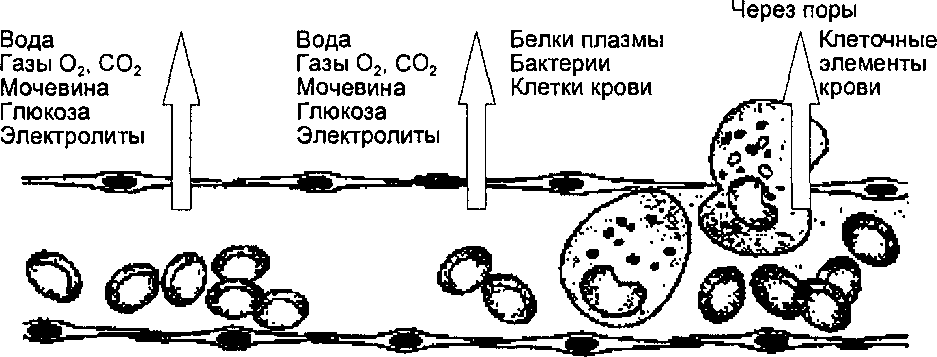
Рис. 9.24. Проницаемость капилляров для жидкости, белков и клеток крови.
ляры и посткапиллярные венулы). В месте отхождения капилляров от ме- тартериол имеются одиночные гладкомышечные клетки, получившие функциональное название «прекапиллярные сфинктеры».
Стенки капилляров гладкомышечных элементов не содержат. В капиллярах наиболее благоприятные условия для обмена между кровью и тканевой жидкостью: высокая проницаемость стенки капилляров для воды и растворенных в плазме веществ; большая обменная поверхность капилляров; гидростатическое давление, способствующее фильтрации на артериальном и реабсорбции на венозном концах капилляра; медленная линейная скорость кровотока, обеспечивающая достаточный контакт крови с обменной поверхностью капилляров.
Стенки капилляров образованы расположенными в один слой эндотелиальными клетками (рис. 9.24). В зависимости от ультраструктуры стенок выделяют три типа капилляров: соматический, висцеральный, синусоидный. Стенка капилляров соматического типа образована сплошным слоем эндотелиальных клеток, в мембране которых имеется большое количество мельчайших пор диаметром 4—5 нм. Этот тип капилляров характерен для кожи, скелетных и гладких мышц, миокарда, легких. Стенка капилляров соматического типа легко пропускает воду, растворенные в ней кристаллоиды, но мало проницаема для белка. Клетки капилляров висцерального типа имеют в мембране эндотелия «окошки» — фенестры, которые представляют собой пронизывающие цитоплазму эндотелиальных клеток отверстия, диаметром 40—60 нм, затянутые тончайшей мембраной. Такой тип капилляров представлен в почках, кишечнике, эндокринных железах, т. е. органах, в которых всасывается большое количество воды с растворенными в ней веществами. Капилляры синусоидного типа имеют прерывистую стенку с большими просветами. Диаметр капилляров — синусоид — колеблется от 1 до 4 мкм. Такой тип капилляров обеспечивает высокую проницаемость не только для жидкости, но и для белка и клеток крови. Он имеется в селезенке, печени, костном мозге.
Состояние капиллярного русла характеризуется отношением числа функционирующих капилляров к нефункционирующим. При увеличении числа функционирующих капилляров возрастает величина их обменной поверхности, снижается диффузионное расстояние между капиллярами и клетками и улучшается кровоснабжение ткани. Несмотря на небольшую толщину стенки капилляров (0,7—1,5 мкм), растяжимость их мала. Это обусловлено механическими свойствами окружающей капилляр соединительной ткани органа.
Гидростатическое давление на артериальном конце «усредненного» капилляра равно примерно 30 мм рт. ст., на венозном — 10—15 мм рт. ст. Этот показатель варьирует в различных органах и тканях и зависит от соотношения пре- и посткапиллярного сопротивления, которое и определяет его величину. Так, в капиллярах почек он может достигать 70 мм рт. ст., а в легких — только 6—8 мм рт. ст.
Транскапиллярный обмен веществ обеспечивается путем диффузии, фильтрации-абсорбции и микропиноцитоза. Скорость диффузии высока: 60 л/мин. Легко осуществляется диффузия жирорастворимых веществ (СО2, О2), водорастворимые вещества попадают в интерстиций через поры, крупные вещества — путем пиноцитоза.
Второй механизм, обеспечивающий обмен жидкости и растворенных в ней веществ между плазмой и межклеточной жидкостью,— фильтрация-абсорбция. Давление крови на артериальном конце капилляра способствует переходу воды из плазмы в тканевую жидкость. Белки плазмы, создавая онкотическое давление, равное примерно 25 мм рт. ст., задерживают выход воды. Гидростатическое давление тканевой жидкости около 3 мм рт. ст., онкотическое — 4 мм рт. ст. На артериальном конце капилляра обеспечивается фильтрация, на венозном — абсорбция. Между объемом жидкости, фильтрующейся на артериальном конце капилляра и абсорбирующейся в венозном конце, существует динамическое равновесие.
Линейная скорость кровотока в сосудах микроциркуляторного русла мала—от 0,1 до 0,5 мм/с. Низкая скорость кровотока обеспечивает относительно длительный контакт крови с обменной поверхностью капилляров и создает оптимальные условия для обменных процессов.
Отсутствие мышечных клеток в стенке капилляров указывает на невозможность активного сокращения капилляров. Пассивное сужение и расширение капилляров, величина кровотока и количество функционирующих капилляров зависят от тонуса гладкомышечных структур терминальных артериол, метартериол и прекапиллярных сфинктеров.
Процессы транскапиллярного обмена жидкости в соответствии с уравнением Старлинга (рис. 9.25) определяется силами, действующими в области капилляров: капиллярным гидростатическим давлением (Рс) и гидростатическим давлением интерстициальной жидкости (Pi), разность которых (Pc — Pi) способствует фильтрации, т. е. переходу жидкости из внутрисосудистого пространства в интерстициальное; коллоидно-осмотическим давлением крови (Пс) и интерстициальной жидкости (ПО, разность которых (Пс — ni) способствует абсорбции, т. е. движению жидкости из тканей во внутрисосудистое пространство, ст — осмотический коэффициент отражения капиллярной мембраны, который характеризует реальную проницаемость мембраны не только для воды, но и для растворенных в ней веществ, а также белков. Если фильтрация и абсорбция сбалансированы, то наступает «старлинговое равновесие».
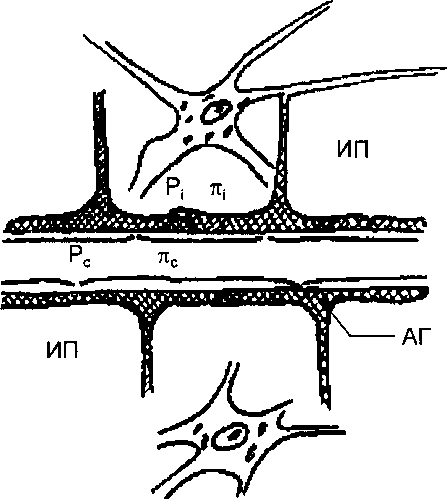
| AV/At = ± CFG {(Рс - PJ - а (лс - тг}} |
| Рис. 9.25. Транскапиллярный обмен жидкости (по Старлингу). |
| ИП — интерстициальное пространство. Остальные обозначения — в тексте. |
Для оценки функциональной активности шунтирующих сосудов (артериовенозных анастомозов) используют возможность перехода частиц, превышающих по размерам диаметр капилляров, из артериального отдела сосудистого русла в венозный.
Рассчитано, что кровоток через анастомозы во много раз превышает кровоток по капиллярам. Так, через анастомоз диаметром 40 мкм может пробрасываться в 250 раз больше крови, чем через капилляр такой же длины, но диаметром 10 мкм. Диаметр артериовенозных анастомозов в разных органах колеблется в широких пределах (например, в сердце — 70—170 мкм, в почках — 30—440 мкм, в печени — 100—370 мкм, в тонком кишечнике — 20—180 мкм, в легких — 28—500 мкм, в скелетных мышцах — 20—40 мкм).
9.1.7. Центральная регуляция кровообращения
Нервная регуляция сердечно-сосудистой системы является мощным и быстрым путем изменения кровообращения. Нервные влияния на гладкомышечные клетки сосудов являются высшими по сравнению с влиянием на сосуды гуморальных веществ, содержащихся в крови, поскольку первые обеспечивают не только быструю, но и, если необходимо, локализованную регуляцию.
Нормальное функционирование системы кровообращения в условиях постоянно меняющихся внешних воздействий осуществляется только при участии механизмов регуляции (управления, контроля). Непременным условием рассматриваемого вопроса является цель регуляции (управления). В физиологии принято употреблять выражение не «цель», а «физиологическое значение (роль)» регуляторного механизма.
Две части системы управления — управляющее устройство и объект управления — образуют вместе контур управления. В кровообращении в качестве объекта управления можно выделить капиллярное русло и течение крови по нему, обеспечивающие питание тканей, тогда управляющими устройствами являются отделы сердечно-сосудистой системы и свойства крови, обеспечивающие необходимый кровоток в капиллярном русле в ходе быстротекущих событий. Однако большинство авторов в качестве объекта управления в системе кровообращения рассматривают системное артериальное давление. Поддержание артериального давления на постоянном уровне является залогом обеспечения нутритивной функции системой. Другие авторы объектом управления в системе считают сердечный выброс. В любом из этих случаев на первый план выступает рефлекторная регуляция кровообращения.
9.1.7. 7. Рефлекторная регуляция кровообращения
Роль каротидных синусов в регуляции кровообращения была доказана тем, что при раздражении ветви языкоглоточного нерва — нерв каротидного синуса, имело место рефлекторное замедление частоты сердечных сокращений и независимое от него снижение артериального давления. В дальнейшем была открыта барорецепторная область не только в каротидном синусе, но и в дуге аорты, чувствительные волокна от которой проходят в составе аортального нерва.
При двустороннем повышении давления в изолированных каротидных синусах на 15 мм рт. ст. происходят снижение системного артериального давления и замедление частоты сокращений сердца. Снижение давления в обоих каротидных синусах до 30 мм рт. ст. (пережатие сонных артерий) сопровождается значительным повышением АД и ростом частоты сокращений сердца. Степень вовлечения артериальных сосудов различных регионарных областей в рефлекторную барорецепторную реакцию различна. Наиболее мощные вазомоторные эффекты отмечены в скелетных мышцах, менее выражены реакции сосудов брыжейки, кожи и почек. Изменения сердечного выброса при синокаротидных барорефлексах невелики.
Указанные рефлексогенные зоны чувствительны и к изменениям напряжения в крови О2, СО2 и pH. Стимулятором хеморецепторов этих областей являются также изменения температуры крови, кровопотеря, а также некоторые вещества (цианиды, никотин, лобелии, серотонин и др.).
При раздражении каротидных хеморецепторов повышается сопротивление сосудов, замедляется частота сердечных сокращений и снижается насосная функция сердца, повышается артериальное давление, кровоток в коронарных сосудах увеличивается. Наименьшее сужение сосудов при этом рефлексе отмечено в сосудах почек и мозга, наибольшее — в сосудах бассейна подвздошной артерии и конечностей.
В ответ на раздражение аортальных хеморецепторов увеличивается частота сердечных сокращений, повышается АД, суживаются сосуды, причем более выражено в брыжеечной и почечной областях, менее — в бедренной артерии.
9.1.7.2. Спинальный уровень регуляции
Эффекторными клетками, осуществляющими регуляцию сердца и сосудов на уровне спинного мозга, являются симпатические преганглионарные нейроны. Они обладают спонтанной фоновой импульсной активностью, частота которой коррелирует с изменениями частоты сокращений сердца и пульсовыми колебаниями артериального давления. Спинальные нейроны представляют собой важное промежуточное звено по пути нисходящих нейрогенных влияний, адресованных эффекторам в сердечно-сосудистой системе. Ядра боковых рогов спинного мозга могут обеспечивать преобразование нервных импульсов по дивергентному и конвергентному типу.
Перерезка в эксперименте на животных спинного мозга на уровне шейных и верхних грудных сегментов приводит к значительному снижению (до 60 мм рт. ст.) артериального давления. Однако если перерезка выполнена в щадящих условиях препаровки (например, при помощи ультразвукового ножа), уже через несколько часов давление восстанавливается практически до нормальных величин. В этих же условиях восстанавливаются и сосудодвигательные рефлексы. Эти факты свидетельствуют о том, что спинной мозг при определенных условиях может являться уровнем замыкания рефлексов сердечно-сосудистой системы. В то же время в естественных условиях рефлексы сердечно-сосудистой системы осуществляются при обязательном участии бульбарных и гипоталамических образований головного мозга.
9.7.7.3. Бульбарный уровень регуляции
Современные представления о бульбарных механизмах регуляции кровообращения основаны на исследованиях, в которых показано влияние как перерезок на разных уровнях, так и стимуляции различных бульбарных структур на артериальное давление и частоту сердечных сокращений, а также на импульсации в симпатических и парасимпатических нервах. Раздражение продолговатого мозга и варолиева моста оказывает либо прессорные, либо депрессорные изменения АД в зависимости от локализации раздражающих электродов: прессорные зоны располагаются, как правило, ростральнее и латеральнее депрессорных. При перерезке на уровне ядер лицевого нерва отделяется расположенная ростральнее часть прессорной области, тогда как депрессорная остается интактной. В этом случае снижается артериальное давление и уменьшается импульсации в эфферентных вегетативных нервах. Перерезка продолговатого мозга на уровне задвижки ведет к еще большему снижению давления и полному прекращению импульсации по вегетативным нервам. Бульбарная медиальная депрессорная область оказывает угнетающее тоническое влияние на спинальные преганглионарные нейроны, способные к спонтанной импульсивной активности.
Латеральные участки бульбарной ретикулярной формации содержат скопления спонтанно активных нейронов, которые через нисходящие пути спинного мозга оказывают стимулирующее влияние на спинальные преганглионарные симпатические нейроны. Эти нейроны образуют латеральную «прессорную» область продолговатого мозга. Функции этих нейронов осуществляются в реципрокном взаимодействии с нейронами медиальной «депрессорной» зоны.
Указанный медуллярный комплекс, реализующий влияния на сердечнососудистую систему через симпатические нервы, называют бульбарным сосудодвигательным центром. Функционально он включает в себя и структуры дорсального ядра блуждающего нерва, обеспечивающие тонические кардиоингибирующие влияния. Поэтому говорят о едином бульбарном центре сердечно-сосудистой системы, получающем информацию от различных рецепторных зон и обеспечивающем поддержание циркуляторного гомеостазиса. Это достигается благодаря реципрокному взаимодействию симпатических и парасимпатических рефлекторных влияний на сердце, а также дозировкой тонических констрикторных влияний симпатических нервов на сосуды.
В вентролатеральных отделах продолговатого мозга сосредоточены образования, соответствующие по своим характеристикам тем представлениям, которые вкладывают в понятие «вазомоторный центр». Здесь сконцентрированы нервные элементы, играющие ключевую роль в тонической и рефлекторной регуляции кровообращения. В вентральных отделах продолговатого мозга расположены нейроны, изменение тонической активности которых ведет к активации симпатических преганглионарных нейронов. Структуры этих отделов мозга контролируют выброс вазопрессина клетками супраоптического и паравентрикулярного ядер гипоталамуса.
Доказаны проекции нейронов каудальной части вентральных отделов продолговатого мозга к клеткам его ростральной части, что свидетельствует о возможности тонического угнетения активности этих клеток. Функционально значимы связи структур вентральных отделов продолговатого мозга с ядром солитарного тракта, которое играет ключевую роль в обработке афферентации от хемо- и барорецепторов сосудов.
К вентральным отделам продолговатого мозга информация поступает как от его структур — ядер солитарного тракта, area postrema, вестибулярных ядер, ядер шва, обоюдного ядра, так и от клеток спинного мозга и супрабульбарных структур центральной нервной системы. Наиболее значимыми в функциональном плане для структур ростральной части вентральных отделов являются их связи с симпатическими преганглионарными нейронами спинного мозга, а для структур каудальных вентролатеральных отделов — восходящие проекции к нейросекреторным клеткам гипоталамуса.
Структуры ростральной части вентральных отделов продолговатого мозга играют ключевую роль в тоническом контроле уровня артериального давления. Стимуляция нейронов рострального вентролатерального ядра вызывает подъем АД, тахикардию, торможение барорецепторных рефлексов, высвобождение адреналина из надпочечников и аргинин-вазопресси- на из нейросекреторных клеток гипоталамуса. Возбуждение нейронов каудальной части вентральных отделов ведет к снижению системного АД. Структуры вентральных отделов участвуют в контроле сердечной деятельности и через обоюдное ядро блуждающего нерва.
Нейроны ростральной части вентральных отделов продолговатого мозга являются звеном дуг собственных и сопряженных сосудистых рефлексов, а нейроны каудальной части — модулируют реализацию на сосуды указанных рефлексов.
Сердечно-сосудистый центр продолговатого мозга оказывает тоническое возбуждающее влияние на преганглионарные симпатические нейроны тораколюмбального отдела спинного мозга. Однако его влияние является не единственными связями, конвергирующими на спинальных вегетативных нейронах. В медуллярной области происходит переключение путей нисходящих возбуждающих и тормозных кардиоваскулярных влияний, исходящих из вышележащих отделов центральной нервной системы. Собственная тоническая активность спинальных нейронов в норме зависит от нисходящих бульбарных и супрабульбарных влияний, эти нисходящие влияния полностью доминируют над их спонтанной активностью. Несмотря на то что сегментарные спинальные вазомоторные рефлексы (например, побледнение кожи над областью внутрибрюшинной воспалительной реакции) могут иметь место, замыкание собственных сердечно-сосудистых рефлексов происходит не ниже, чем на бульбарном уровне. Однако и бульбарный уровень регуляции в естественных условиях модулируется сложной совокупностью нисходящих к нему влияний, среди которых ведущую роль играют нейрогуморальные влияния гипоталамического происхождения.
9.1.7.4. Гипоталамические влияния
Традиционно гипоталамус делят на передний — депрессорный (парасимпатический, трофотропный) и задний — прессорный (симпатический, эрго- тропный), однако это деление весьма условно. Выраженные прессорные реакции могут быть вызваны и с передних отделов гипоталамуса (супраоптическое ядро). Депрессорные или прессорные эффекты можно получить в зависимости от частоты подаваемых на структуру импульсов (депрессорные—при низких частотах — 20—40 имп/с, прессорные — 60—100 имп/с), функционального состояния центров (вид, глубина наркоза) и от исходного тонуса сосудов.
Опыты на животных с перерезками, коагуляцией и раздражением гипоталамических структур и нисходящих путей показали, что имеются два основных вазоконстрикторных пути: от переднего гипоталамуса (от супраоптического ядра по срединному пучку переднего мозга и по периферии вентромедиального ядра) и от заднего гипоталамуса (от периферии III желудочка над маммилярными телами и дорсолатеральнее субталомической области: неопределенная зона и поля Фореля 1—2 через перивентрикулярные безмякотные волокна). Каудальнее оба пути проходят в центральном сером веществе сильвиева водопровода, в покрышке мозга и в продольном дорзальном пучке спускаются к дну IV желудочка. Здесь образуются синапсы с клетками ядра блуждающего нерва и вазомоторного центра. На протяжении этих путей отходят многочисленные коллатерали в ретикулярную формацию ствола мозга. Таким образом, первое симпатическое переключение имеет место в ретикулярной формации продолговатого мозга, второе — на вазомоторных нейронах спинного мозга (общий конечный путь сосудодвигательных реакций).
Наиболее универсальным механизмом реакции сердечно-сосудистой системы на возбуждение гипоталамуса является активация симпатической системы. Типичным результатом возбуждения гипоталамических структур в этом случае является альфа-адренергическая констрикция периферических сосудов в сочетании с положительными хронотропными и инотропными влияниями на сердце.
Симпатические эффекторы, обусловленные гипоталамическими влияниями, вызывают и дилатацию периферических сосудов. Это достигается симпатической холинергической или p-адренергической дилатацией, а также результатом центрального нисходящего гипоталамического торможения бульбарных сердечно-сосудистых центров.
Гипоталамические влияния на кровообращение реализуются и гуморальным путем. Возбуждение гипоталамуса сопровождается выделением вазопрессина в гипофизе и адреналина в надпочечниках с их последующим действием на сердце и сосуды, а также выделением ренина почками в результате прямых нейрогенных влияний на их юкстагломерулярный аппарат. Конечным результатом этого процесса является повышение артериального давления за счет усиленного образования и нарастания в крови ангиотензина II.
Гипоталамической отдел регуляции кровообращения оказывает дифференцированное влияние на сердце и некоторые сосудистые бассейны. Так, раздражение гипоталамических центров «защитных» реакций организма вызывает увеличение сердечного выброса, повышение артериального давления, сужение сосудов внутренних органов, но при этом имеет место расширение артериальных сосудов скелетных мышц. Стимуляция пищевых центров в латеральном гипоталамусе приводит, наоборот, к расширению сосудов желудочно-кишечного тракта и их сужению в скелетных мышцах.
Гипоталамические нейроны получают сигналы практически от всех экстеро- и интероцепторов организма, включая артериальные барорецепторы, импульсы от которых поступают в передний гипоталамус. Кроме того, гипоталамические нейроны получают информацию об изменениях внутренней среды организма (температуры, кислотности, осмолярности и др.). Следовательно, существует еще одна рефлекторная функция гипоталамуса, физиологический смысл которой заключается в обработке и интеграции этой информации, и включения в общую реакцию сердечно-сосудистой системы, направленную на поддержание гомеостазиса. Эта функция гипоталамуса включает в себя и контроль деятельности нижележащих бульбарных и спинальных структур, ответственных за регуляцию кровообращения.
Важная роль гипоталамуса заключается также в координации кровообращения с другими висцеральными и соматическими функциями. Так, эмоциональным состояниям человека, связанным с активацией гипоталамических структур, соответствуют и определенные изменения гемодинамики. Поэтому считается, что гипоталамус осуществляет координацию сома- томоторных и вегетативных проявлений эмоционального поведения.
9.7.7.5. Участие лимбических структур
Лимбическая система, или «висцеральный мозг», представляет собой комплекс структур на медиальной поверхности полушарий мозга. При электрическом раздражении передних отделов системы имеет место умеренная гипотензия и брадикардия. Стимуляция переднего отдела лимбической коры вызывает депрессорную реакцию с верхних участков, а с базальных (нижних) участков провоцируются прессорные ответы.
Выраженная гипотензия и брадикардия зарегистрированы при раздражении прозрачной перегородки, функционально относящейся к лимбической системе. Эта реакция аналогична эффектам раздражения сердечнотормозного центра гипоталамуса и является одним из элементов центрального комплекса экстренного снижения сосудистого тонуса и частоты сокращений сердца.
Для стимуляции гиппокампа характерны «парасимпатические ответы» (снимаемые атропином гипотензия и брадикардия). Функционально к ростральной части гиппокампа примыкает миндалевидно-ядерный (амигда- лярный) комплекс, имеющий тесные связи с заднелатеральным гипоталамусом. Амигдалярные влияния модулируют чрезмерные гипоталамические реакции. Для раздражения самого миндалевидного комплекса характерны дифференцированные влияния на сердце и тонус сосудов: брадикардия предшествует позже развивающейся гипертензии, т. е. изменения ритма сердца не являются вторичными, обусловленными барорецептивными рефлексами. Через амигдалу и передние отделы гипоталамуса реализуются рефлекторные изменения кровообращения при раздражении афферентных волокон блуждающего нерва.
9.1.7.6. Кортикальные влияния
Изучению роли коры больших полушарий в регуляции кровообращения уделялось пристальное внимание, но результаты этих исследований до настоящего времени весьма противоречивы. В экспериментах на животных удаление обоих полушарий не вызывает каких-либо существенных изменений кровообращения. Электрическая стимуляция участков лобной и теменной областей коры ведет к изменениям артериального давления в результате сужения или расширения сосудов, причем, в зависимости от параметров раздражения стимуляция одних и тех же точек, может вызвать как вазоконстрикцию, так и вазодилатацию.
Влияние коры больших полушарий на сердце связано с высшей нервной деятельностью человека — реализацией эмоциональных, поведенческих реакций и условных рефлексов. Последние могут образовываться на основе сопряженных кардиальных рефлексов. Изменения кровообращения, обусловленные собственными рефлексами сердечно-сосудистой системы, воспроизвести условнорефлекторным путем не удалось. Условно- рефлекторные реакции сердца являются составной частью сложных поведенческих рефлексов. У человека эти реакции могут быть вызваны и словесными раздражителями (речевыми сигналами). Однако произвольно изменить параметры сердечной деятельности возможно только косвенно через заведомо управляемые системы: дыхание или скелетную мускулатуру, а также в некоторых случаях — изменяя эмоциональное состояние организма.
Большее значение имеют кортикальные механизмы в реализации изменений кровообращения при стрессорных и невротических состояниях человека.
9.1.7.7. Общая схема центральной регуляции
На рис. 9.26 представлена общая схема организации центральных звеньев нервной регуляции кровообращения. Сердечно-сосудистый центр продолговатого мозга состоит из двух зон (А и Б) одна из которых определяет сужение сосудов (А'), ускорение и усиление сердцебиения (АП), тогда как другая — расширение сосудов (Б') и замедление частоты сокращений сердца (БП). Тонически активные нейроны зоны А непосредственно или через промежуточные нейроны возбуждают преганглионарные и ганглионарные симпатические нейроны, иннервирующие сердце и сосуды, и в то же время тормозят нейроны зоны Б. Последние активируются сигналами барорецепторов сердечно-сосудистой системы. Через короткие внутрицентральные пути нейроны зоны Б тормозят нейроны зоны А, а посредством нисходящих тормозных путей — и преганглионарные симпатические нейроны. Кроме того, через моторное ядро блуждающих нервов нейроны зоны Б влияют на ганглионарные парасимпатические нейроны сердца. В результате обе зоны (А и Б), получая основную сигнализацию от рецепторов сердечно-сосудистой системы, являются основой поддержания кровообращения, сочетанно подвергая сердце тоническому контролю тормозных вагусных и возбуждающих симпатических волокон, тогда как постоянный контроль сосудов обеспечивается только симпатическими вазоконстрикторными волокнами.
Афферентная нервная система является источником сигналов собственных и сопряженных рефлексов. Вход первых ограничен продолговатым мозгом, причем барорецепторы сердечно-сосудистой системы связаны с зоной Б, а хеморецепторы — с зоной А.
|
|
| Кора |
| нервной регуляции сердечно |
| центральных звеньев |
| Рис. 9.26. Схема организации сосудистой системы (объяснение в тексте). |
Поскольку сердечно-сосудистый центр продолговатого мозга регулирует основные параметры системной гемодинамики, даже будучи отключенным от связей с вышележащими нервными структурами, он функционирует как истинный «центр», обладающий значительной независимостью. Следовательно, супрабульбарные структуры признаются несущественными ни для прямой тонической регуляции кровообращения, ни для осуществления сердечно-сосудистых рефлексов. В то же время при общих реакциях организма (поведенческих, эмоциональных, стрессорных и др.) кора мозга, гипоталамус и другие супрабульбарные структуры могут вмешиваться в деятельность сердечно-сосудистой системы, изменяя путем нисходящих (модулирующих) влияний возбудимость бульбарного центра.
Вазомоторные центры спинного мозга самостоятельного значения в регуляции кровообращения не имеют. Действующими элементами спинального уровня являются лишь симпатические преганглионарные нейроны, которые входят в состав эфферентного звена бульбарных рефлекторных дуг.
Лимфообращение
Основной функцией лимфатической системы является резорбция из интерстиция белков и других веществ, вышедших в него из кровеносного русла и неспособных вновь вернуться в кровоток через кровеносные капилляры, с последующей транспортировкой этих веществ и жидкости по лимфатическим сосудам в венозную систему.
Поскольку в указанной системе транспорт жидкости и включенных в нее веществ осуществляется по пути: кровеносное русло—интерстиций— лимфатические сосуды (лимфообразование и лимфоток)—кровеносное русло, это является основанием для использования термина «лимфообращение».
Физиологическая характеристика интерстиция и лимфообразования представлена в главе 2, поэтому здесь рассматриваются только вопросы лимфотока.
У взрослого человека за сутки из кровеносного русла в интерстиций выходит около 20 л жидкости, из которой 1,5—2,5 л в виде лимфы возвращается в кровеносную систему по лимфатическим сосудам. Вместе с жидкостью из крови в интерстиций за сутки мигрирует 50—100 % всех циркулирующих в плазме белков. Значительная часть их должна возвратиться в кровеносное русло, что и достигается благодаря функционированию лимфатической системы, регулирующей экстраваскулярное обращение плазменных белков. Увеличение объема интерстициальной жидкости ведет к повышению резорбирующей функции лимфатической системы. При этом деятельность ее направлена на нормализацию объема интерстициальной жидкости как путем ускорения вывода избытка ее из тканей в кровь, так и частичного депонирования в лимфатической системе.
Находящаяся в интерстиции жидкость движется по направлению к лимфатическим капиллярам по так называемым соединителънотканевым пре- или паралимфатическим транспортным путям. Примером такого пути могут служить пространства Диссе в печени, с одной стороны ограниченные кровеносными синусоидами, а с другой — «балочками» из клеток печени. Лимфатические капилляры окружают «кольцом» фрагменты сети кровеносных капилляров и топографически связаны с посткапиллярными венулами. Это создает предпосылки для возникновения градиентов давления на границе раздела интерстициальная жидкость — терминальная лимфа, определяющих в интерстициальном пространстве направление перемещения жидкости и белка и поступление их в корни лимфатической системы. Последние сообщаются с интерстициальным пространством через отверстия в эндотелиальной выстилке лимфатических капилляров.
Основными путями попадания крупно- и жидкодисперсных частиц в просвет лимфатических капилляров являются: а) места соединения эндотелиальных клеток, б) пиноцитозные пузырьки, в) цитоплазма эндотелиальной клетки. Когда гидростатическое давление в тканях становится выше, чем в лимфатическом капилляре, проникающая в него жидкость растягивает межэндотелиальные соединения. При этом эндотелиальная клетка, не связанная с фиксирующими волокнами и контактирующая в обычных условиях с другой клеткой, свободно отгибается в просвет сосуда, открывая для крупных молекул доступ в лимфатический капилляр. Этому содействует приводящее к накоплению интерстициальной жидкости повышение осмотического давления в интерстиции, при котором набухание тканей вызывает натяжение фиксирующих волокон и расширение лимфатических капилляров.
Макромолекулы и частицы диаметром 3—50 мкм проникают в просвет лимфатических капилляров через эндотелиальные клетки с помощью пи- ноцитозных пузырьков или везикул. Этим путем в лимфатические капилляры поступают белки, хиломикроны и ионы.
9.2. 1. Лимфатические сосуды
Лимфатическая система состоит из мелких внутриорганных лимфатических сосудов, отводящих лимфу из лимфатических капилляров; внеорган- ных лимфатических сосудов, отводящих лимфу из органов в лимфатические узлы; внеорганных лимфатических сосудов, отводящих лимфу из лимфатических узлов; крупных лимфатических сосудов — стволов, протоков, отводящих лимфу в венозную систему.
Форма лимфатических сосудов преимущественно цилиндрическая. Она отличается от вида артерий и вен чередованием многочисленных, сменяющих друг друга расширений и сужений, придающих им сходство с четками, что объясняется наличием в этих сосудах многочисленных клапанов.
Клапаны лимфатических сосудов препятствуют обратному току лимфы. Благодаря им при сокращении стенки лимфатического сосуда лимфа течет только в центрипетальном направлении. Клапаны и стенка лимфатического сосуда в структурном и функциональном отношении составляют единое целое. Клапаны имеют створки — парные, расположенные друг против друга полулунные складки интимы. Створки имеют два края, один из них прикреплен к стенке сосуда в месте его сужения, другой — свободно свисает в просвет сосуда.
Часть лимфатического сосуда между двумя клапанами называется лим- фангион. или клапанный сегмент. В лимфангионе различают мышцесодержащую часть, или мышечную манжетку, и область прикрепления клапана, в которой мускулатура развита слабо или отсутствует.
Поскольку средняя и адвентициальная оболочки не имеют нервных окончаний, активность лимфангионов считается миогенной. Лимфатическим сосудам свойственны: фазные ритмические сокращения, медленные волны, тонус. Фазное ритмическое сокращение представляет собой быстрое сужение отдельного участка сосуда, сменяемое быстрым расслаблением. Эта активность может быть спонтанной или вызванной (растяжением, повышением температуры, гуморальными воздействиями). Фазные ритмические сокращения следуют с частотой 10—20 в 1 мин.
Медленные волны представляют собой колебания просвета сосуда неодинаковой продолжительности и амплитуды. Продолжительность медленной волны может составлять от 2 до 5 мин. Эти волны лимфатических сосудов непостоянны, появляются спонтанно или в ответ на действие вазоактивных веществ.
Тонус лимфатических сосудов является отражением активности их тонических клеток, модулируемой местными, гуморальными или нервными факторами. В естественных условиях тонус гладких мышц лимфатических сосудов обусловливает определенную жесткость их стенок, препятствуя пе- рерастяжению последних, создает исходный фон для фазных сокращений, поддерживает внутрисосудистое давление, необходимое для реализации фазной активности. Изменения тонуса лимфатических сосудов лежат в основе регуляции объема лимфатической системы.
9.2.2. Лимфатические узлы
На объем и состав лимфы влияет наличие в системе лимфатических узлов, У человека их примерно 460. Функции лимфатических узлов — гемопоэтическая, иммунопоэтическая, защитно-фильтрационная, обменная, резервуарная, пропульсивная. Лимфатические узлы играют роль не только механического, но и биологического фильтра, задерживающего поступление в кровь инородных частиц, бактерий, клеток злокачественных опухолей, токсинов, чужеродных белков. К узлу обычно подходят 2—4 приносящих сосуда, а выходят 1—2 выносящих, поэтому количество послеузловой лимфы в среднем в 3 раза меньше, чем доузловой. Сопротивление узлов току перфузата в несколько раз больше, чем в лимфатических сосудах; возможно, поэтому входящие в узел лимфатические сосуды обладают более мощным слоем гладкомышечных клеток, чем выходящие. Роль узла заключается не только в создании сопротивления току лимфы и замедления ее движения, но и в депонировании лимфы, перераспределении жидкости между кровью и лимфой. При возникновении венозного застоя лимфатические узлы увеличиваются на 40—50 %.
Лимфатические узлы содержат гладкомышечные элементы и могут поэтому сокращаться при нейрогуморальных или местных влияниях: они обладают сходной с лимфатическими сосудами сократительной активностью.
Лимфатические узлы, кровоснабжение которых очень обильно, содержат фагоцитарные клетки, разрушающие чужеродные вещества, которые поступают в узлы с лимфой. Они также вырабатывают лимфоциты и плазматические клетки и синтезируют антитела. Лимфатические узлы играют роль мощных защитных барьеров против бактерий, попадающих в организм.
9.2.3. Лимфоток
Содержимое двух больших терминальных каналов — правого и левого грудных протоков — поступает, соответственно, в правую и левую подключичные вены у их соединения с яремными венами. Скорость тока лимфы варьирует в широких пределах в различных магистральных и органных лимфатических сосудах. Так, лимфоток в грудном протоке собаки составляет 0,03—0,4 мл/мин, в кишечнике — 0,06—0,2 мл/мин, в печени — 0,01 — 0,2 мл/мин, в миокарде — 0,01—0,6 мл/мин, в почке и конечности — 0,01— 0,7 мл/мин. У человека лимфоток в грудном протоке колеблется от 0,4 до 1,3 мл/кг/мин.
Скорость движения лимфы по сосудам зависит от ряда факторов: вне- сосудистых — сокращений скелетных мышц, перистальтики кишечника, дыхательных экскурсий грудной клетки, пульсаций рядом лежащих артерий; внутрисосудистых — сил vis a tergo, лимфообразования, сократительной активности стенок лимфатических сосудов.
Уменьшение онкотического давления белков плазмы или повышение венозного (и, соответственно, капиллярного) давления ведет к увеличению объема оттекающей лимфы. Любые водные нагрузки, вызывающие увеличение объема циркулирующей крови, приводят к увеличению лимфотока. Повышение венозного давления в портальной системе на 1—2 см водн. ст. увеличивает лимфоток из печени в 10—12 раз.
9.2.4. Нервные и гуморальные влияния
Существование лимфатических сосудов только у позвоночных является свидетельством наибольшего совершенства их интерстиция, а сам аппарат лимфатических сосудов — наисовершеннейшей системой интерстиция, которая не обязательна для примитивной жизни тканей (она отсутствует у беспозвоночных).
Нервные волокна достигают лимфатических сосудов по ходу vasa vaso- rum; степень развития гладких мышц лимфатических сосудов коррелирует
с их иннервацией. Там, где мускулатура стенки лимфатических сосудов достигает большей степени развития, она содержит мышечные и адвентициальные вегетативные нервные сплетения.
Лимфатические сосуды снабжены адренергическими и холинергическими нервными волокнами. Эти волокна из периадвентициальных сплетений артерий распространяются на сопровождающие их вены и близлежащие лимфатические сосуды, образуя из них сплетения. Интенсивность иннервации лимфатических сосудов в 2—2,5 раза слабее, чем артерий. Адренергические и холинергические волокна концентрируются в местах перехода лимфатических сосудов малого диаметра в более крупные, а также в местах расположения клапанов.
i Возбуждение симпатических нервов вызывает сокращение лимфатиче
ских сосудов, возбуждение парасимпатических — как сокращение, так и расслабление (зависит от исходного тонуса и ритмической активности сосуда). Грудной проток, брыжеечные лимфатические сосуды имеют двойную иннервацию — симпатическую и парасимпатическую (волокна блуж-
* дающего нерва), в то время как крупные лимфатические сосуды конечностей иннервируются симпатическим отделом нервной системы. В магистральных и периферических лимфатических сосудах учащение ритма фазных сокращений достигается активацией а-адренорецепторов. Торможение ритма спонтанных сокращений лимфатических сосудов осуществляется двойным тормозным механизмом: посредством выделения АТФ и путем активации p-адренорецепторов.
t Адреналин вызывает усиление тока лимфы и повышение давления в
* грудном протоке, увеличивает частоту и амплитуду спонтанных сокращений лимфатических сосудов брыжейки. Внутривенное введение гистамина увеличивает ток лимфы в грудном протоке и кишечном стволе, не только влияя на моторику сосудов, но и повышая проницаемость лимфатических
( капилляров. Малые концентрации гистамина стимулируют спонтанный ритм и повышают тонус лимфатических сосудов, высокие концентрации — тормозят фазную сократительную активность и увеличивают тоническое сокращение. Аналогично действует на лимфатические сосуды гепарин. АТФ тормозит ритмические сокращения грудного протока и брыжеечных лимфатических сосудов. Серотонин вызывает сокращение просвета грудного протока и брыжеечных сосудов, величина их сокращения зависит от дозы серотонина. Спонтанные ритмические сокращения лимфатических
> сосудов прекращаются в бескальциевой среде или при блокаде кальциевых каналов. В отличие от фазных, тонические сокращения этих сосудов в аналогичных условиях практически не уменьшаются. В низких концентрациях ионы калия вызывают увеличение частоты фазных сокращений лимфатических сосудов, в более высоких — увеличение тонических сокращений.
* Гиперкальциевый раствор увеличивает амплитуду спонтанных сокращений, гипокальциевый — подавляет амплитуду и ритм фазных сокращений. Уменьшение в среде ионов натрия вызывает увеличение частоты сокращений и снижение амплитуды спонтанных фазных сокращений лимфатических сосудов. Наркоз подавляет их ритмическую активность.
Лимфу в экспериментальных исследованиях на животных или в клинической лимфологии у человека забирают не из капилляров, что технически ( очень сложно или невозможно, а из крупных доузловых или послеузловых сосудов грудного протока, через который проходит лимфа, дренируемая от 3/4 тела. Лимфа из лимфатических сосудов существенно отличается от капиллярной в силу проницаемости стенки лимфатических сосудов для низкомолекулярных веществ и воды. Проницаемость лимфатических сосудов уменьшается от периферии к центру, что связано с наличием у них базальной мембраны и гладкой мускулатуры, увеличением количества эластических и коллагеновых волокон, уплотнением межэндотелиальных щелей.
Итак, основной движущей силой лимфотока является собственная сократительная активность лимфатических сосудов и узлов. При этом среднее внутрилимфатическое давление колеблется в небольших пределах и обусловлено фазами сокращений лимфатических ососудов по типу перистальтической волны. Нейрогуморальные влияния, физические и фармакологические воздействия влияют на сократительную активность лимфатических сосудов и узлов, на их емкость и пропускную способность, а также на обменные процессы в лимфатических узлах.
Дата добавления: 2021-04-05; просмотров: 60; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!