К системе подведено 1500 Дж теплоты. (2000Дж-500Дж)
0,909837
В 4,0 кг воды растворено 405 г соли, имеющей молекулярную массу 75.
Температура кристаллизации получившегося раствора составляет минус 3,66.
Криоскопическая постоянная воды равна 1,85.
Определите изотонический коэффициент соли.
(3,66*4000г*75)/(1,85*405г*1000)=1,46546547 или 1,465
В 4,0 кг воды растворено 418 г соли, имеющей молекулярную массу 77.
Температура кристаллизации получившегося раствора составляет минус 3,16.
Криоскопическая постоянная воды равна 1,85.
Определите изотонический коэффициент соли.
(3,16*4000г*77)/(1,85*418г*1000)=1,25860597 или 1,259
Температура кристаллизации некоторого вещества "А" при стандартном давлении составляет 598 К.
Известна теплота плавления вещества "А":
ΔНпл (А) = 11050 Дж/моль.
Если расплав вещества "А" содержит небольшую примесь вещества "В", то температура начала кристаллизации расплава снижается на 12,5 градусов. Вещества "А" и "В" не образуют твердых растворов.
Определите мольную долю вещества "А"в таком расплаве.
Универсальную газовую постоянную принять равной 8,314 Дж/мольК
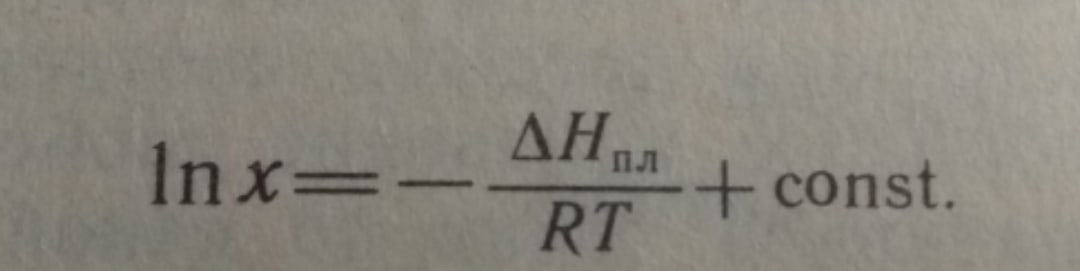
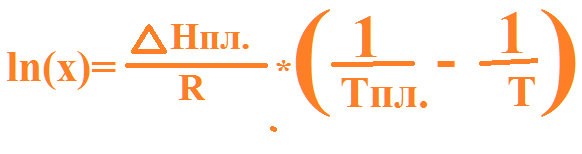
е^((11050/8,314)*((1/598)-(1/(598-12,5))))= 0,9537
Некоторое твердое вещество может находиться в двух кристаллических модификациях – альфа и бета. Известны теплоты сублимации альфа-кристаллов (минус 105 КДж/моль) и бета-кристаллов (минус 100 КДж/моль). Определите тепловой эффект перехода из бета в альфа-модификацию.
Ответ введите цифрами.
|
|
|
Размерность (КДж/моль) не указывайте.
В случае, если ответ является отрицательным числом, перед ним поставьте знак «минус» без пробелов
Бета – Альфа = -100 – (-105)= 5
Определите, какое количество теплоты необходимо для нагревания 4 моль вещества от 7 до 227 оС, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 46 + 0,005Т
Ср интегрируя = 10549 4 моль*10549 = 42196 Дж
Определите, какое количество теплоты необходимо для нагревания 5 моль вещества от 103 до 302 К, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 8,0 + 5·10-3Т
8967,4375
Определите, какое количество теплоты необходимо для нагревания 4 моль вещества от минус 30 до плюс 40 оС, если известно, что при начальной температуре вещество находится в твердом состоянии, а при 0 оС вещество плавится. Известна теплота плавления 1,4 кДж/моль. Известны теплоемкости вещества в твердом и жидком состояниях – соответственно, 2 и 4 Дж/(мольК)
Ответ укажите в Дж.
6480 
Определите, какое количество теплоты необходимо для нагревания 3 моль вещества от минус 10 до плюс 20 оС, если известно, что при начальной температуре вещество находится в твердом состоянии, а при 15 оС вещество плавится. Известна теплота плавления 2,4 кДж/моль. Известны теплоемкости вещества в твердом и жидком состояниях – соответственно, 4 и 6 Дж/(мольК)
|
|
|
7590
На какую величину изменится энтропия при нагревании 1,2 моль вещества от минус 5 оС до +44 оС?
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 33 + 0,023Т.
Ср = 1/(317-269)*итеграл = 39,7275
Дельта Эс = Эн*Ср*ln (Т2/Т1)=7,827 или примерно 8
На какую величину изменится энтропия при нагревании 2,4 моль вещества от минус 13 оС до +99 оС?
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 22 + 0,004Т.
20
На какую величину изменится энтропия при нагревании 5 моль вещества от минус 67 оС до +1 оС?
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 81 + 0,0045Т.
117,1
На какую величину изменится энтропия при нагревании 3,7 моль вещества от минус 55 оС до +55 оС?
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 11 + 0,087Т.
52
На какую величину изменится энтропия при нагревании 2,6 моль вещества от минус 22 оС до +16 оС? (251 К до 289К)
|
|
|
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 18 + 0,0244Т.
Ср = 934,344*(1/(Т2-Т1)=24,588 Дельта Эс =2,6 моль * 24,588 * ln (Т2/Т1)=9,0122826
На какую величину изменится энтропия 5 моль вещества при его кристаллизации, если известно, что температура плавления вещества – минус 23 оС, а теплота кристаллизации – минус 300 Дж/(мольК)
дельта Эс = Ку / Т = (5*(-300))/250К) = -6,25
СР0 = 31,6 – 0,054Т
Определите среднюю теплоемкость этого вещества в интервале от минус 51 до +8 оС
Выберите ответ, наиболее близкий к результату ваших вычислений (ответы приведены в Дж/(мольК).
Ср(сверху черточка)= 1/(Т2-Т1)* интеграл (=1063,121)= 18,019 или 18
Известна температурная зависимость истинной теплоемкости некоторого вещества от температуры:
СР0 = 11,7 + 0,011Т
Определите среднюю теплоемкость этого вещества в интервале от минус 15 до +65 оС
14,9
Определите, какое количество теплоты необходимо для нагревания 2 моль вещества от 200 до 230 К, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 25 + 0,02Т Ответ укажите в Дж.
|
|
|
Ср интегрированием от 200 до 230 = 25*(230-200)+(0,02*(230^2-200^2)/2)=750+129 = 879
2моль*879 = 1758 Дж
Определите, какое количество теплоты необходимо для нагревания 2 моль вещества от 280 до 410 К, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 28 + 0,01Т
8177
Определите, какое количество теплоты необходимо для нагревания 1 моль вещества от минус 23 до плюс 67 оС, если известно уравнение зависимости теплоемкости данного вещества от температуры, справедливое в рассматриваемом температурном интервале:
СР = 25 + 0,02Т
Ответ укажите в Дж.
2781
для некоторого вещества известна зависимость молярной теплоемкости Ср от температуры:
Ср = 18 + 4,4·10‾3T.
Некоторое количество этого вещества нагревали от 290 K до 411 K.
Эксперимент показал, что для нагревания необходимо 15262 Дж тепла.
Сколько моль вещества было взято для нагревания?
Интегрируем Ср от 290 до 411 = (18*(411-290)+(…….так далее м= 2364,6062
Кол.теплоты / получ.число = 6,454352моль
Для некоторого вещества известна молярная теплоемкость Ср:
Ср = 23,6,Дж/мольК
9,8 моль этого вещества нагревали от 304 K до некоторой конечной температуры.
На нагревание потратили 16215 Дж тепла.
Какова конечная температура вещества?
23,6 * (Т2-304)*9,8моль = 16215 Т2 = 374,109824К
Для некоторого вещества известна молярная теплоемкость Ср:
Ср = 35,2,Дж/мольК
7,4 моль этого вещества нагревали от 471 K до некоторой конечной температуры.
На нагревание потратили 20780 Дж тепла.
Какова конечная температура вещества?
550,776
Вычислите при температуре 350 К изменение энтропии DS реакции
2А + В = 3С + 4D,
если известны следующие данные:
| Вещество | А | В | С | D |
| So298, Дж/(мольК) | 25 | 22 | 16 | 10 |
| Срo298, Дж/(мольК) | 24 | 14 | 22 | 10 |
дельта Эс 298 = (48+40) – (50+22) = 16 Дж/мольК
дельтаСр = (40+66)-(48+14)=44Дж/мольК
16+ln(350/298)*44 = 23,01 Дж
Вычислите при температуре 400 К изменение энтропии DS реакции
2А + 1/2В = С + D,
если известны следующие данные:
| Вещество | А | В | С | D |
| So298, Дж/(мольК) | 45 | 22 | 11 | 8 |
| Срo298, Дж/(мольК) | 23 | 14 | 44 | 25 |
дельта Эс = -82 дельта Ср = 16 -82+ln(400/298)*16 = -77,290063Дж
Вычислите (при 298 К) ΔG реакции
2А + 1/2В = С + D,
(при 298 К) для которой известны следующие данные:
| Вещество | А | В | С | D |
| ΔfHo298, кДж/моль | 2 | 22 | 0 | 40 |
| So298, Дж/(мольК) | 11 | 10 | 12 | 30 |
Ответ введите в Дж.
20530 
Вычислите (при 298 К) ΔG реакции
2А + В = 2С + D,
(при 298 К) для которой известны следующие данные:
| Вещество | А | В | С | D |
| ΔfHo298, кДж/моль | 5 | 11 | 15 | 8 |
| So298, Дж/(мольК) | 12 | 5 | 60 | 40 |
Ответ введите в Дж.
-22038
Вычислите при температуре 800 К тепловой эффект ΔrНо реакции
А = В + С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = –8,0 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 4 | –1,2 | 3,6 |
| b | 0,001 | 0,002 | –0,005 |
Ответ введите в джоулях (Дж).
Ответ: -9900
Вычислите при температуре 800 К тепловой эффект ΔrНо реакции
А + В = С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = –8,0 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 4 | –1,2 | 3,6 |
| b | 0,001 | 0,002 | –0,005 |
Ответ введите в джоулях (Дж).
Введите только число, без указания размерности.
Если ответ отрицательный, поставьте перед числом знак «минус», без пробелов
-9800
Вычислите при температуре 500 К тепловой эффект ΔrНо реакции
А + В = С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = 14 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 4 | 3 | 4 |
| b | 0,004 | –0,003 | –0,009 |
Ответ введите в джоулях (Дж).
12600
Вычислите при температуре 600 К тепловой эффект ΔrНо реакции
А + В = С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = –12 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 2 | 3 | 4 |
| b | 0,001 | –0,002 | –0,007 |
Ответ введите в джоулях (Дж).
Введите только число, без указания размерности.
Если ответ отрицательный, поставьте перед числом знак «минус», без пробелов
Как всегда интегрируем каждый компоент отдельно (-1110) + (-12000Дж)= = -13110 Дж
Вычислите при температуре 600 К тепловой эффект ΔrНо реакции
А = В + С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = –8,0 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 3,2 | –1,5 | 2 |
| b | 0,004 | 0,001 | –0,006 |
Ответ введите в джоулях (Дж).
-10025
Вычислите при температуре 400 К тепловой эффект ΔrНо реакции
А = В + С,
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = –2,0 кДж;
- коэффициенты зависимости теплоемкости участников реакции от температуры СР = а + bТ приведены в таблице.
| Вещество | А | В | С |
| a | 3,2 | 1 | 2 |
| b | 0,003 | 0,0012 | 0,008 |
Ответ введите в джоулях (Дж).
-1803
Вычислите при температуре 418,6 тепловой эффект ΔrНо реакции
4A + B = 3C
если известны следующие данные:
- тепловой эффект данной реакции при 300 К равен ΔrНо300 = 1,8 Дж
- молярные теплоемкости участников реакции приведены в таблице.
| вещество | А | В | С |
| Ср, Дж/мольК | 25,5 | 17,1 | 20,5 |
Ответ введите в джоулях (Дж).
Ср для реакции для температуры от 300 до 418, 6 К: (61,5-(102+17,1))*(418,6-300)= - 6831,36
- 6831,36 + 1,8 = -6829,56 или -6830
При температуре минус 8 оС константа равновесия КР некоторой реакции равна 54.
При температуре 18 оС константа равновесия этой реакции равна 166
Определите тепловой эффект реакции.
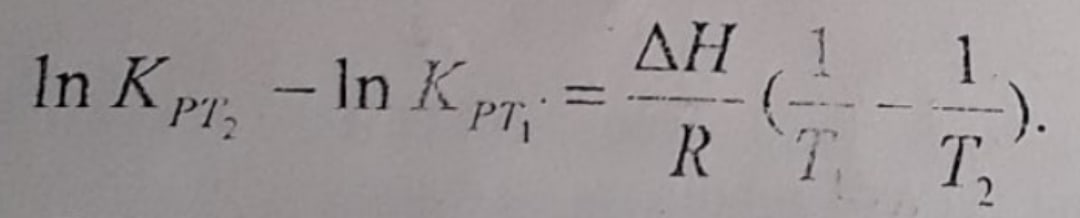
При температуре минус 5 оС константа равновесия КР некоторой реакции равна 6.
Тепловой эффект реакции равен минус 61,177 кДж
При какой температуре константа равновесия этой реакции будет равна 1,4?
283
При кристаллизации вещества его энтропия снизилась на 6,5 Дж/(мольК). Известна теплота кристаллизации данного вещества - минус 650 Дж/моль.
Какова температура замерзания этого вещества?
650 /6,5 = 100 К дельтаН=27692Дж
Температура кристаллизации некоторого вещества "А" при стандартном давлении составляет 785 К.
Известна теплота плавления вещества "А":
ΔНпл (А) = 62250 Дж/моль.
Если расплав вещества "А" содержит небольшую примесь вещества "В", то температура начала кристаллизации расплава снижается на 15,4 градусов. Вещества "А" и "В" не образуют твердых растворов.
Определите мольную долю вещества "А"в таком расплаве.
Универсальную газовую постоянную принять равной 8,314 Дж/мольК.
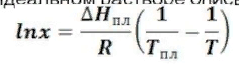 , Где Т = 785-15,4 е в степени = 0,8262
, Где Т = 785-15,4 е в степени = 0,8262
Температура кристаллизации некоторого вещества "А" при стандартном давлении составляет 437 К.
Известна теплота плавления вещества "А":
ΔНпл (А) = 19918 Дж/моль.
Если расплав вещества "А" содержит небольшую примесь вещества "В", то температура начала кристаллизации расплава снижается на 13,7 градусов. Вещества "А" и "В" не образуют твердых растворов.
Определите мольную долю вещества "А"в таком расплаве.
Универсальную газовую постоянную принять равной 8,314 Дж/мольК.
е в степени (-0,177429803)=0,837419782
При кристаллизации 8,1 моль вещества его энтропия снизилась на 5,8 Дж/(мольК). Известно, что температура замерзания этого вещества равна (-23) оС = 250 К
Какова теплота плавления данного вещества? (Дж/моль)
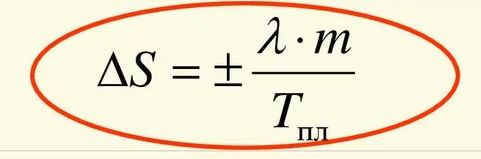 (5,8*250)/8,1моль=179,012346
(5,8*250)/8,1моль=179,012346
Определить разность между ΔН и ΔU при температуре 33 оС для приведенной ниже реакции.
ΔН – ΔU = …….. Дж
Универсальную газовую постоянную R принять равной 8,3 Дж/(мольК).
Ответ привести в Дж. Ввести только число, размерность не указывать.
Целую часть числа отделите от дробной при помощи запятой.
Если ответ отрицательный, перед числом поставьте знак «минус» без пробелов
NH4Cl(жидк) + NaOH = NaCl + NH3(газ) + H2O(жидк)
1 моль газа * (273+33)*8,3 = 2539,8
Определить разность между ΔН и ΔU при температуре 33 оС для приведенной ниже реакции.
ΔН – ΔU = …….. Дж
Универсальную газовую постоянную R принять равной 8,3 Дж/(мольК).
Ответ привести в Дж. Ввести только число, размерность не указывать.
Целую часть числа отделите от дробной при помощи запятой.
Если ответ отрицательный, перед числом поставьте знак «минус» без пробелов
NH4Cl + NaOH = NaCl + NH3(газ) + H2O(газ)
2 моль газа * (273+33)*8,3 = 5079,6
Над одноатомным идеальным газом сторонние силы совершают работу, величина которой 2000 Дж, при этом внутренняя энергия газа уменьшилась на 0,5кДж. Какое из нижеприведённых утверждений справедливо?
От системы отведено 2500 Дж теплоты. (2000Дж+500Дж)
Одноатомный идеальным газ совершает работу 2000 Дж, при этом внутренняя энергия газа уменьшилась на 0,5кДж. Какое из нижеприведённых утверждений справедливо?
К системе подведено 1500 Дж теплоты. (2000Дж-500Дж)
Для некоторой реакции при температуре t = 25оС известны
Изменение энтропии ΔrSо = 137 Дж
Тепловой эффект ΔrНо = 36,83 кДж
Определите константу равновесия КР данной реакции.
Универсальную газовую постоянную принять равной 8,314 Дж/мольК
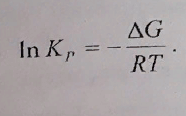 Сначала находим дельта Жэ – дельта аш – Т*дельта Эс = -3996 Дж
Сначала находим дельта Жэ – дельта аш – Т*дельта Эс = -3996 Дж
Потом по этой формуле Kp=e^(-G/(R*T)) = 5,01718678 или 5
При температуре минус 25 оС константа равновесия КР некоторой реакции равна 6.
Тепловой эффект реакции равен 25,03 кДж
При какой температуре константа равновесия этой реакции будет равна 46?
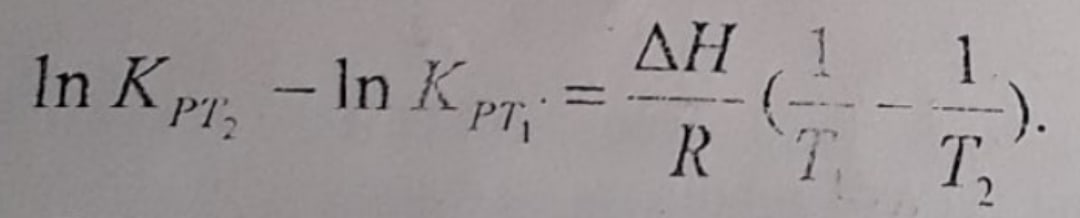
ln46 – ln6 = (25030/8,314)*((1/298)-(1/T2) Т2 = 298К
Вычислите работу расширения 1 моля идеального газа, если известно, что процесс протекает в изобарных условиях (1 атм), а объем газа изменяется с 2 до 2,2 м3.
1 атм считать равной 100 000 Па.
(2,2-2,0)*1моль*100000Па=20000 Дж
Вычислите работу расширения 1,1 моль идеального газа, если известно, что в изобарных условиях (Р = 1032 Па) его объем вырос c 7 до 13 м3.
6811
Известно, что 3 моль идеального газа в изобарных условиях совершает работу расширения 614 Дж. Начальная температура составляла 101 К. Какой стала конечная температура газа?
Универсальную газовую постоянную считать равной 8,3 Дж/(моль*К).
(614Дж/(3моль*8,3))+101К=125,7 К
Вычислите работу изотермического обратимого расширения 1,5 моль идеального газа от 2,5 до 10 м3 при температуре 650 К.
Универсальную газовую постоянную считать равной 8,3Дж/(мольК).
1,5 моль * 8,3 * 650 К* ln (10/2,5) делим на 1000 = 11,22 кДж
Вычислите работу изотермического обратимого расширения 1,5 моль идеального газа от 1 до 5 м3 при температуре 600 К.
Универсальную газовую постоянную считать равной 8,3Дж/(мольК).
Выберите из предложенных вариантов ответов тот, который наиболее близок к результату ваших вычислений (ответы приведены в кДж).
12,0Кдж
Вычислите работу изотермического обратимого расширения 2 моля идеального газа от 0,6·105 до 0,1·105 Па при температуре 273 К.
Универсальную газовую постоянную считать равной 8,3Дж/(мольК).
Выберите из предложенных вариантов ответов тот, который наиболее близок к результату ваших вычислений (ответы приведены в кДж).
2 моль * 8,3 * 273 К* ln (0,6/0,1) делим на 1000 = 8,12 кДж
Вычислите работу расширения 6,7 моль идеального газа, если известно, что в изобарных условиях (Р = 1255 Па) его объем вырос c 7 до 14 м3. (V2-V1)*p*n
(14-7)* 1255*6,7 = 58869,5 Дж
Теплота конденсации некоторой этой жидкости из паров - минус 40 КДж/моль. Теплота сгорания газа того же вещества - минус 400 КДж/моль.
Определите теплоту сгорания жидкости
Ответ введите цифрами.
Размерность (КДж/моль) не указывайте.
Сублим – Кристаллиз (Плавление) = Кипения (конденсации)
Сублим – Кристаллиз (Плавление) = Кипения (конденсации)
Сгорания газа = Сгорание жидкости – Испарение жидкости
-400- (-40)= -360 Ответ: -360
Теплота сгорания некоторой жидкости - минус 111 КДж/моль, теплота испарения этой жидкости 29 КДж/моль. Вычислите теплоту сгорания газа. -111-29=-140кДж/моль
-140,0
Для некоторого вещества известны теплоты кристаллизации (30 КДж/моль) и сублимации (минус 50 КДж/моль). Определите теплоту кипения данного вещества.
Ответ введите цифрами.
Размерность (КДж/моль)
30 – (-50) = -20
Теплота сгорания некоторой жидкости - минус 290 КДж/моль, теплота сгорания того же вещества в газообразной форме - минус 306 КДж/моль Вычислите теплоту испарения 4 моль жидкости. 4*(-290-(-306))=64кДж 64,00
Теплота сгорания некоторой жидкости - минус 300 КДж/моль, теплота конденсации этой жидкости - минус 10 КДж/моль. Вычислите теплоту сгорания газа. (КДж/моль)
-300 + (-10)= -310 кДж/моль
Используя приведенные данные рассчитайте при Т = 298К стандартную энтальпию образования СS2.
СS2 + 3О2 = СО2 + 2SО2 ΔH = –1104 кДж
С+ О2 = СО2 ΔH = –394 кДж
S+ О2 = SО2 ΔH = –297 кДж
Ответ введите в кДж.
2S+2O2=2SO2+2H3
2*Н3+ СS2 + 3О2 = СО2 + 2S2+О2+Н1
2*Н3+ Н2+СS2 + 3О2 = С+О2 + 2S2+2О2+Н1
Н = Н2+3*Н3-Н1 =116
Используя приведенные данные рассчитайте при Т = 298К стандартную энтальпию образования Се2О3
Се(т) + О2(г) = СеО2(т) ΔH = –1090 кДж
3СеО2(т) + Се(т) = 2Се2О3(т) ΔH = –332 кДж
3Се+3О2=3СеО2+3*Н1
3Се+3О2+Се(ТВ)=2Се2О3+ Н2 + 3*Н1
1 моль Се2О3 ((-1090)*3)+(-332))/2= - 1801
Используя приведенные данные рассчитайте при Т = 298К стандартную энтальпию образования CH4.
CH4 + 2O2 = СО2 + 2H2О ΔH = 889 кДж
С+ О2 = СО2 ΔH = –394 кДж
Н2 + 1/2О2 = Н2О (ж) ΔH = –285 кДж
Ответ введите в кДж.
-75
Используя приведенные данные рассчитайте при Т = 298К стандартную энтальпию образования AsCl3.
2As + 6HCl = 2AsCl3 + 3H2 ΔH = –1150 кДж
H2 + Cl2 = 2HCl ΔH = 184 кДж
Ответ введите в кДж.
-299
На какую величину изменится энтропия 3 моль вещества при его плавлении, если известно, что температура замерзания вещества – минус 23 оС, а теплота плавления + 300 Дж/(мольК)?
250 К = -23 С Дельта Эс = (3моль*300)/250К = 3,6 Дж
На какую величину изменится энтропия при нагревании 1,7 моль вещества от минус 25 оС до +18 оС?
Известна зависимость теплоемкости вещества от температуры на данном температурном интервале:
Ср = 26 + 0,028Т.
9,1
Вычислите работу расширения 6 моль идеального газа, если известно, что в изобарных условиях (Р = 2*105 Па) его объем вырос c 0,2 до 0,6 м3. Размерность (кДж) не указывайте.
(V2-V1)*p*n = (0,6-0,2)*2*(10^5)*6=480000Дж=480кДж
Некоторое количество идеального газа нагревают в изобарных условиях с 298 до 459 К. При этом газ совершает работу расширения, равную 681 Дж.
Сколько моль газа участвует в процессе?
Универсальную газовую постоянную считать равной 8,3 Дж/(моль*К).
Если ответ необходимо округлить, оставляйте не менее 4 значащих цифр.
681 Дж/(8,3*(459-298) = 0,509616104
Известно, что некоторое количество идеального газа при расширении в изобарных условиях (Р = 1,2*105 Па) увеличилось в объеме c 0,1 до 0,9 м3. При этом была совершена работа, равная 192 кДж.
Сколько моль газа участвовало в опыте?
192000Дж/(((0,9-0,8)*1,2*10в пятой степени) = 2 моль
Известно, что некоторое количество идеального газа при расширении в изобарных условиях (Р = 12564 Па) увеличилось в объеме c 2 до 8 м3.
При этом была совершена работа, равная 33360 Дж.
Сколько моль газа участвовало в опыте?
0,442534 моль
1 моль идеального газа обратимо изотермически расширяется от 1 до 25 м3. При этом газ совершает работу 8200 Дж.
Определите температуру, при которой происходит процесс.
Универсальную газовую постоянную считать равной 8,3Дж/(мольК).
Выберите из предложенных вариантов ответов тот, который наиболее близок к результату ваших вычислений (ответы приведены в К).
8200 = 1моль*8,3 *дельта Т * ln(25/1) Т=306,924К ил 307К
1 моль идеального газа обратимо изотермически расширяется от 5 до 15 м3. При этом газ совершает работу 6500 Дж.
Определите температуру, при которой происходит процесс.
Универсальную газовую постоянную считать равной 8,3Дж/(мольК).
713К
Для проведения газофазной реакции
А + В = С
было взято 5 моль вещества А и 5 моль вещества В.
Продукт реакции С в начальный момент отсутствовал.
Когда система пришла в состояние равновесия, образовалось 2 моль вещества С.
Какова будет мольная доля вещества С в системе в момент равновесия?
2/(10-2)=0,25
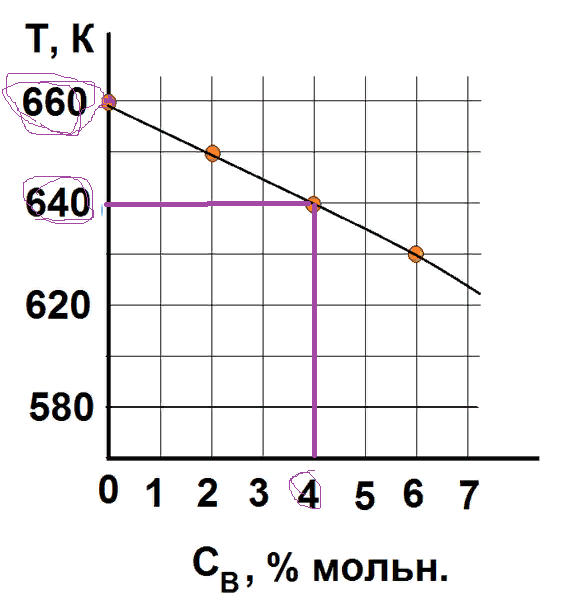
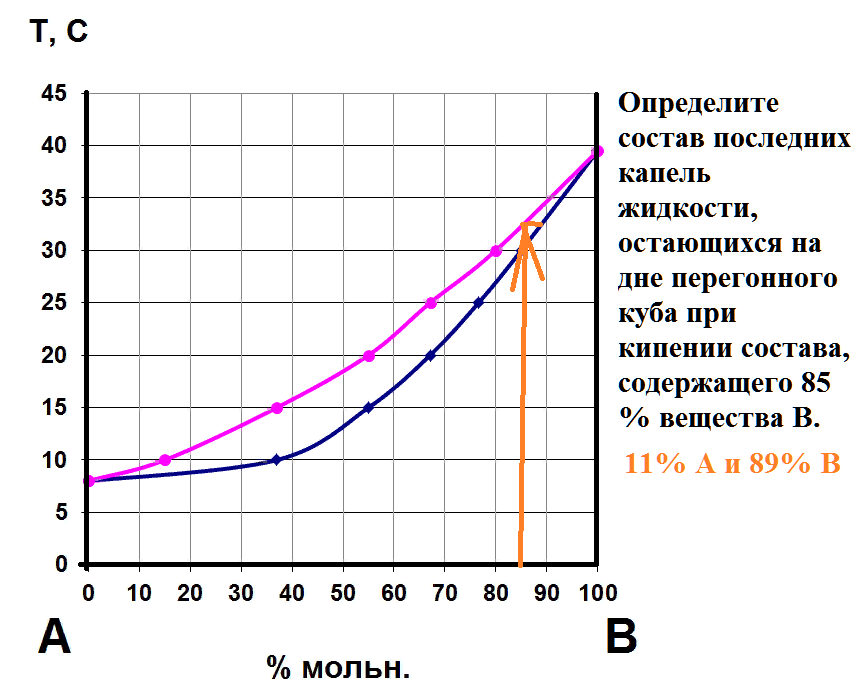
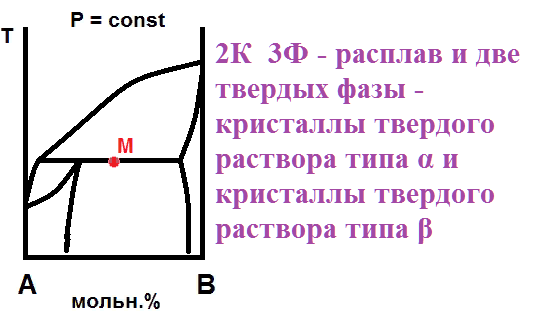
На рисунке приведен фрагмент диаграммы плавкости некоторой двухкомпонентной системы, состоящей из веществ А и В.
Используя уравнение Шредера, определите теплоту плавления (кДж) компонента А.
Универсальную газовую постоянную считать равной 8,314 Дж/мольК.
9 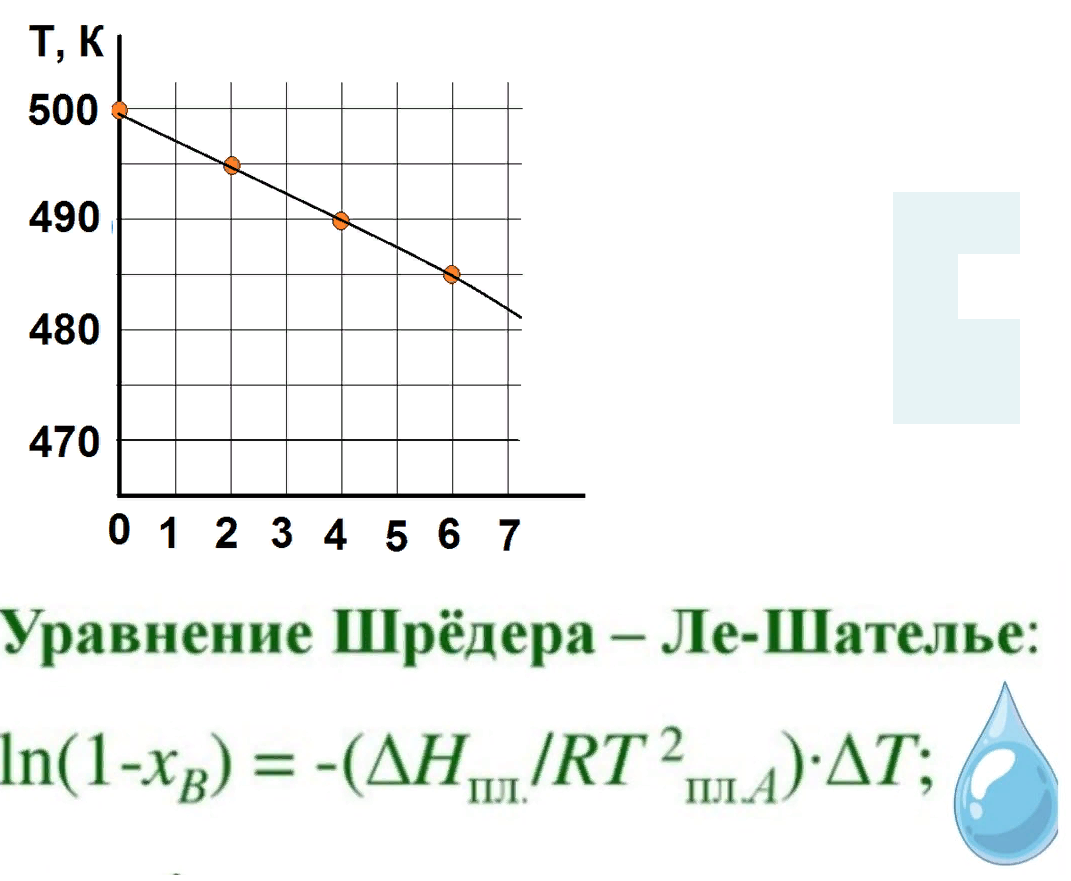
дт(1-0,04)=-(дельтаН/8,314*(500^2))* (500-490)
дельта Н = 8484,9Дж= 8,3кДж
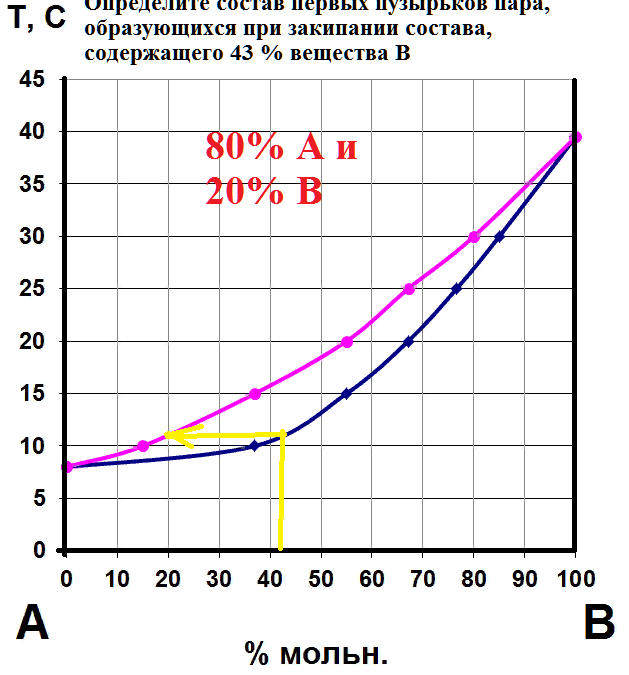
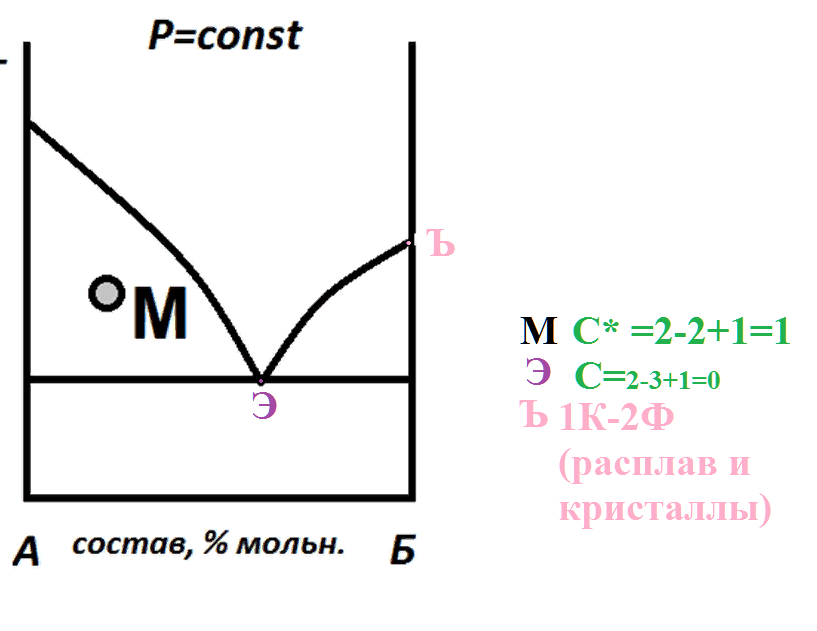
На рисунке приведен фрагмент диаграммы плавкости некоторой двухкомпонентной системы, состоящей из веществ А и В.
Используя уравнение Шредера, определите теплоту плавления (кДж) компонента А.
Универсальную газовую постоянную считать равной 8,314 Дж/мольК.
Выберите ответ, наиболее близкий к результату ваших вычислений.
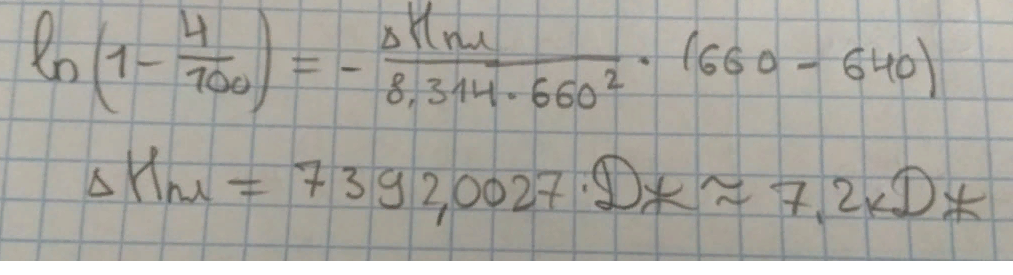
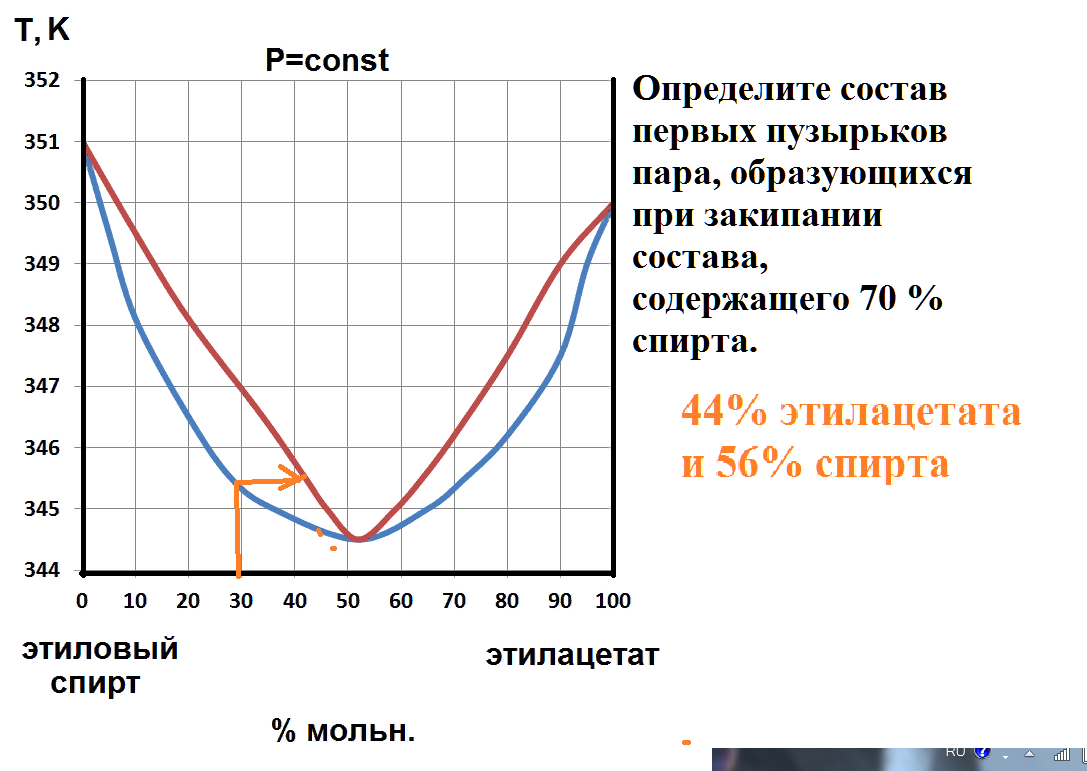
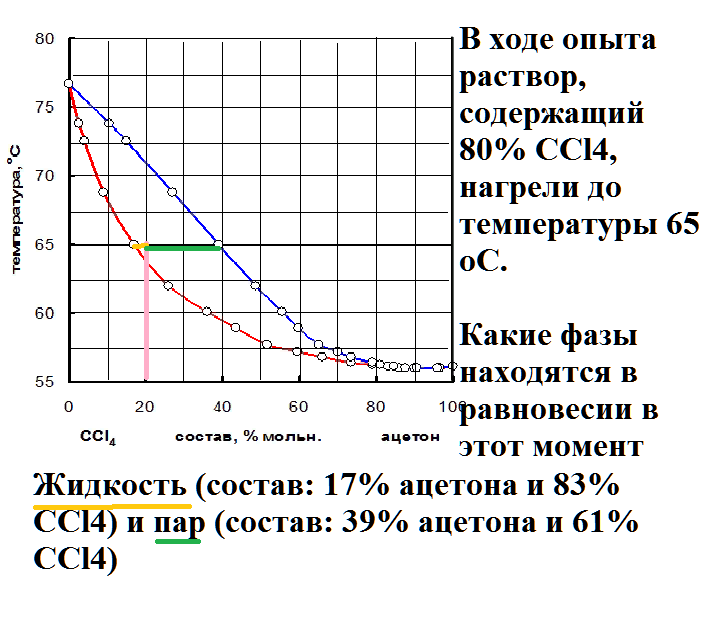
В ходе опыта раствор, содержащий 80% ССl4, нагрели до температуры 65 оС.
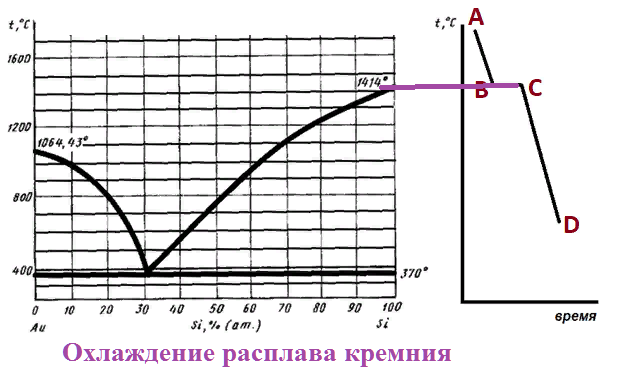
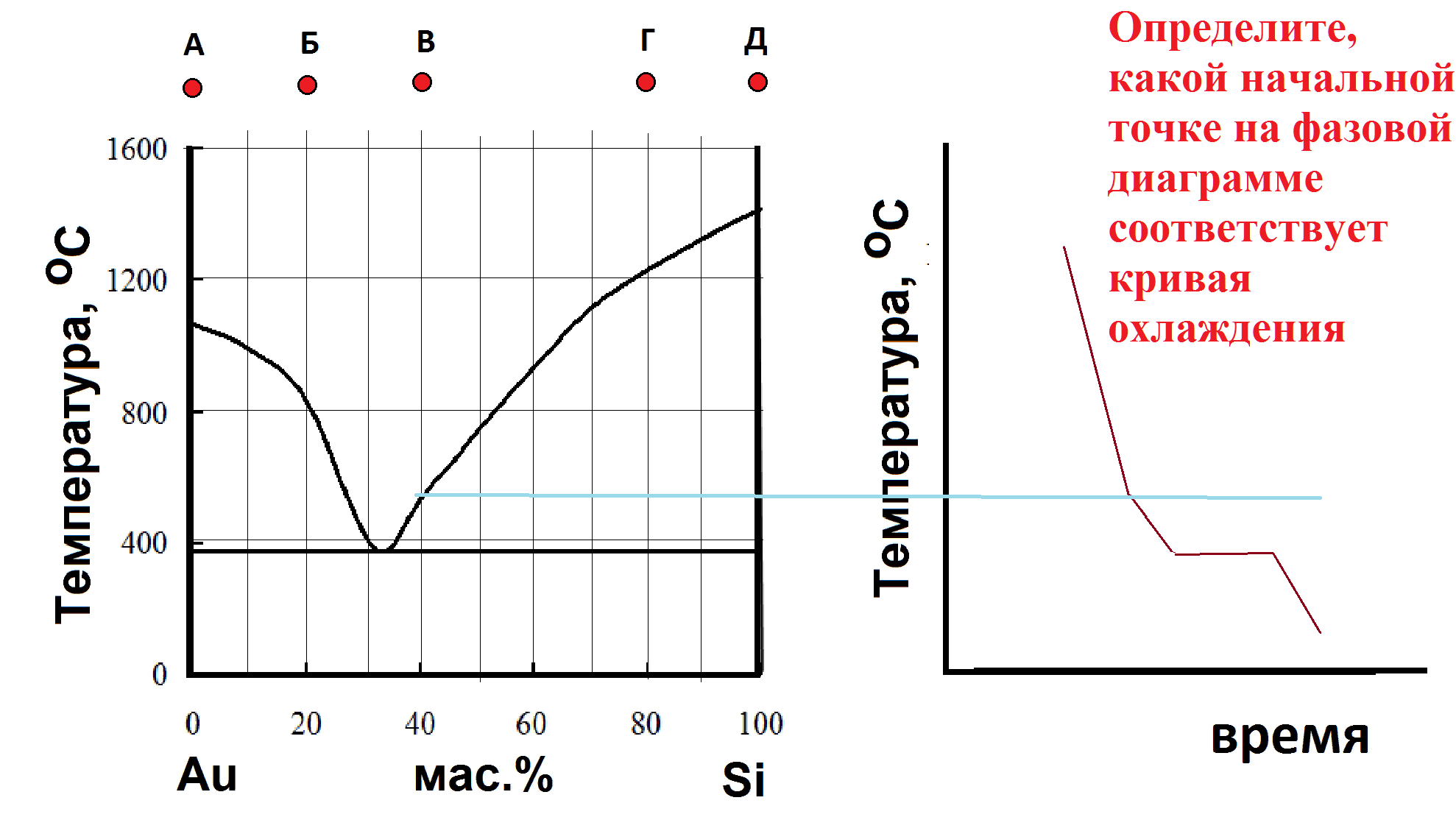
Какому процессу соответствует участок АВ кривой охлаждения?
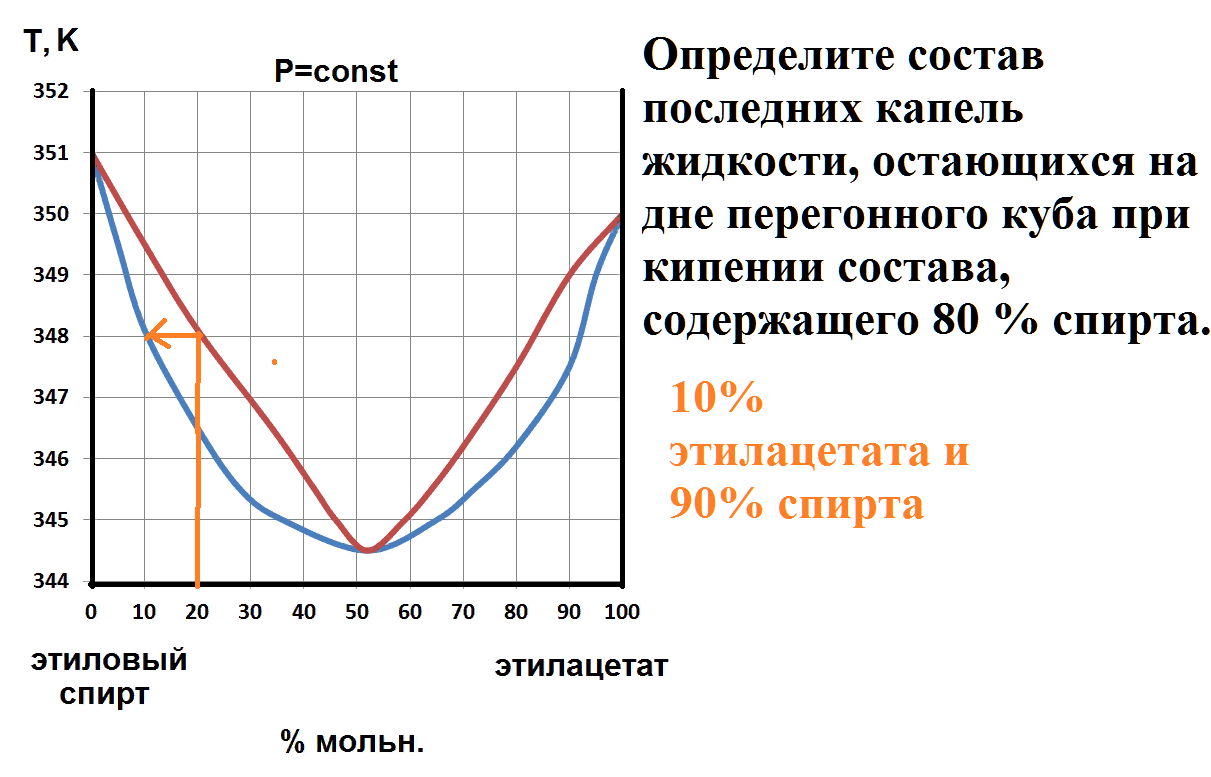
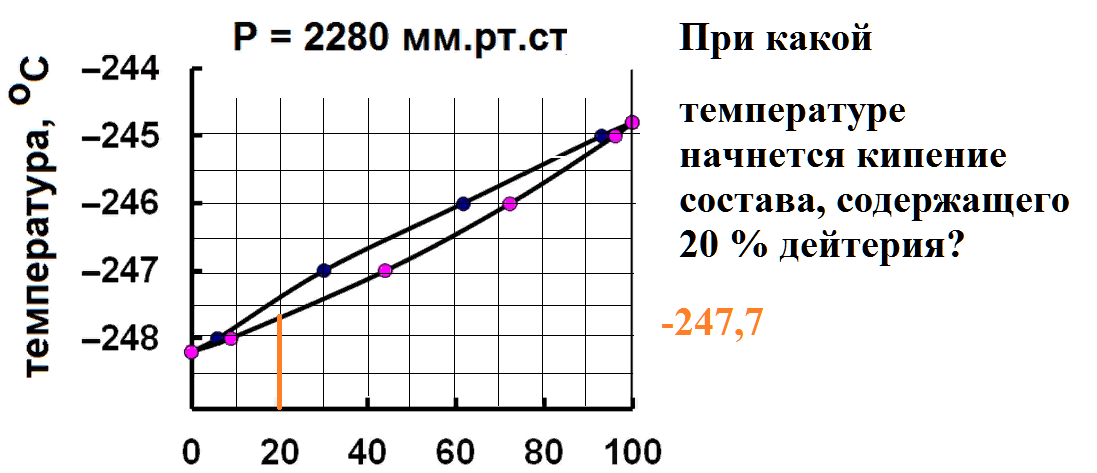
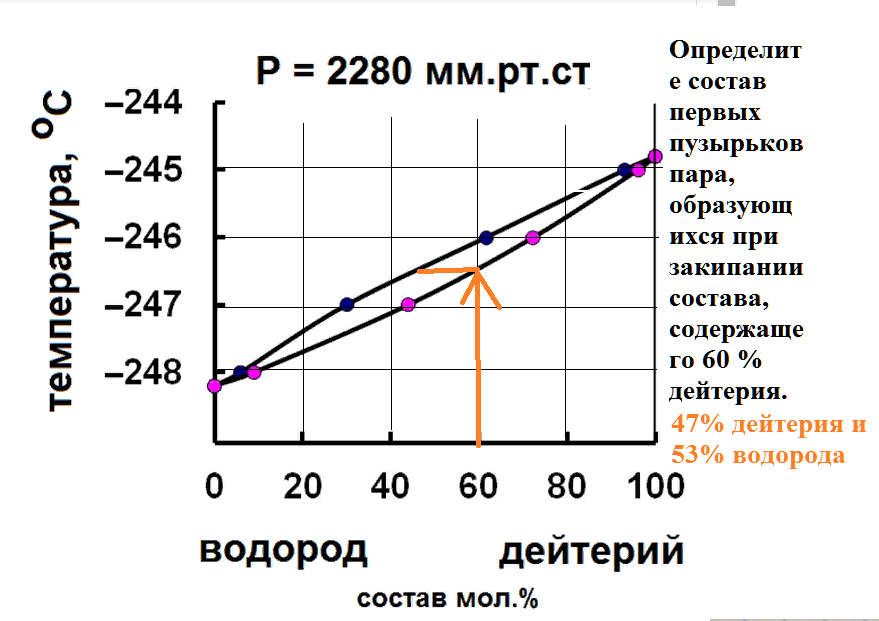
Определите состав последних капель жидкости, остающихся на дне перегонного куба при кипении состава, содержащего 60 % дейтерия.
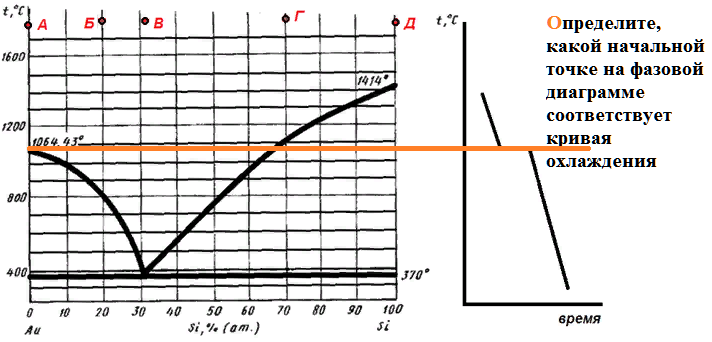
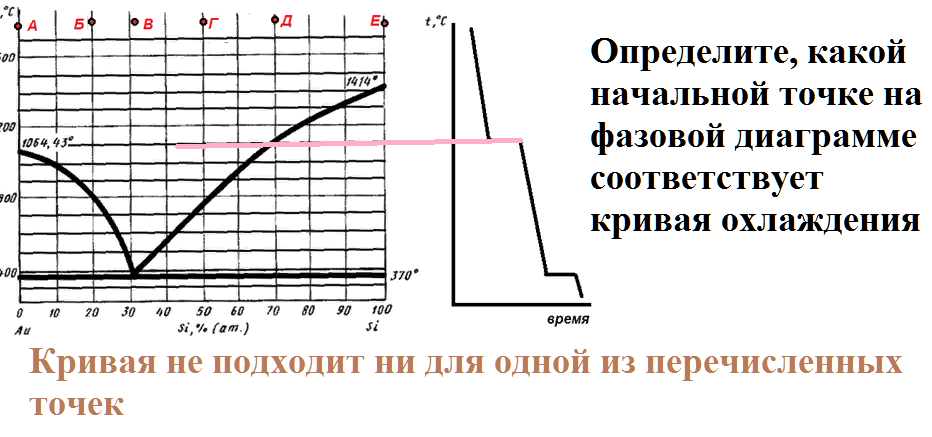
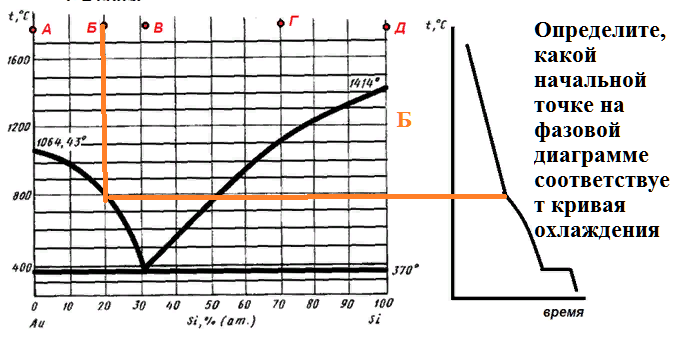
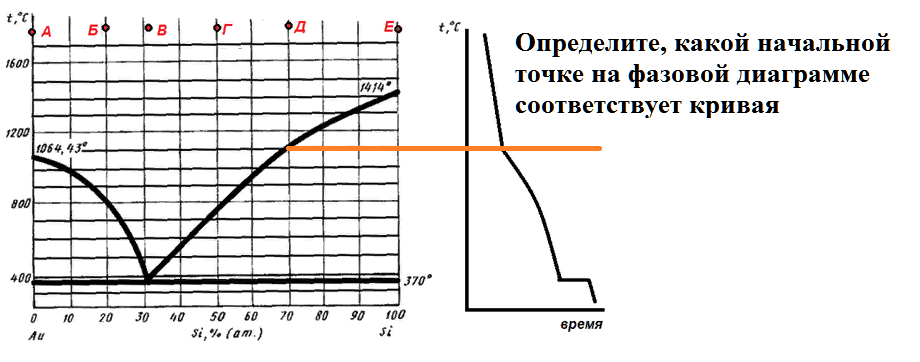
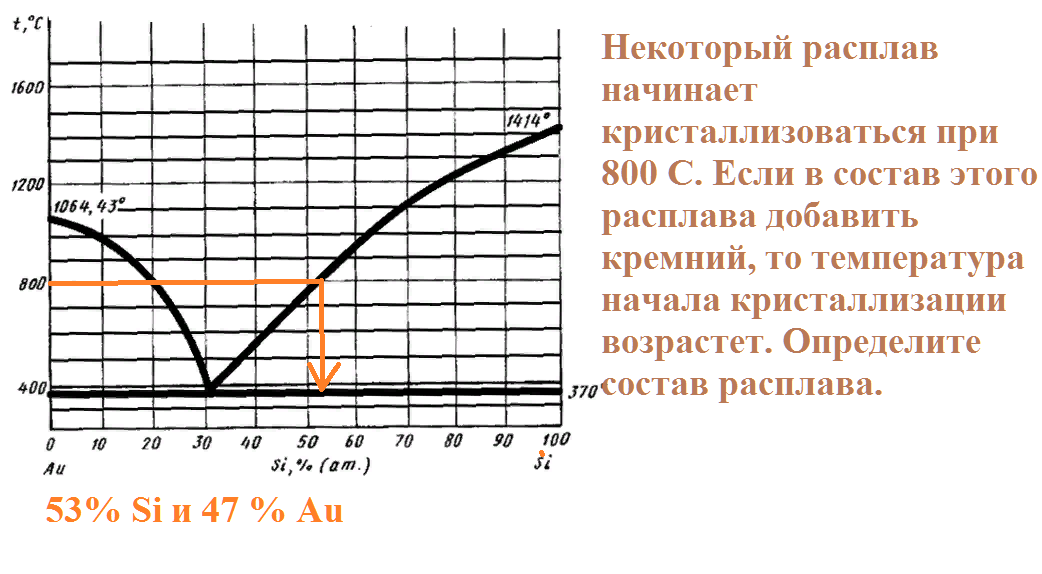
Некоторый расплав начинает кристаллизоваться при 800 С. Если в состав этого расплава добавить кремний, то температура начала кристаллизации возрастет. Определите состав расплава.
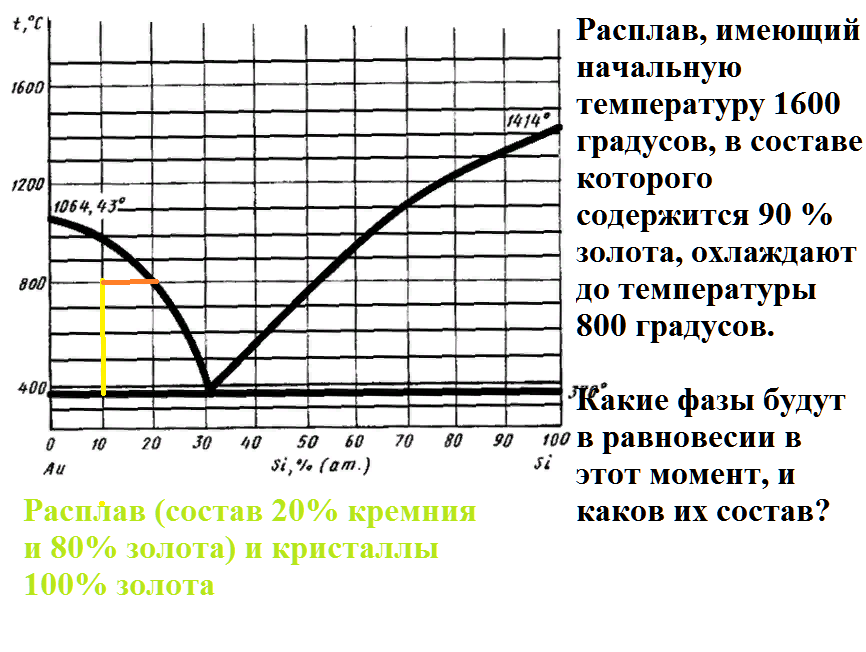
На рисунке приведена диаграмма плавкости системы кремний-золото.
Расплав, имеющий начальную температуру 1600 градусов, в составе которого содержится 90 % золота, охлаждают до температуры 800 градусов.
Какие фазы будут в равновесии в этот момент, и каков их состав?
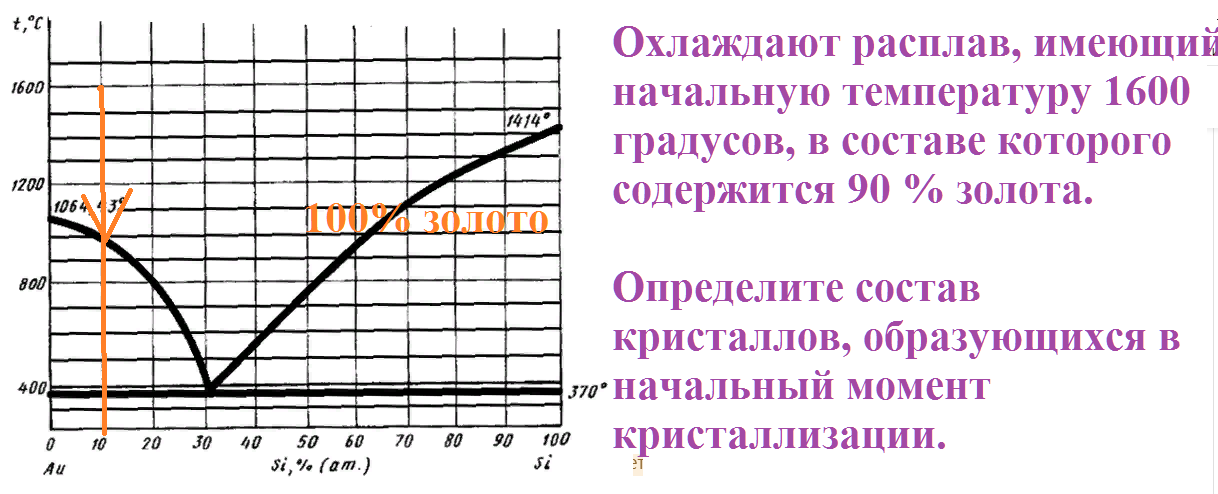
На рисунке приведена диаграмма плавкости системы кремний-золото.
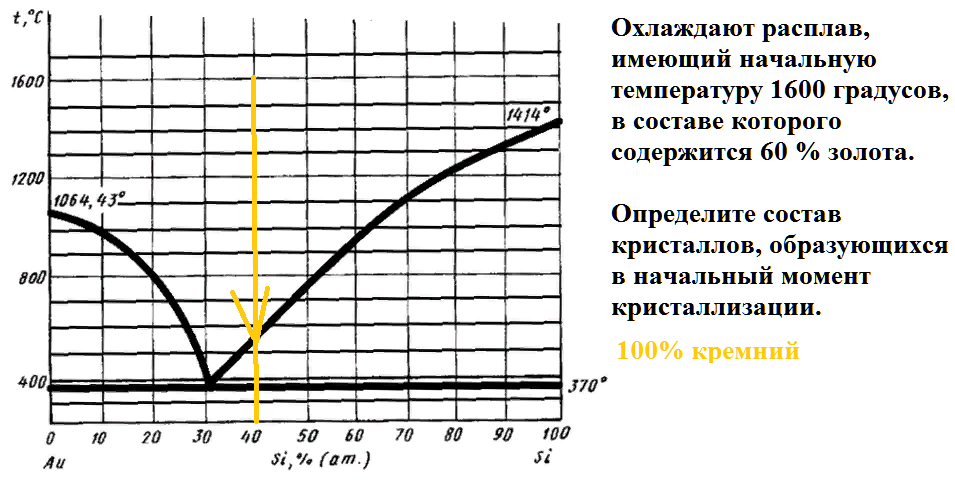
Охлаждают расплав, имеющий начальную температуру 1600 градусов, в составе которого содержится 90 % золота.
Определите состав кристаллов, образующихся в начальный момент кристаллизации.
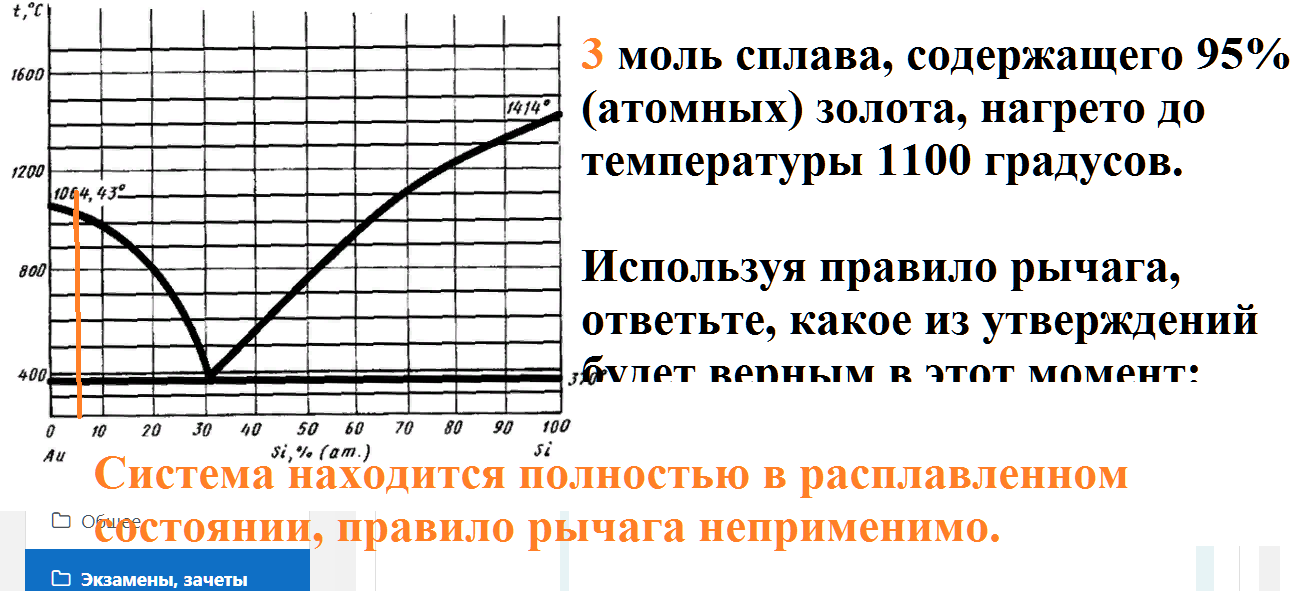
3 моль сплава, содержащего 95% (атомных) золота, нагрето до температуры 1100 градусов.
Используя правило рычага, ответьте, какое из утверждений будет верным в этот момент:
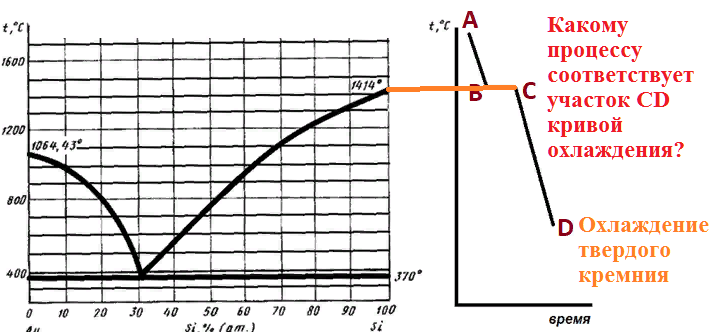
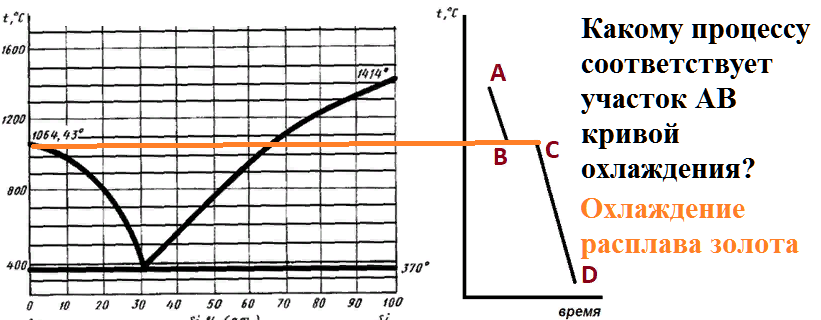
Какому процессу соответствует участок AB кривой охлаждения?
6 моль сплава, содержащего 80% (атомных) кремния, нагрето до температуры 1100 градусов 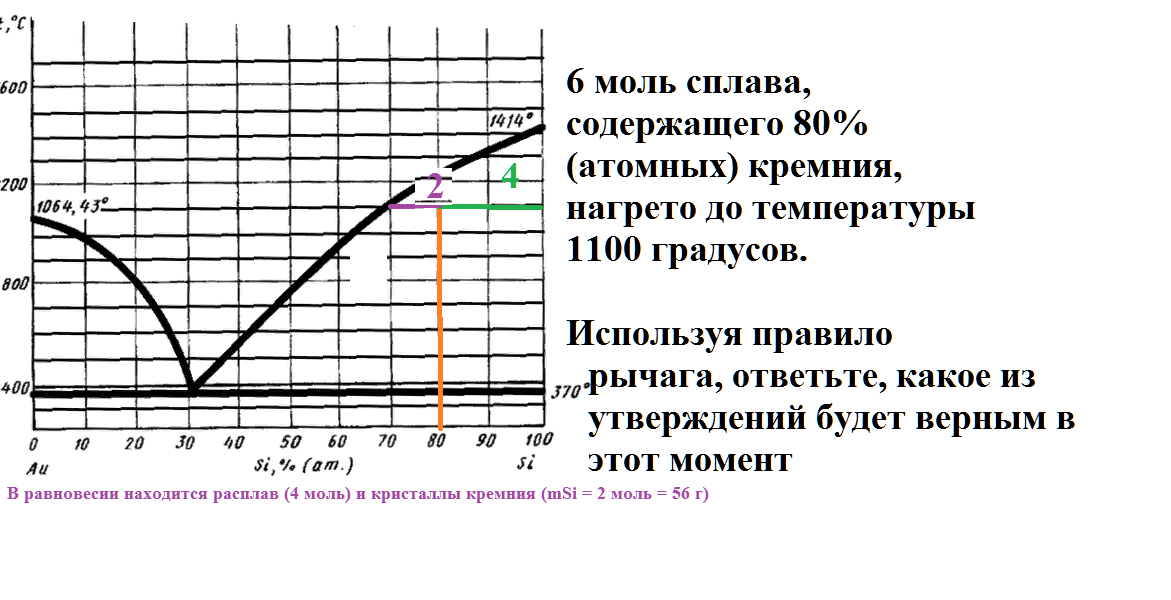
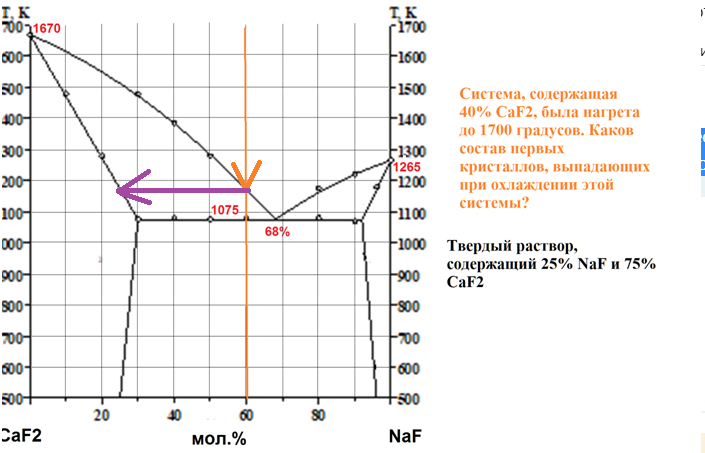
На рисунке приведена диаграмма плавкости системы NaF-CaF2.
Система, содержащая 40% CaF2, была нагрета до 1700 градусов. Каков состав первых кристаллов, выпадающих при охлаждении этой системы?
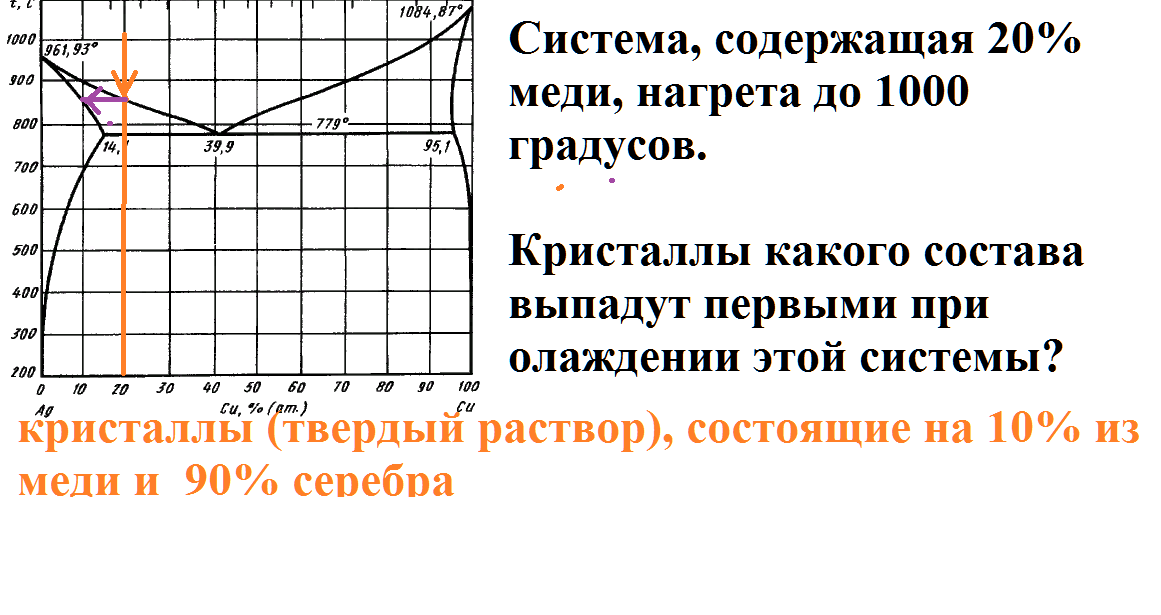
Система, содержащая 20% меди, нагрета до 1000 градусов.
Кристаллы какого состава выпадут первыми при олаждении этой системы?
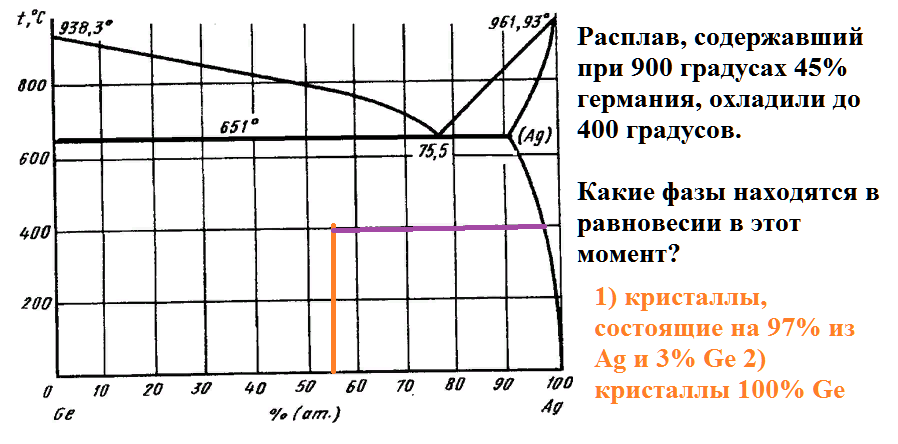
Расплав, содержавший при 900 градусах 45% германия, охладили до 400 градусов.
Какие фазы находятся в равновесии в этот момент?
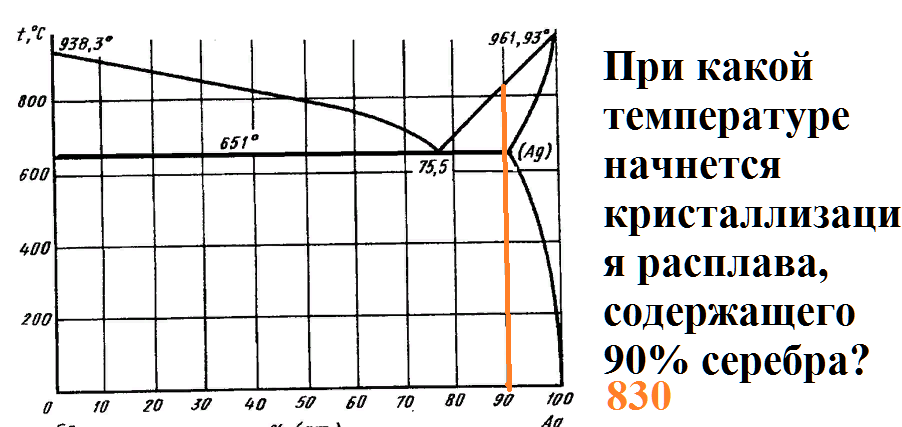
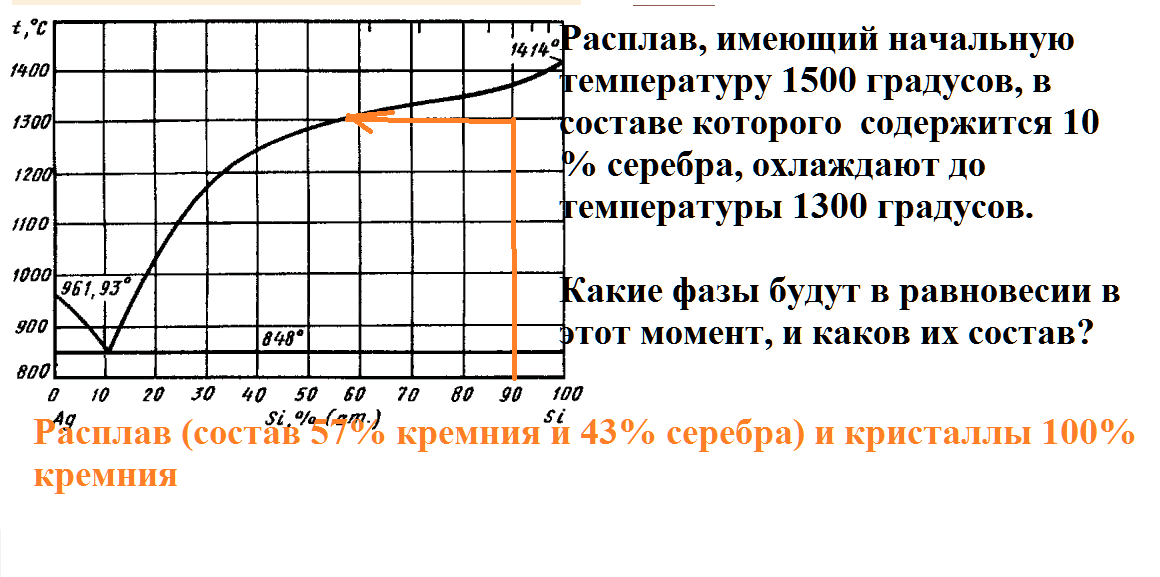
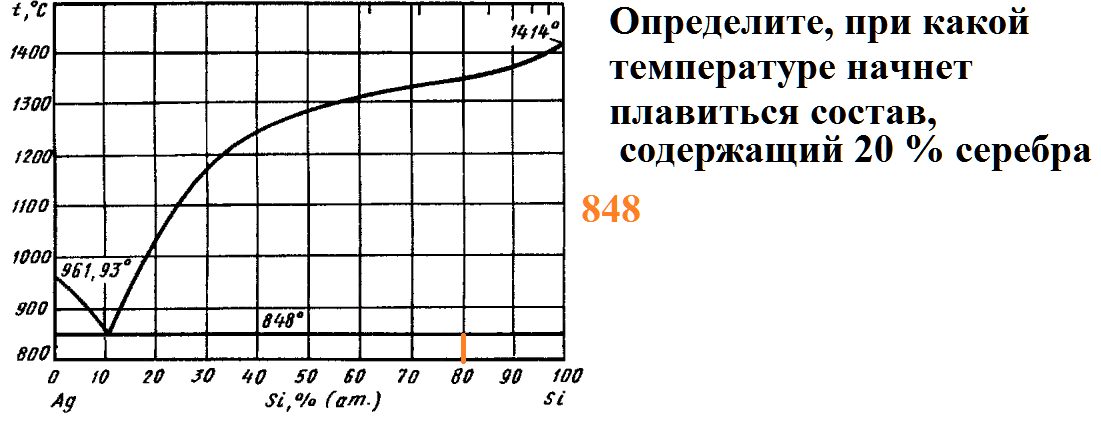
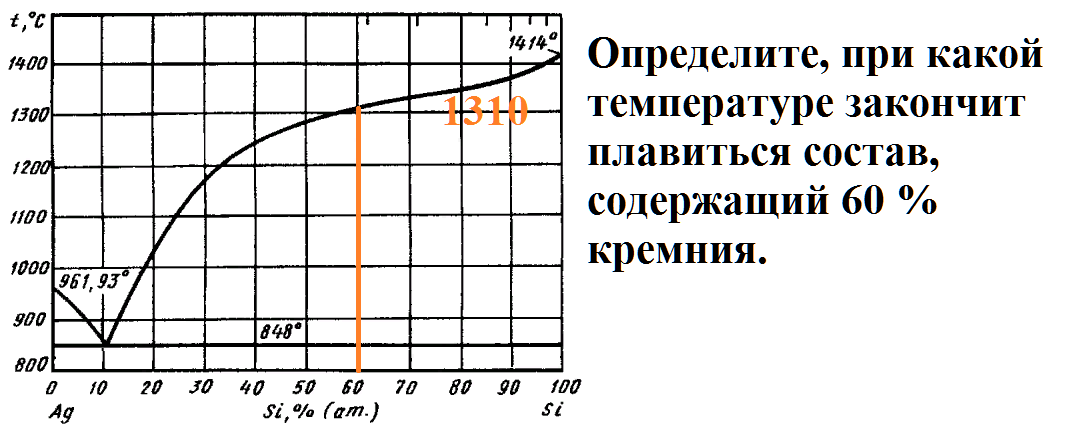
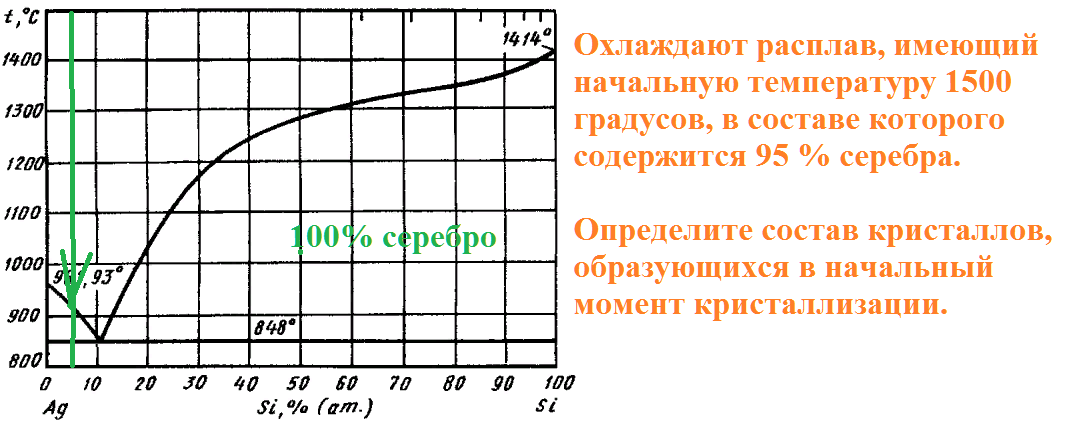
На рисунке приведена диаграмма плавкости системы кремний-серебро.
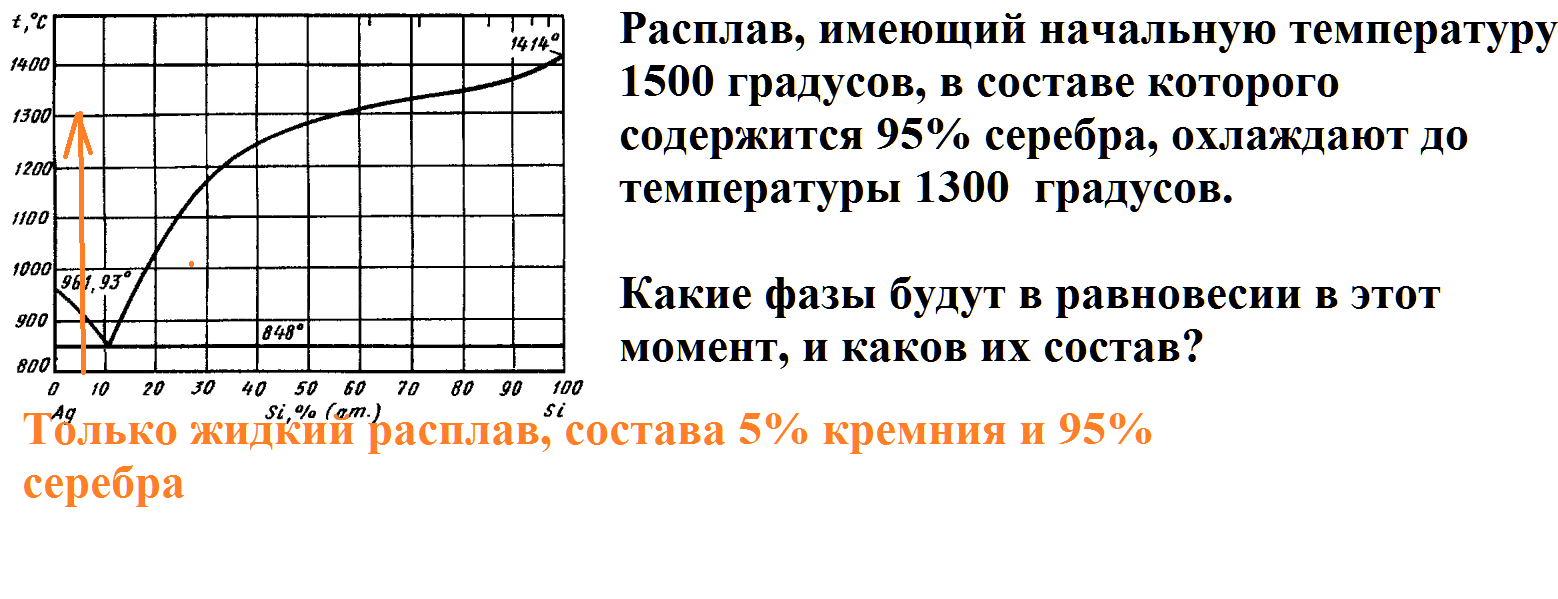
Расплав, имеющий начальную температуру 1500 градусов, в составе которого содержится 95% серебра, охлаждают до температуры 1300 градусов.
Какие фазы будут в равновесии в этот момент, и каков их состав?
Некоторый расплав начинает кристаллизоваться при 250 С.
Известно, что если к составу расплава добавить (NaNO2)2, то температура начала кристаллизации возрастет. Определите состав расплава.
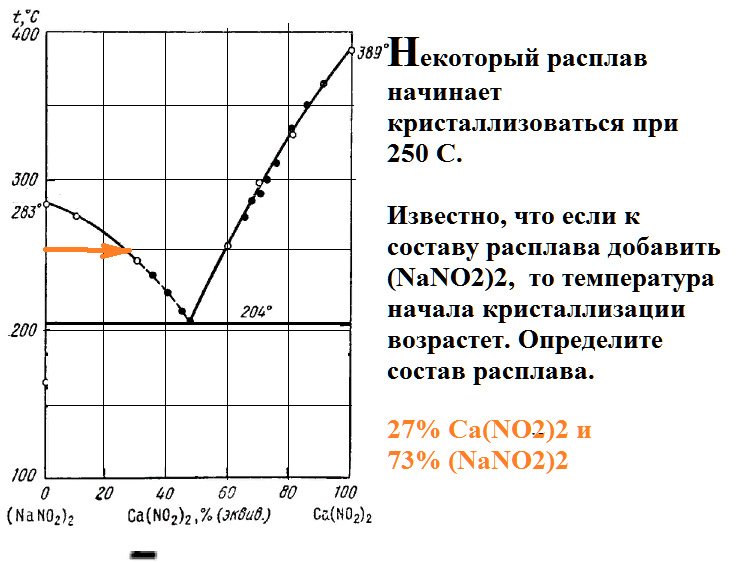
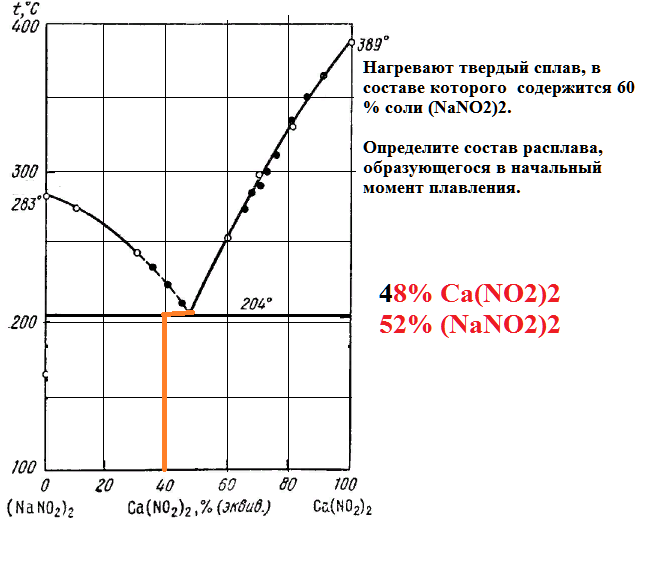
Нагревают твердый сплав, в составе которого содержится 60 % соли (NaNO2)2.
Определите состав расплава, образующегося в начальный момент плавления.
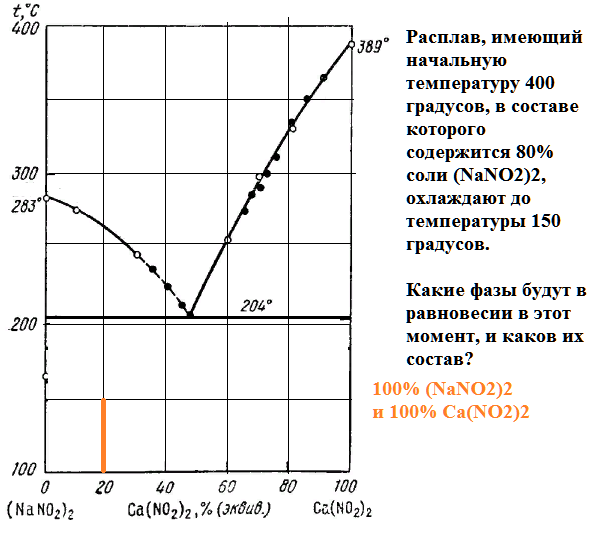
Расплав, имеющий начальную температуру 400 градусов, в составе которого содержится 80% соли (NaNO2)2, охлаждают до температуры 150 градусов.
Какие фазы будут в равновесии в этот момент, и каков их состав?
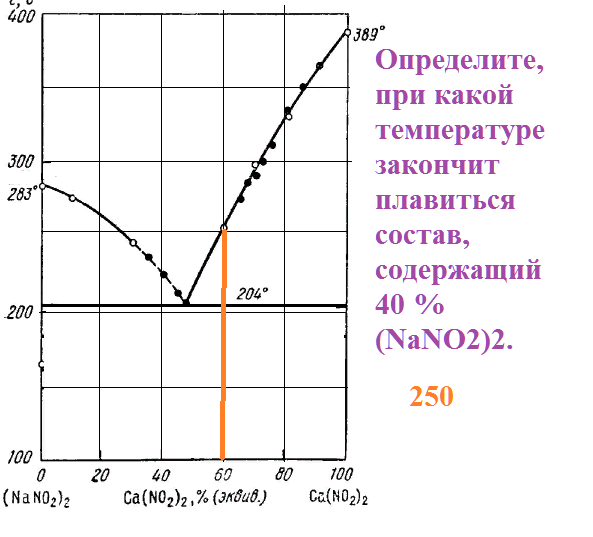
Определите, при какой температуре закончит плавиться состав, содержащий 40 % (NaNO2)2.
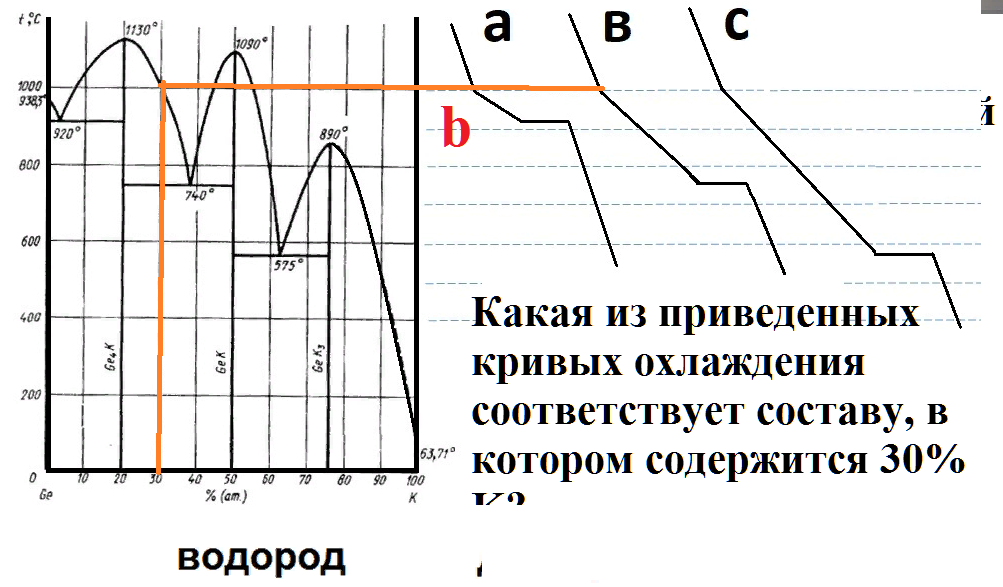
На рисунке приведена диаграмма плавкости системы калий-германий.
Расплав, содержавший при 1200 оС 30% К, охладили до 400 градусов.
Какие фазы находятся в равновесии в этот момент?

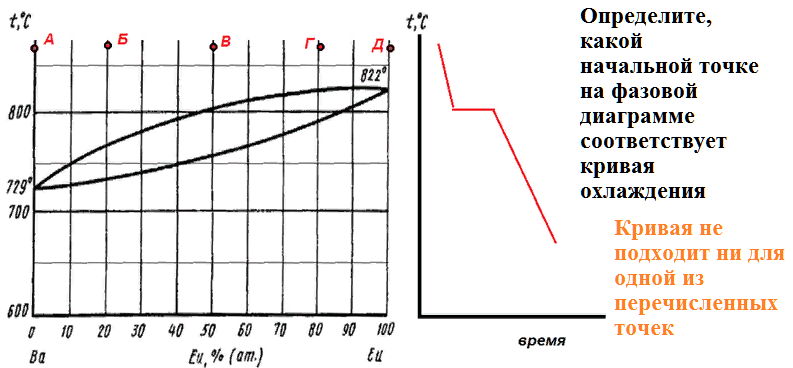
Какая из приведенных кривых охлаждения соответствует составу, в котором содержится 30% K?
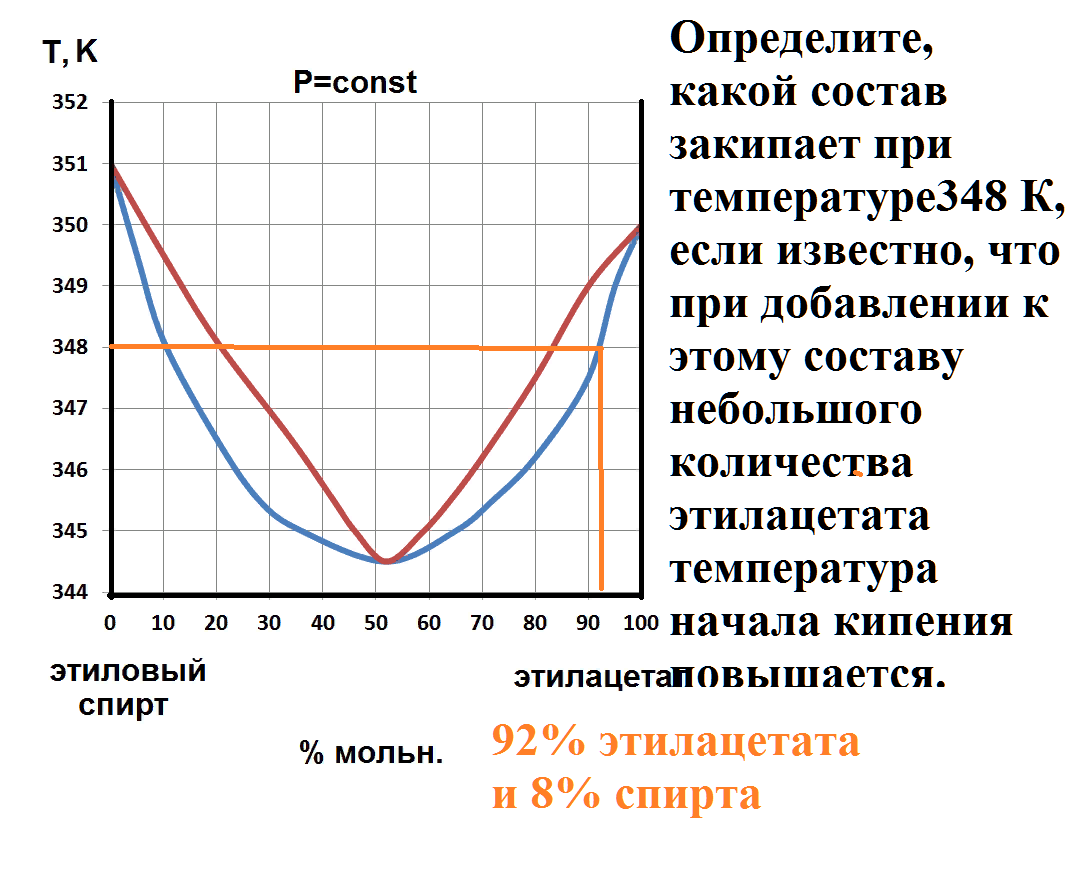
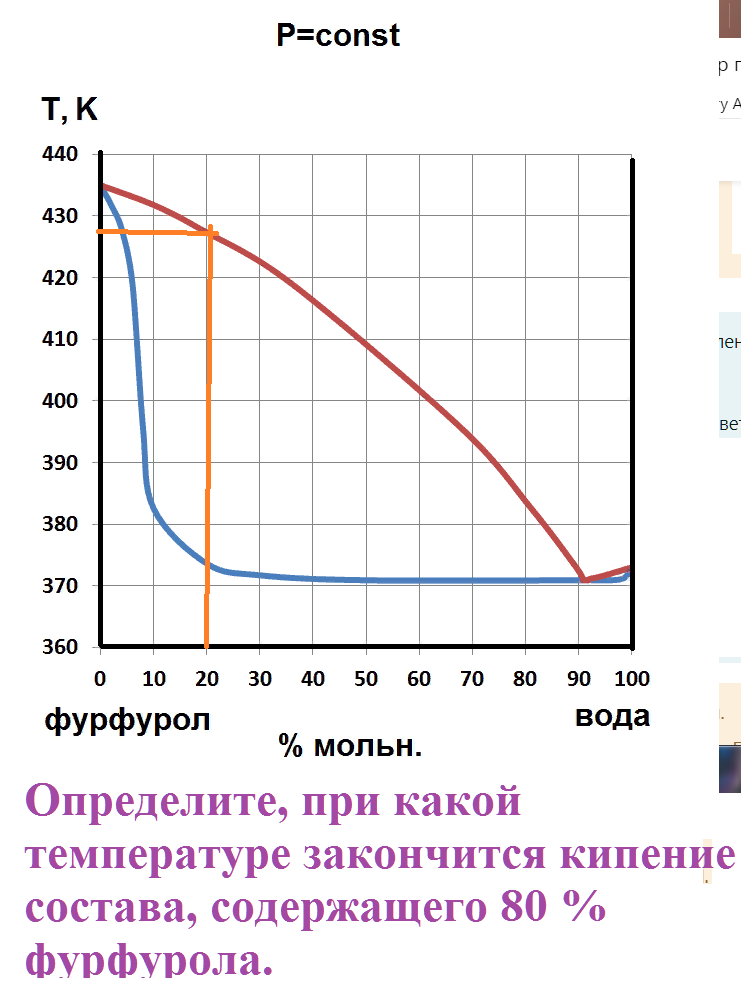
Определите, при какой температуре закончится кипение состава, содержащего 80 % фурфурола.
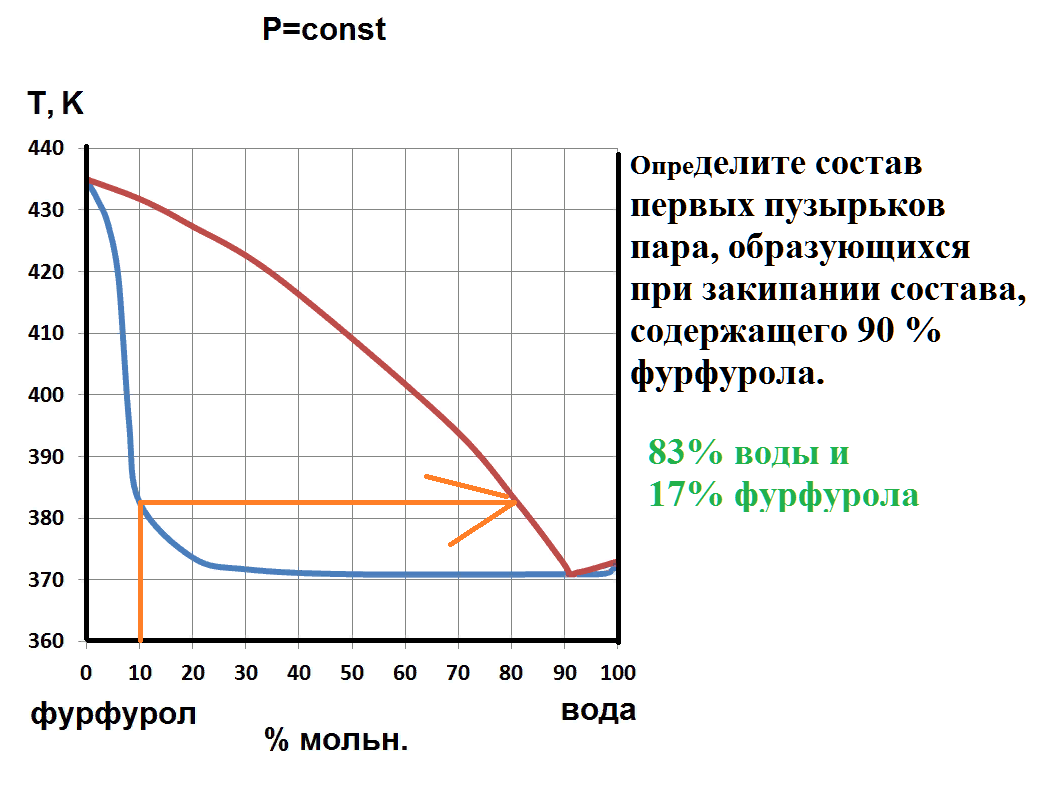
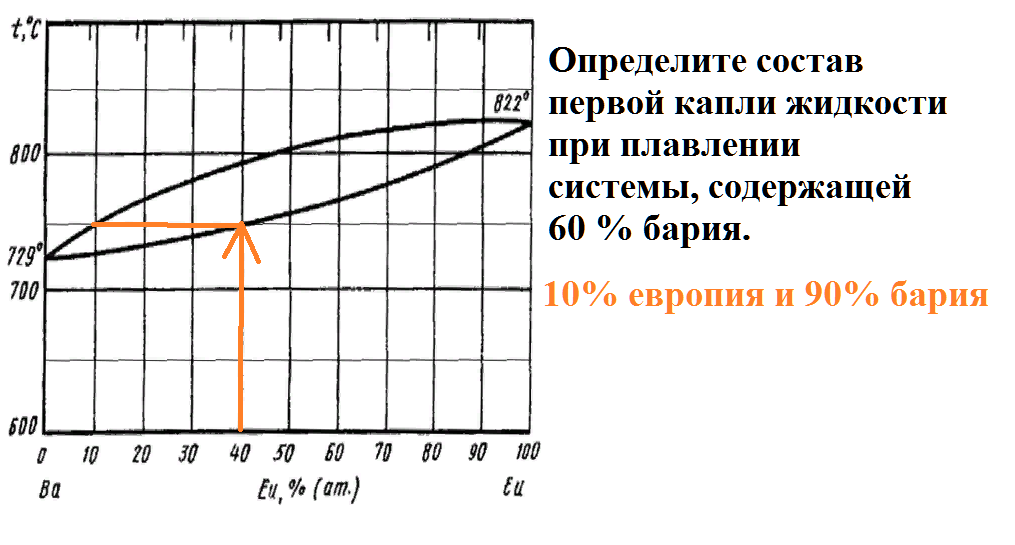
Определите состав первой капли жидкости при плавлении системы, содержащей 60 % бария
Определите состав последних капель жидкости, остающихся на дне перегонного куба при кипении состава, содержащего 60 % дейтерия. 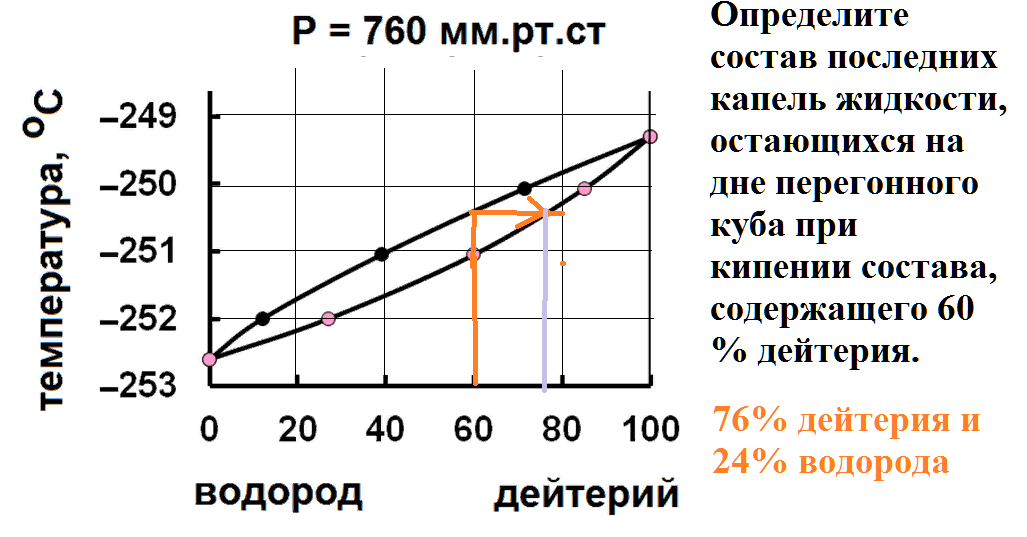
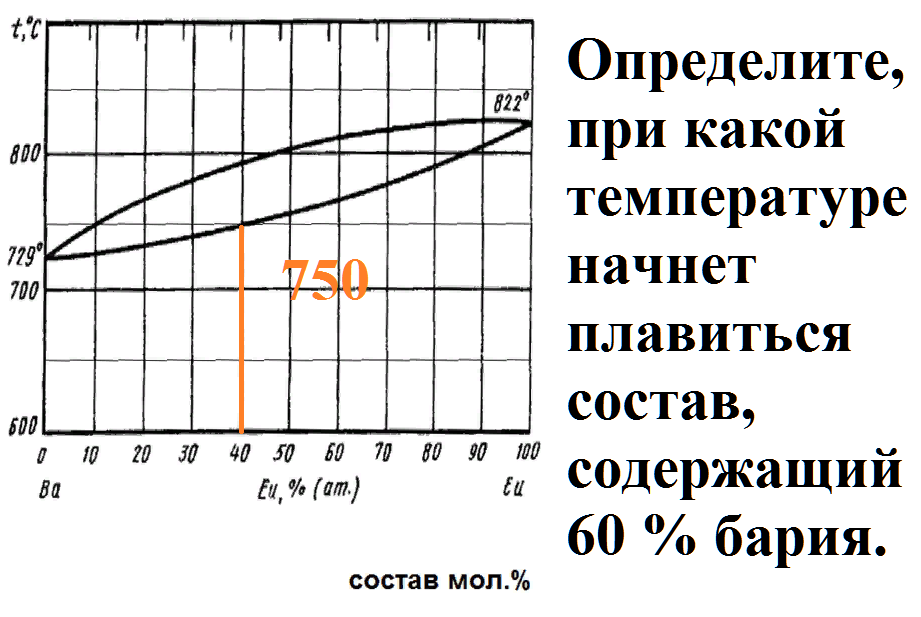
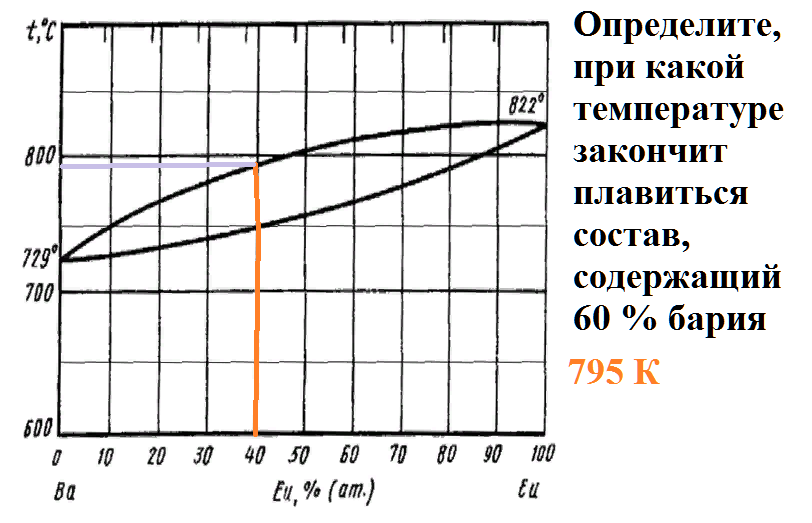
Определите, при какой температуре закончит плавиться состав, содержащий 60 % бария
На рисунке приведена фазовая диаграмма серы.
При нагревании серы до температуры К происходит…..
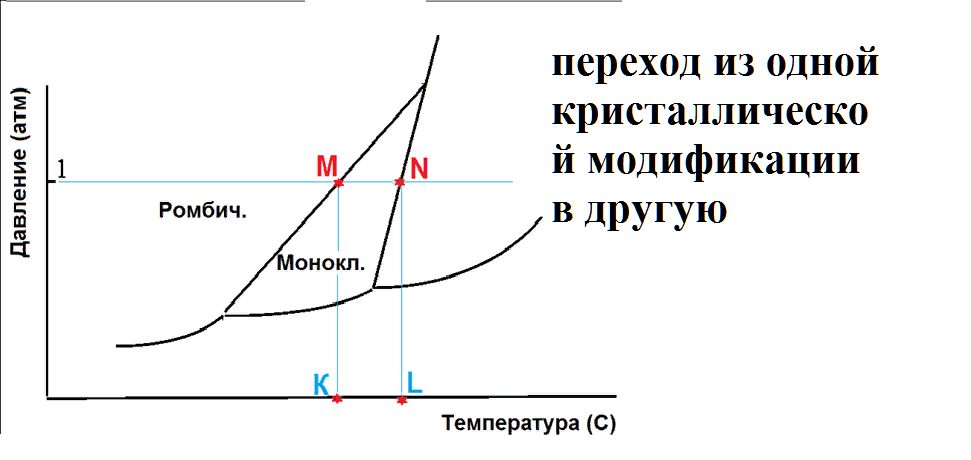
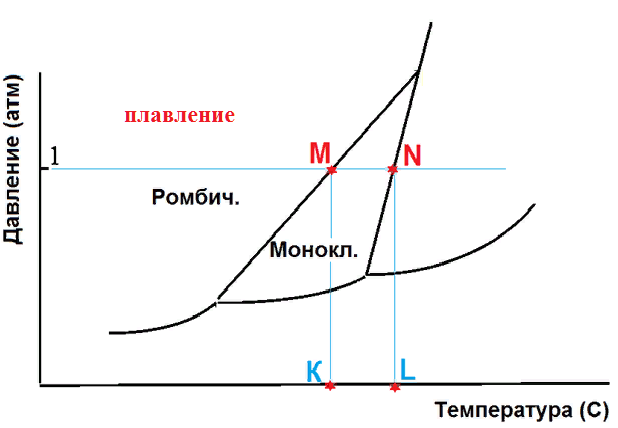
На рисунке приведена фазовая диаграмма серы.
При нагревании серы до температуры L происходит
Для каких процессов предпочтительно используется константа равновесия? Поставьте в соответствие
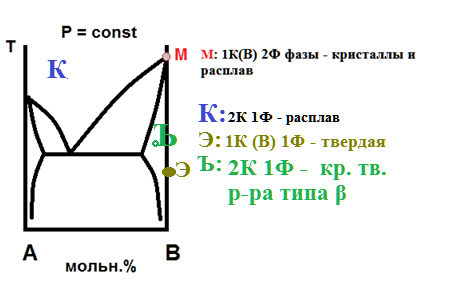
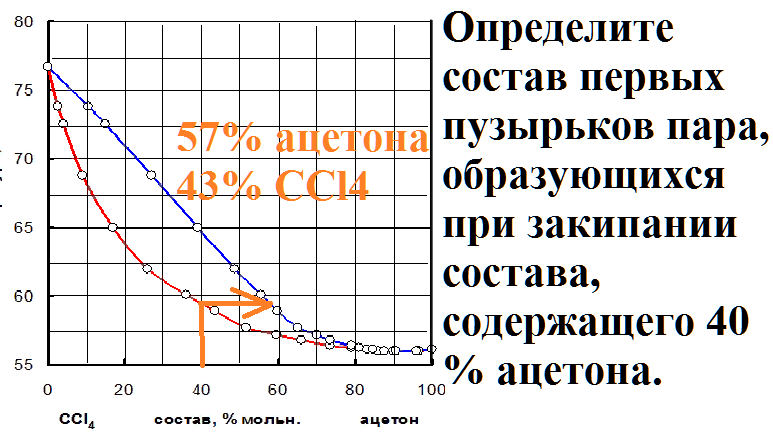
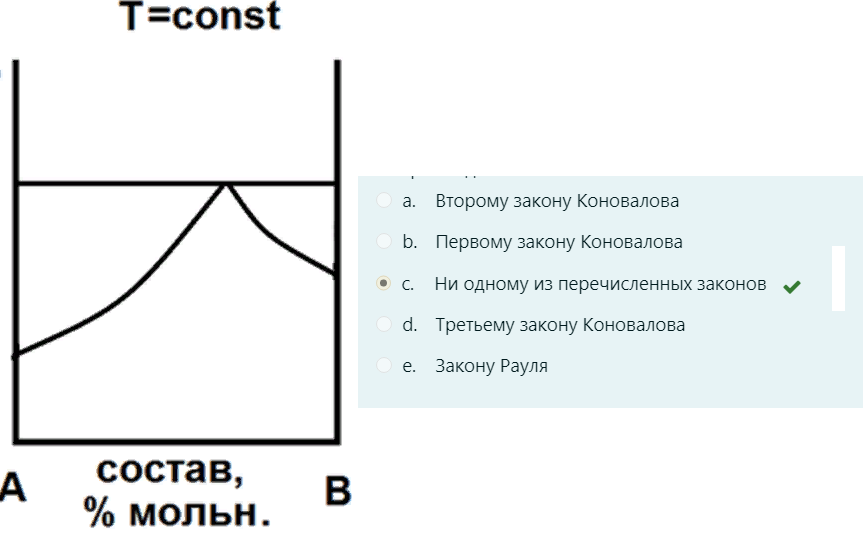
На рисунке приведена диаграмма давление-состав для системы из двух жидкостей. Какому закону подчиняется данная система?
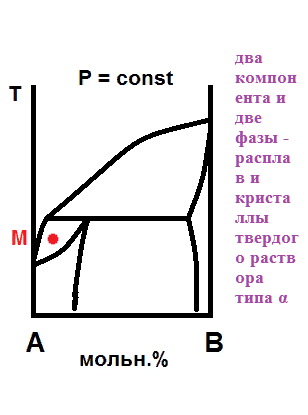
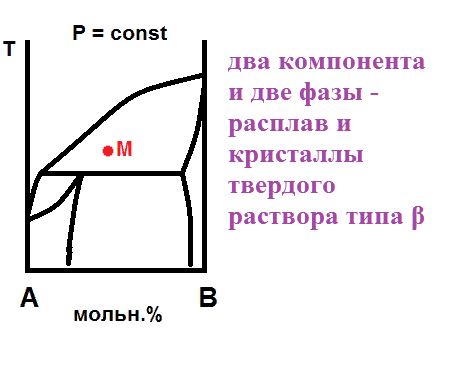
Дата добавления: 2021-07-19; просмотров: 7168; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
