Характеристика понятия «лихорадка». Этиология и патогенез лихорадки.
Тема: Нарушение терморегуляции. Ответ острой фазы.
1. Характеристика понятия «ответ острой фазы». Основные медиаторы ответа острой фазы (ООФ), их происхождение и биологические эффекты. Проявления ООФ, механизмы их развития. Значение ООФ.
Ответ острой фазы – общая реакция организма на воспаление, сопровождающаяся увеличением его резистентности к инфекциям. Проявления острой фазы:
1. Лихорадка (антибактериальный эффект);
2. Активация фагоцитоза и иммунитета (выработка цитокинов, нейтрофильный лейкоцитоз со сдвигом влево);
3. Диспротеинемия: увеличение концентрации a1- и а2~глобулинов (преимущественно при остром воспалении), у-глобулинов (преимущественно при хроническом воспалении), фибриногена, прокоагулянтов и плазминогена, гипоальбуминемия, отрицательный азотистый баланс;
4. Увеличение синтеза АКТГ и кортизола (неспецифическая резистентность);
5. Гиперлипидемия (за счет выброса адреналина и его действия на (b-адренорецепторы жировой ткани с последующим липолизом);
6. Увеличение концентрации К+ (повреждение клеток).
Белки острой фазы:
1. С-реактивный белок (является опсонином);
2. Сывороточный амилоид;
3. Транспортные белки (церуллоплазмин, гаптоглобин, орозомукоид);
4. Антиферменты (он-антитрипсин и агантихимотрипсин, а2-макроглобулин);
5. Фибриноген и плазминоген;
6. Компоненты системы комплемента.
Противовоспалительный эффект оказывают: агаититрипсин, агантихимотрипсин, церулоплазмин, кортизол.
|
|
|
Основные медиаторы:ИЛ1 ИЛб, ФНО - эндогенные пирогены, стимулирующие синтез белков острой фазы.
Интерлейкин-1. ИЛ-1 представляет собой многофункциональный цитокин, впервые обнаруженный как продукт лейкоцитов, вызывающий лихорадку при введении животным. ИЛ-1 относится к семейству, состоящему из трех структурно родственных пептидов: интерлейкина-1a (ИЛ-1a), интерлейкина-1b (ИЛ-1b) и антагониста рецептора для ИЛ-1.
Две известные формы ИЛ-1 (a и b) – продукты раздельных генов. Они отличаются аминокислотной последовательностью, но имеют трехмерную структуру. Они взаимодействуют с одним и тем же рецептором, обнаруживая сходную биологическую активность. Главная секреторная форма ИЛ-1 – ИЛ-1b возникает после расщепления соответствующего предшественника с помощью специфической внутриклеточной протеазы, названной ИЛ-1-конвертирующим ферментом. ИЛ-1 продуцируют многие клетки: моноциты, макрофаги, эндотелиоциты, нейтрофилы, В-лимфоциты, натуральные киллеры, фибробласты, дендритные клетки кожи, мезангиальные клетки почек, клетки глии, нейроны. Способностью секретировать ИЛ-1 обладают некоторые опухолевые клетки.
Синтез ИЛ-1 может быть вызван разными факторами: микроорганизмами и продуктами их жизнедеятельности, антигенами немикробного происхождения, органическими и неорганическими соединениями неантигенной природы таким, как соли кремния, желчных кислот, мочевой кислоты, цитокинами (ФНОa, ИЛ-6), активными компонентами комплемента (С5а), нейрогормонами (вещество Р), гликопротеинами табака, ионизирующим излучением, гипоксией, гипероксией, перегреванием и другими.
|
|
|
Биологические эффекты ИЛ-1. ИЛ-1 опосредует различные защитные процессы в организме, активируемые при его повреждении. Прежде всего, ИЛ-1 является медиатором воспаления, развивающегося на месте повреждения. Когда связанная с повреждением продукция ИЛ-1 возрастает, он вызывает многие системные реакции, что делает его важнейшим медиатором ООФ.
ИЛ-1 стимулирует иммунную систему. Он активирует Т-клетки, усиливает продукцию ими ИЛ-2, индуцирует экспрессию рецепторов для ИЛ-2 на активированных антигеном Т-клетках. Это приводит к быстрому разрастанию соответствующего клона Т-клеток. Совместно с другими цитокинами он активирует и В-клетки, способствуя их пролиферации и дифференцировке в продуцирующие антитела плазматические клетки.
|
|
|
Значительная часть эффектов ИЛ-1 реализуется с участие циклооксигеназы, которая катализирует метаболизм арахидоновой кислоты, ведущей к образованию простагландинов. Применение блокаторов циклооксигеназы (например, аспирина, индометацина) подавляет вызванную ИЛ-1 лихорадку, анорексию и другие эффекты.
В организме существует сложная система регуляции потенциально повреждающего действия ИЛ-1. В крови здорового человека и больных людей циркулируют растворимые рецепторы ИЛ-1, которые представляют собой фрагменты цитоплазматических рецепторов ИЛ-1 первого и второго типов. Оба растворимых рецептора связывают избыток свободного ИЛ-1, предупреждая тем самым его взаимодействие с мембранными рецепторами.
Другим важным элементом системы регуляции действия ИЛ-1 является естественный антагонист рецептора ИЛ-1 – третий член семейства ИЛ-1. Он синтезируется многими клетками, в том числе и теми клетками, которые продуцируют ИЛ-1, хотя главными источниками синтеза антагониста рецептора для ИЛ-1 являются, скорее всего, гепатоциты. Он специфически связывается с цитоплазматическими рецепторами для ИЛ-1, блокируя тем самым действие самого ИЛ-1 на его клетки мишени. Взаимодействие самого
|
|
|
ИЛ-1 с антагонистом рецептора не является сигналом для каких-либо внутриклеточных процессов, а его введение в кровь здоровым людям не оказывает заметного влияния на их организм: ни количество лейкоцитов, ни биохимические показатели не изменяются, не реагируют на него и железы внутренней секреции. Вместе с тем, этот антагонист интерлейкинового рецептора эффективно подавляет многие вызываемые ИЛ-1 патологические процессы – лихорадку, гипотензию, синтез белков острой фазы печенью, симптомы септического шока.
Должное соотношение между продукцией ИЛ-1 и антагониста его рецептора во время болезни регулируется определенными цитокинами. Так, ИЛ-6 и ФНОa стимулируют продукцию ИЛ-1, а ИЛ-4, ИЛ-10 и трансформирующий фактор роста-b усиливают секрецию антагонистов ИЛ-1 и одновременно снижают секрецию ИЛ-1.
Хотя в организме существуют механизмы «сдерживания» провоспалительной активности ИЛ-1, при некоторых условиях он синтезируется в чрезмерных количествах, что вызывает разрушение тканей, степень которого может превысить первоначальное повреждение. В таких случаях продукция ИЛ-1 становится фактором, определяющим все дальнейшее течение болезни.
ИЛ-1 – один из главных медиаторов острого повреждения легких, возникающего при остром респираторном дистресс-синдроме взрослых, который проявляется резким отеком легких и массированной инфильтрацией легочной ткани нейтрофилами. В бронхиальном лаваже обнаруживают высокое содержание ИЛ-1.
Интерлейкин-6. Многофункциональный цитокин ИН-6 впервые идентифицирован как секретируемый Т-клетками фактор, вызывающий конечную дифференцировку В-клеток в плазматические клетки, продуцирующие антитела. ИЛ-6 синтезируется макрофагами, фибробластами, эндотелиоцитами, эпителиальными клетками, моноцитами, Т-клетками, кератоцитами кожи, клетками эндокринных желез, глиальными элементами и нейронами отдельных областей мозга.
Главным стимулятором синтеза ИЛ-6 являются вирусы, бактерии, эндотоксины, липополисахариды, грибы, провоспалительные цитокины ИЛ-1 и ФНОa. ИЛ-1 секретируют также многие линии опухолевых клеток (остеосаркомы, карциномы мочевого пузыря, шейки матки, миксомы, глиобластомы). В отличие от нормальных клеток, опухолевые ткани продуцируют ИЛ-6 постоянно и в отсутствии всякой внешней стимуляции.
Реализация действия ИЛ-6 осуществляется через специфические рецепторы для ИЛ-6, наибольшее количество которых обнаруживается на гепатоцитах, почему до 80% всего вводимого меченого ИЛ-6 фиксируется клетками печени. Синтез рецепторов для ИЛ-6 осуществляется под влиянием самих молекул ИЛ-6. Рецепторы для ИЛ-6 имеются также на Т-лимфоцитах, В-лимфоцитах, активированных митогеном, фибробластах, моноцитах и др. Их находят также на мембранах клеток некоторых опухолей (гистиоцитомы, миеломы, астроцитомы и т.п.). Помимо фиксированных рецепторов имеется и растворимая форма интерлейкинового рецептора. Содержание растворимого рецептора для ИЛ-6 в крови значительно возрастает при аутоиммунных болезнях и плазмоцитомах, что может вызвать нежелательные последствия.
Биологическая роль ИЛ-6. ИЛ-6 – главный стимулятор синтеза и секреции белков острой фазы гепатоцитами. ИЛ-6 активирует ось «гипоталамус-гипофиз-надпочечники», вызывая секрецию кортикотропинвысвобождающего фактора нейронами гипоталамуса и прямо воздействуя на клетки передней доли гипофиза. Подобно ИЛ-1 он опосредует лихорадочный ответ на эндотоксин, стимулирует пролиферацию лейкоцитов в костном мозге.
ИЛ-6 необходим для конечной дифференцировки активированных В-лимфоцитов в плазматические клетки. Он усиливает продукцию некоторых классов иммуноглобулинов зрелыми плазматическими клетками, стимулирует пролиферацию и дифференцировку Т-лимфоцитов, усиливает продукцию ИЛ-2 зрелыми Т-клетками.
ИЛ-6 относится к семейству гемопоэтических цитокинов, он обладает свойствами фактора роста и дифференцировки для полипотентных стволовых клеток, стимулирует рост гранулоцитов и макрофагов. Кроме того, ИЛ-6 действует как фактор роста для некоторых неопластически трансформированных В-лимфоцитов, в том числе В-клеток человека, трансформированных вирусом Эпштейна-Барр. Он может быть аутокринным фактором роста для клеток миеломы человека, клеток лимфомы, плазмоцитомы, гибридомы.
Роль ИЛ-6 в болезнях. Хотя первичная роль ИЛ-6 состоит в активации процессов восстановления нарушенного гомеостаза, его избыточная продукция способствует повреждению тканей. Так, существует прямая корреляция между степенью увеличения ИЛ-6 и прогрессией аутоиммунного ответа. ИЛ-6 способствует воспалительному повреждению суставов при ревматоидном артрите. Длительное повышение уровня ИЛ-6 в крови может быть причиной активации остеокластов, разрушающих кость.
Важную роль играет ИЛ-6 в патогенезе множественной миеломы – опухоли, образованной неопластически трансформированными плазматическими клетками. ИЛ-6 – главный фактор поддержания пролиферации злокачественных плазмобластов.
ИЛ-6 представляется чувствительным, хотя и неспецифическим маркером болезней.
Биологическая роль ФНОa. ФНОa обладает мощным провоспалительным действием, которое обнаруживается, прежде всего, в местах его высвобождения. Он активирует лейкоциты, экспрессирует молекулы адгезии на мембранах эндотелиоцитов, способствуя миграции лейкоцитов из крови в межклеточный матрикс, стимулирует продукцию лейкоцитами активных метаболитов кислорода, секрецию провоспалительных цитокинов клетками воспалительной ткани, включая ИЛ-1, ИЛ-6, ИЛ-8, g-интерферон. Во время пролиферации ФНОa способствует размножению фибробластов, стимулирует ангиогенез.
ФНОa действует как иммунорегулятор: усиливает пролиферацию Т-лимфоцитов, пролиферацию и дифференцировку В-лимфоцитов, стимулирует рост натуральных киллеров, усиливает их цитотоксичность. ФНОa является одним из важнейших факторов защиты от внутриклеточных патогенов, обладает противовирусной активностью. Он замедляет рост или вызывает геморрагический некроз опухолей in vivo, цитотоксичен для многих линий опухолевых клеток in vitro. ФНОa участвует в гемопоэзе, защищает полипотентные стволовые клетки от сублетальных доз облучения и специфических токсинов клеточного типа, возможно, путем снижения митотической активности.
Роль ФНОa в болезнях. Чрезмерная продукция ФНОa является важнейшим звеном патогенеза септического шока. Содержание ФНОa в сыворотке прямо связано с вероятностью летального исхода при шоке. Блокада образования или предупреждение действия ФНОa на клетки, например, посредством анти-ФНО-a-антител оказывает благоприятное действие при экспериментальном септическом шоке у животных и у больных септическим шоком людей. Предполагают участие ФНОa в развитии раковой кахексии и кахексии при хронических инфекционных болезнях. ФНОa может быть ключевым медиатором в реакциях отторжения трансплантата и в болезнях трансплантат против хозяина. Он играет важную роль в повреждении мозга при менингитах, патогенезе ревматоидного артрита, формировании респираторного дистресс-синдрома и патогенезе других болезней.
Характеристика понятия «лихорадка». Этиология и патогенез лихорадки.
Лихорадка (от лат. febris) - типовой патологический процесс, характеризующийся активной задержкой тепла в организме вследствие смещения на более высокий уровень «установочной точки» центра теплорегуляции под действием пирогенных факторов. Долгое время лихорадка рассматривалась как симптом различных инфекционных и воспалительных заболеваний. В настоящее время установлено, что она представляет собой комплексный координированный ответ организма человека и гомойотермных животных на воздействие различных болезнетворных факторов и относится к проявлениям острофазной реакции иммунного ответа. Проявления лихорадки стереотипны и в основном не зависят от вида этиологического фактора, что и позволяет отнести ее к типовым патологическим процессам. Основным проявлением лихорадки является повышение температуры «ядра» тела, не зависящее от температуры внешней среды. Эта способность присуща только гомойотермным организмам, поскольку пойкилотермные животные не способны накапливать в своем организме тепло.
ОНТОГЕНЕЗ ЛИХОРАДКИ.
Новорожденные способны регулировать температуру тела непосредственно после рождения. У них вполне развиты вазомоторные реакции и секреция пота, но отсутствует способность усиливать теплообразование за счет непроизвольного сокращения мышц. Повышенное теплообразование осуществляется у новорожденных за счет усиления окислительных процессов в бурой жировой ткани (несократительный термогенез). Однако нужно иметь в виду, что у новорожденных и детей раннего возраста усилен процесс теплоотдачи вследствие увеличения удельной поверхности тела и недостаточно выраженной подкожной жировой клетчатки, поэтому дисбаланс между теплообразованием и теплоотдачей развивается у них чаще. Способность к развитию лихорадки выявляется на вторые сутки после рождения, но она выражена слабее, чем у детей старшего возраста. У грудных детей инфекционные болезни могут не сопровождаться лихорадкой, но если она возникает, то это свидетельствует о серьезности заболевания.
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ ЛИХОРАДКИ.
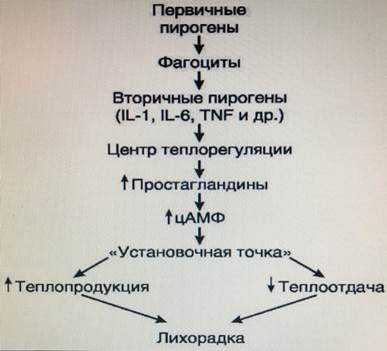
Подобно другим типовым патологическим процессам лихорадка является полиэтиологичной, т.е. вызывается многими причинами. В процессе возникновения и развития лихорадки основная роль отводится так называемым пирогенным веществам (от греч. pyros - огонь, pyretos - жар). Они подразделяются на первичные и вторичные. Их значение различно. Первичный пироген - это главный этиологический фактор для развития лихорадки, а вторичный пироген - это основное звено патогенеза лихорадки. Первичные пирогены могут быть инфекционного и неинфекционного происхождения. Инфекционные пирогены (их также называют экзогенными) в основном представляют собой термостабильные липополисахариды бактериальных мембран. К ним относятся эндотоксины грамотрицательных бактерий, из которых были получены путем очистки от белка высокоактивные пирогенные препараты, такие как пирогенал, пиромен, пирексаль. Эти вещества оказывают пирогенное действие в малых дозах, но при повторном введении они становятся менее активными, т.е. по отношению к ним развивается толерантность. Как показали исследования, развитие толерантности к липополисахаридам связано с тем, что при повторном их введении образуется меньше цитокинов, обладающих пирогенной активностью (интерлейкин (IL)1 и др.). Кроме липополисахаридов, роль экзопирогенов могут играть полисахариды, белки и нуклеиновые кислоты некоторых возбудителей инфекций. При неинфекционной лихорадке первичными пирогенами являются продукты распада нормальных и патологически измененных тканей и лейкоцитов, иммунные комплексы, фрагменты комплемента. В зависимости от этиологических факторов выделяют инфекционную и неинфекционную лихорадку. Инфекционная лихорадка возникает при острых и хронических заболеваниях, вызываемых бактериями, вирусами, простейшими, спирохетами, риккетсиями и грибками. Неинфекционная лихорадка наблюдается при:
• наличии в том или ином участке тела некротизированных тканей (например, при инфаркте миокарда и других органов);
• наличии очагов асептического воспаления (при панкреатите, подагре, тромбофлебите и других заболеваниях);
• аллергических заболеваниях (поллинозы, сывороточная болезнь и др.);
• внутренних кровоизлияниях, усиленном гемолизе эритроцитов;
• развитии злокачественных опухолей;
• асептической травме тканей (после хирургических операций);
• после гемотрансфузий, парентерального введения вакцин, сывороток и других белоксодержащих жидкостей.
Этот перечень является неполным. Первичные пирогены, как инфекционные, так и неинфекционные, сами по себе не могут вызвать характерную для лихорадки перестройку теплорегуляции. Их действие опосредуется через образование вторичных пирогенов, которые в состоянии такую перестройку вызвать. Образование вторичных пирогенов является основным патогенетическим фактором в развитии лихорадки независимо от вызывающей ее причины. Свойствами вторичных пирогенов обладают IL-1 и IL-6, фактор некроза опухолей (TNF) α; менее выраженное пирогенное действие оказывают интерферон, катионные белки и гранулоцитарномакрофагальный колониестимулирующий фактор (ГМ-КСФ). Местом образования вторичных пирогенов являются все фагоцитирующие клетки (гранулоциты, клетки системы мононуклеарных фагоцитов), а также эндотелиоциты, клетки микроглии; установлено, что в последних могут синтезироваться IL-1, IL-6, TNF-α. В лимфоцитах образуются интерферон и TNF-α. Продукция вторичных пирогенов вышеперечисленными клетками осуществляется в условиях активации их функции при контакте с первичными пирогенами в процессе фагоцитоза различных микроорганизмов, погибших или поврежденных клеток, иммунных комплексов, продуктов деградации фибрина и коллагена. Процесс образования вторичных пирогенов является температурозависимым и нуждается в транскрипции специфических информационных РНК (иРНК). В условиях in vitro установлено, что образование пирогенов прекращается при нагревании лейкоцитов до 56 °С в течение 30 мин, а также при добавлении в инкубационную среду 2,4-динитрофенола, подавляющего окислительное фосфорилирование. Внутривенное введение вторичных пирогенов вызывает лихорадку уже через 10-20 мин, а введение их в очень малых количествах (нанограммы) в область теплорегулирующего центра (преоптическая область гипоталамуса) стимулирует развитие лихорадки почти немедленно. Введение в преоптическую область первичных пирогенов развитием лихорадки не сопровождается, а после внутривенной инъекции очищенного эндотоксина повышение температуры происходит примерно через 45 мин. Развитие лихорадки является результатом воздействия вторичных пирогенов на центр теплорегуляции, локализующийся в преоптической зоне гипоталамуса. Действие пирогенов на нейроны гипоталамуса реализуется через образование простагландинов, которые в данном случае играют роль медиаторов (рис. 11-1)
Дата добавления: 2021-07-19; просмотров: 40; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
