Энтропия системы и её свойства. Определение изменения энтропии системы, совершающей какой-либо изопроцесс
Первое начало термодинамики
Первое начало термодинамики - закон сохранения и превращения энергии, которым сопровождаются термодинамические процессы. Оно утверждает: "Изменение внутренней энергии системы при переходе из одного состояния в другое равно сумме механических эквивалентов всех внешних воздействий". Математически первое начало термодинамики можно записать так
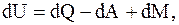 (8.1)
(8.1)
где dU - изменение внутренней энергии системы;
dQ - элементарное количество тепла, подводимого к системе;
dA - элементарная работа, совершаемая системой;
dM - другие виды элементарных энергий.
Если dM = 0, то
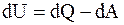 или
или 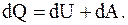 (8.2)
(8.2)
Из первого начала термодинамики вытекает невозможность построения вечного двигателя первого рода, т.е. такой машины, которая производила бы работу без потребления эквивалентного количества энергии.
Первое начало термодинамики в применении к изопроцессам в идеальных газах
Изотермический процесс
Изотермический процесс. Это процесс, протекающий при постоянной температуре (T = const). Тогда
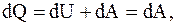 (8.3)
(8.3)
т.к. dU = Cv×dT = 0, то U = const, т.е. все подводимое к системе тепло идет на совершение этой системой работы, которую можно рассчитать так
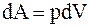 , а
, а 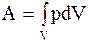 . (8.4)
. (8.4)
Из уравнения состояния идеального газа для моля или киломоля идеального газа 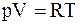 ,
, 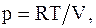 следовательно,
следовательно,
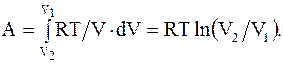 (8.5)
(8.5)
|
|
|
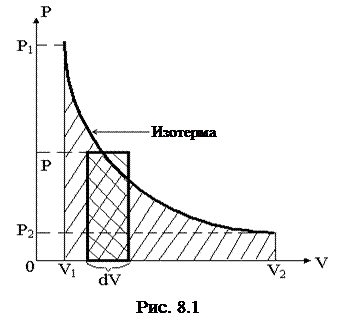
Графически эту работу (в координатах p, V) можно представить в виде площади фигуры, ограниченной изотермой ab, осью OV и прямыми V1 и V2 (рис.8.1).
Из полученного результата можно сделать вывод: при изотермическом процессе работа, совершаемая системой, зависит только от соотношения начального и конечного объемов.
8.1.1.2. Изобарический процесс
Изобарический процесс. Это процесс, протекающий при постоянном давлении (p = const).
В этом случае
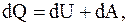 (8.6)
(8.6)
т.е. подводимое к системе тепло идет как на изменение ее внутренней энергии, так и на совершение этой системой работы. При этом
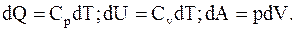 (8.7)
(8.7)
Определим долю подводимой к системе энергии, которая идет на совершение работы, и долю этой энергии, которая идет на изменение внутренней энергии системы. Известно, что
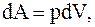 (8.8)
(8.8)
но для моля или киломоля идеального газа 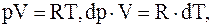 следовательно,
следовательно, 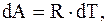
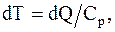 тогда
тогда
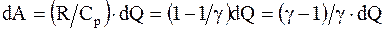 . (8.9)
. (8.9)
Изменение внутренней энергии
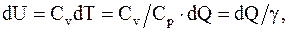 (8.10)
(8.10)
где g = Cp/Cv.
8.1.1.3. Изохорический процесс
Изохорический процесс. Это процесс, протекающий при постоянном объеме (V = const).
Первое начало термодинамики
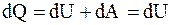 , (8.11)
, (8.11)
|
|
|
так как, 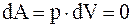 . Таким образом, при изохорическом процессе, все подводимое к системе тепло идет на изменение ее внутренней энергии. При этом
. Таким образом, при изохорическом процессе, все подводимое к системе тепло идет на изменение ее внутренней энергии. При этом
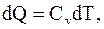 (8.12)
(8.12)
следовательно
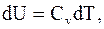
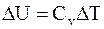 . (8.14)
. (8.14)
Изменение внутренней энергии системы пропорционально изменению ее температуры.
8.1.1.4. Адиабатический процесс
Очень часто на практике приходится иметь дело с процессами, протекающими без теплообмена или почти без теплообмена с окружающей средой. Такие процессы называют адиабатическими или адиабатными. Примером адиабатического процесса может служить быстро протекающий процесс сжатия или расширения газа.
Найдем зависимость между давлением и объемом при адиабатическом процессе, для чего воспользуемся первым началом термодинамики 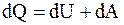 , так как
, так как 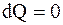 , то
, то
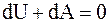 , а
, а 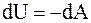 , (8.15)
, (8.15)
т.е. работа, совершаемая системой при адиабатическом процессе, сопровождается изменением ее внутренней энергии. Но, 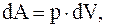 а dU = Cv×dT, тогда
а dU = Cv×dT, тогда
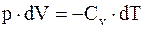 . (8.16)
. (8.16)
Из уравнения состояния идеального газа для моля или киломоля 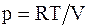 , следовательно
, следовательно
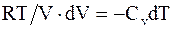 или
или 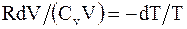 откуда,
откуда, 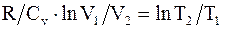 т.е.
т.е. 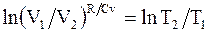 , а
, а
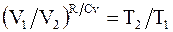 . (8.17)
. (8.17)
Известно, что 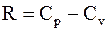 , а
, а 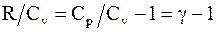 , тогда
, тогда
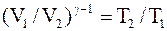 ;
;
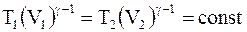
или
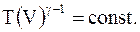 (8.18)
(8.18)
|
|
|
Следовательно, при адиабатических процессах произведение температуры на объем в степени (g - 1 ) для данной массы остается величиной постоянной.
Из полученного видно, что при адиабатическом расширении идеального газа его температура уменьшается, а при адиабатическом сжатии - увеличивается.
Из уравнения Менделеева - Клапейрона для моля или киломоля идеального газа 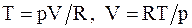 . Подставляя значения T и V в уравнение (8.18), имеем
. Подставляя значения T и V в уравнение (8.18), имеем
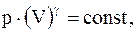
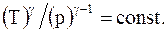 (8.19)
(8.19)
 Уравнения (8.18) и 8.19), связывающие давление и объем, температуру и объем, температуру и давление при адиабатическом процессе называют уравнениями Пуассона.
Уравнения (8.18) и 8.19), связывающие давление и объем, температуру и объем, температуру и давление при адиабатическом процессе называют уравнениями Пуассона.
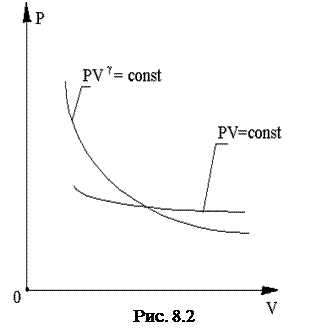
Графически (в координатах p, V) адиабатический процесс можно представить адиабатой. При этом адиабата располагается более круто, чем изотерма (рис. 8.2). Это объясняется тем, что при изотермическом сжатии давление возрастает за счет изменения молекулярной плотности, т.е. за счет увеличения числа ударов молекул о стенки сосуда. При адиабатическом процессе сжатие сопровождается повышением температуры, т.е. давление возрастает не только за счет увеличения молекулярной плотности, но и за счет роста средней скорости движения молекул.
Следует иметь в виду, что каждая точка адиабаты имеет температуру, отличную от других, следовательно, через каждую точку адиабаты можно провести соответствующую изотерму и наоборот.
|
|
|
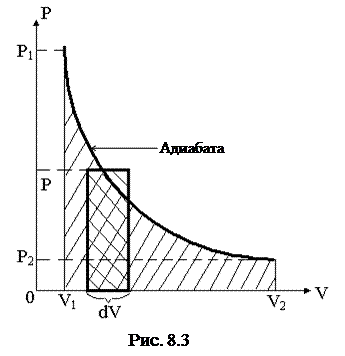
Определим работу, совершаемую идеальным газом при адиабатическом расширении. В этом случае работа совершается за счет изменения (уменьшения) его внутренней энергии:
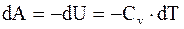 , а
, а 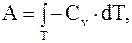 (8.20)
(8.20)
откуда
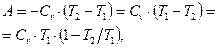 (8.21)
(8.21)
но, 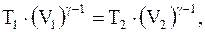 следовательно
следовательно
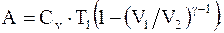 (8.22)
(8.22)
Так как 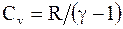 , то
, то
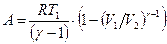 или
или 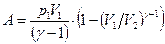 . (8.23)
. (8.23)
Графически эта работа изображается площадью фигуры, ограниченной адиабатой, осью OV, и прямыми V1 и V2 (рис.8.3).
Надо отметить, что все рассмотренные процессы в идеальных газах являются частными случаями политропического процесса.
Политропическим процессом называют такой, при котором p и V связаны соотношением
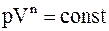 , (8.24)
, (8.24)
где n - показатель политропы, принимающий любые значения от - ¥ до + ¥. В частности для изобарического процесса n = 0; изотермического n = 1; адиабатического n = g; изохорического n = ¥.
Можно показать, что работа, совершаемая идеальным газом при политропическом процессе, определяется соотношением
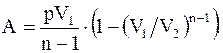 (8.25)
(8.25)
Теплоемкость тела при адиабатном процессе 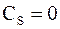 , т.к.
, т.к. 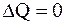 . Это означает, что теплоемкость при различных термодинамических процессах может принимать любые значения от -¥ до +¥. Указанное обстоятельство можно проиллюстрировать при помощи так называемой шкалы теплоемкостей:
. Это означает, что теплоемкость при различных термодинамических процессах может принимать любые значения от -¥ до +¥. Указанное обстоятельство можно проиллюстрировать при помощи так называемой шкалы теплоемкостей:
13.2. Обратимые, необратимые и круговые процессы (циклы)
Обратимым называется такой процесс, который протекает так, что после его окончания систему можно вернуть в первоначальное состояние, причем никаких изменений в окружающей систему среде не произойдет.
Процесс, протекающий так, что после его окончания систему нельзя вернуть в первоначальное состояние без изменений в окружающей среде, называется необратимым.
Примером необратимых процессов могут служить все процессы, которые сопровождаются силами трения, сопротивления или теплопередачей. Например, процесс передачи тепла всегда происходит от более нагретого тела к менее нагретому телу, или более нагретой части какого - либо тела к менее нагретой части этого же тела. Обратный процесс невозможен. В природе все процессы необратимы.
Кроме обратимых и необратимых процессов в термодинамике большое значение имеют различные круговые процессы или циклы.
Круговым процессом (циклом) называется такая последовательность превращений, в результате которой система, выйдя из какого-либо исходного состояния, возвращается в него вновь (рис.8.4).
Из первого начала термодинамики видно, что работа при расширении может совершаться либо за счет подводимого к системе тепла, либо за счет уменьшения ее внутренней энергии. Работа при сжатии сопровождается либо отводом от системы некоторого количества тепла, либо увеличением ее внутренней энергии.
 Если работа при расширении больше, чем работа при сжатии, то такой процесс (цикл) называется прямым. В противном случае – цикл обратный.
Если работа при расширении больше, чем работа при сжатии, то такой процесс (цикл) называется прямым. В противном случае – цикл обратный.
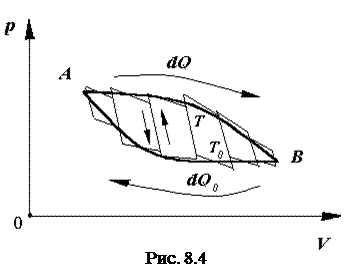
Рассмотрим один из возможных круговых процессов (рис.13.5).
 Пусть некоторая система, например, один моль идеального газа из состояния с параметрами p1, V1, T1 перешла изотермически в состояние с параметрами p2, V2, T1. При этом системой за счет подвода некоторого количества тепла Q1 при температуре Т1, была совершена работа
Пусть некоторая система, например, один моль идеального газа из состояния с параметрами p1, V1, T1 перешла изотермически в состояние с параметрами p2, V2, T1. При этом системой за счет подвода некоторого количества тепла Q1 при температуре Т1, была совершена работа
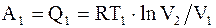 . (8.26)
. (8.26)
Для перехода системы в состояние с параметрами p3, V3, T2 (при V2 = const) надо понизить ее температуру от T1 до T2 ,что возможно, если система отдаст некоторое количество теплоты
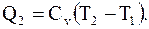 (8.27)
(8.27)
Изотермический переход системы в состояние с параметрами p4, V4, T2 можно осуществить, совершая над ней работу, что возможно, только при отводе от нее эквивалентного количества тепла Q3 = A2.
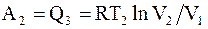 .(8.28)
.(8.28)
Для завершения цикла систему необходимо нагреть до температуры T1, подводя к ней некоторое количество тепла
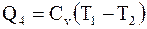 . (8.29)
. (8.29)
Так как Q2 = Q4, то работа цикла равна и эквивалентна разности количеств тепла, подводимого к системе при расширении и отводимого от нее при сжатии
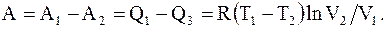 (8.30)
(8.30)
Для характеристики эффективности цикла вводится в рассмотрение физическая величина, называемая коэффициентом полезного действия, равная отношению работы цикла к работе, которую можно было бы совершить при превращении в нее всего количества тепла, подведенного к системе
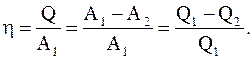 (8.31)
(8.31)
Превращение теплоты в работу используется в тепловых машинах. При этом более совершенной считается такая тепловая машина, у которой КПД стремится к единице.
8.3. Цикл Карно. Максимальный КПД тепловой машины
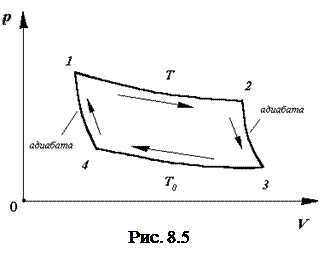
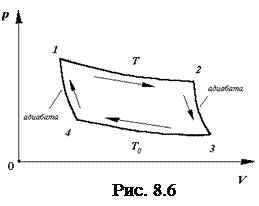 Наиболее совершенным в отношении КПД является цикл Карно, который состоит из двух изотерм (1-2, 3-4) и двух адиабат (2-3, 4-1) (рис.8.6).
Наиболее совершенным в отношении КПД является цикл Карно, который состоит из двух изотерм (1-2, 3-4) и двух адиабат (2-3, 4-1) (рис.8.6).
Пусть один моль или киломоль идеального газа в состоянии 1 имеет параметры p1, V1, T1.
После изотермического перехода из состояния 1 в состояние 2, его параметры изменяются p2, V2, T1, при этом он совершает работу, которая численно будет равна количеству тепла, подводимому к системе 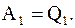
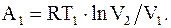 (8.32)
(8.32)
При адиабатическом расширении из состояния 2 в состояние 3 газ, совершив работу за счет изменения внутренней энергии, приобретет параметры p3, V3, T2. При этом
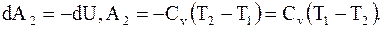 (8.33)
(8.33)
Для возвращения системы в первоначальное состояние необходимо газ изотермически сжать при температуре T2 до объема V4. А это возможно только в том случае, если от системы отбирается некоторое количество тепла Q2, равное работе над системой
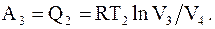 (8.34)
(8.34)
При этом параметры газа станут равными p4, V4, T2. Затем сжать адиабатически из состояния 4 в состояние 1. В этом случае, за счет работы, совершаемой над газом, произойдет увеличение внутренней энергии газа на величину
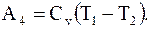 (8.35)
(8.35)
Разность между работой, совершенной системой при расширении, и работой, совершенной над системой при ее сжатии, будет равна работе цикла Карно
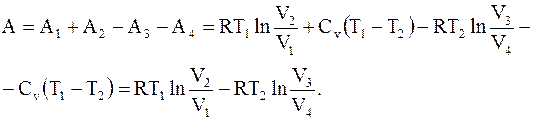 (8.36)
(8.36)
Тогда h цикла Карно
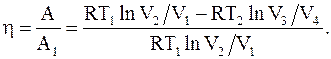 (8.37)
(8.37)
 Объемы V2 и V3, V1 и V4 лежат на соответствующих адиабатах, следовательно, согласно уравнениям Пуассона
Объемы V2 и V3, V1 и V4 лежат на соответствующих адиабатах, следовательно, согласно уравнениям Пуассона 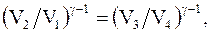
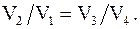
Таким образом
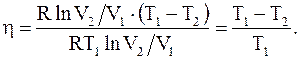 (8.38)
(8.38)
Из полученного соотношения видно, что h цикла Карно не зависит от природы вещества, а зависит лишь от температур, при которых теплота, сообщается системе и отбирается от нее.
Коэффициент полезного действия цикла Карно стремится к единице при возрастании T1 и стремлении к нулю температуры T2.
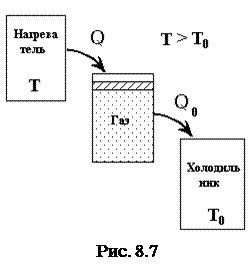
За цикл Карно часть тепла отбирается от внешнего по отношению к системе тела - нагревателя и передается системе. Часть ее превращается в работу, часть - отдается холодильнику. Такой цикл Карно встречается в тепловых машинах (рис. 8.7).
Надо иметь в виду, что цикл Карно обратим, что используется в холодильных машинах. В этом случае в результате совершения работы удается перевести некоторое количество теплоты от тела более холодного к телу более нагретому. Коэффициент полезного действия холодильной машины (холодильника)
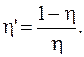 (8.39)
(8.39)
Кроме цикла Карно в технической термодинамике применяются цикл Отто, состоящий из двух адиабат и двух изохор, и цикл Дизеля,  состоящий из двух адиабат, изохоры и изобары (рис.13.8).
состоящий из двух адиабат, изохоры и изобары (рис.13.8).
Энтропия системы и её свойства. Определение изменения энтропии системы, совершающей какой-либо изопроцесс
Известно, что внутренняя энергия системы является функцией ее состояния. Характеристикой различных термодинамических процессов является энтропия. Энтропия системы физическая величина, элементарное изменение которой при переходе системы из одного состояния в другое равно полученному или отданному количеству теплоты, деленному на температуру, при которой произошел этот процесс. Энтропия, подобно внутренней энергии, является однозначной функцией состояния системы.
Бесконечно малое изменение энтропии определяется соотношением
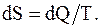 (8.40)
(8.40)
При переходе системы из одного состояния в другое, изменение энтропии можно рассчитать так
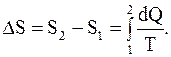 (8.41)
(8.41)
На основании первого начала термодинамики
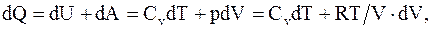
тогда
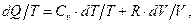
а
 (8.42)
(8.42)
Зная общую формулу для расчета изменения энтропии можно рассчитать изменение энтропии, если система совершает какой-либо изопроцесс, например:
1. Изотермический.
Известно, что при изотермическом процессе T = const, т.е. T1=T2, тогда
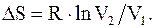 (8.43)
(8.43)
2. Изобарический.
Известно, что при изобарическом процессе p = const, т.е. V2/V1 = T2/T1, следовательно
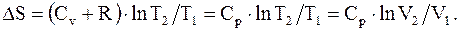 (8.44)
(8.44)
3. Изохорический.
При изохорическом процессе V = const, т.е. V2 = V1. Таким образом,
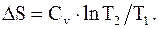 (8.45)
(8.45)
4. Адиабатический.
Известно, что при адиабатическом процессе dQ = 0, т.е. DS = 0, следовательно
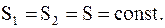 (8.46)
(8.46)
Для любых изопроцессов энтропия системы равна сумме энтропии всех тел, входящих в нее.
Найдем выражение для изменения энтропии системы, совершающей цикл Карно. В этом случае
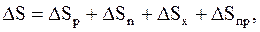 (8.47)
(8.47)
где DSр - изменение энтропии рабочего тела;
DSн, DSх - изменение энтропии нагревателя и холодильника;
DSпр - изменение энтропии "потребителя работы".
Так как рабочее тело при совершении цикла Карно возвращается в исходное состояние, то DSр = 0; DSп = 0 - энергия "потребителя работы" сообщается ему только в виде работы; DSн = - Q1/T1; DSх = - Q2/T2, что характерно для изотермических процессов. Таким образом
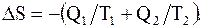 (8.48)
(8.48)
В случае совершения системой обратимого цикла Карно |Q1|=|Q2|, но Q1>0, Q2<0, следовательно, DSобр = 0 или Sобр=const, т.е. энтропия замкнутой системы, совершающей обратимый цикл Карно не изменяется.
Если системой совершается необратимый цикл, то 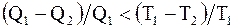 или
или 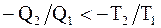 откуда
откуда 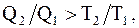 следовательно
следовательно 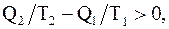 т.е.
т.е.
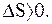 (8.49)
(8.49)
Таким образом, энтропия замкнутой системы, совершающей необратимый цикл, возрастает.
Объединяя полученные результаты для обратимых и необратимых процессов, для произвольных процессов, происходящих в замкнутой системе, будем иметь
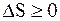 (8.50)
(8.50)
т.е. энтропия замкнутой (изолированной) системы при любых, происходящих в ней процессах, не может убывать.
Для бесконечно малого изменения состояния системы, с учетом того, что энтропия замкнутой системы при любых процессах, происходящих в ней, не может убывать, можно сделать вывод, что
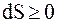 или
или 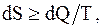 (8.51)
(8.51)
где знак равенства справедлив для обратимых процессов, а знак неравенства - для необратимых.
Так, например, пусть необратимость процесса обусловлена только теплообменом при конечной разности между температурами нагревателя T и тела (T - DТ), тогда
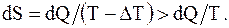 (8.52)
(8.52)
Для обратимых процессов
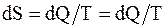 . (8.53)
. (8.53)
Определим работу для обратимых и необратимых изотермических процессов, воспользовавшись первым началом термодинамики в виде 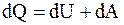 .
.
Так как из (13.51) 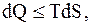 то
то
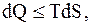 (8.54)
(8.54)
Из выражения (13.54) для обратимого процесса можно получить
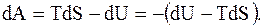 (8.55)
(8.55)
При изотермических процессах T = const, dT = 0, a
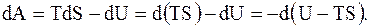 (8.56)
(8.56)
Таким образом, при обратимом изотермическом процессе работа, совершаемая системой над внешними телами, оказывается равной убыли некоторой величины F = U - T×S , которая называется свободной энергией. Она представляет собой ту часть внутренней энергии системы, которая превращается во внешнюю работу при обратимых изотермических процессах. Свободная энергия является функцией состояния системы.
Если процесс изотермический и необратимый, то 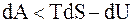 т.е.
т.е.
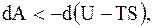
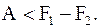 (8.57)
(8.57)
Таким образом, убыль свободной энергии определяет наибольшую величину работы, которую может совершить система при изотермическом процессе.
Величину T×S = U - F называют связанной энергией.
Связанная энергия представляет собой ту часть внутренней энергии, которая не может быть передана в виде работы при изотермическом процессе.
Второе начало термодинамики.
Как показал человеческий опыт, первого начала термодинамики недостаточно для того, чтобы объяснить своеобразие различных явлений в природе.
На основании первого начала термодинамики, внутренняя энергия системы может изменяться только в результате совершения работы или передачи некоторого количества теплоты. Работа может совершаться или внешними силами, действующими на систему, или системой над внешними силами. Количество теплоты либо передается от каких-либо тел, не входящих в систему, либо отбираться от самой системы внешними телами. Следовательно, в изолированной системе внутренняя энергия не изменяется.
В различных термодинамических системах можно представить различные процессы. Первое начало термодинамики позволяет выбрать из многообразия процессов такие, которые с точки зрения энергетических соотношений возможны. Однако оно не дает способа различия, какие процессы в действительности возможны, а какие нет.
Так, например, при смешении двух порций жидкости с разной температурой с точки зрения первого начала термодинамики возможен любой процесс, в результате которого температура смеси установится и будет равна t, при этом должно выполняться соотношение
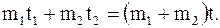 (8.58)
(8.58)
В то же самое время, возможен и такой процесс, при котором жидкость массой (m1 + m2), имеющая температуру t, самопроизвольно разделится на две порции массами m1 и m2 с различными температурами t1 и t2, при этом будет выполняться соотношение:
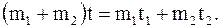 (8.59)
(8.59)
Однако в действительности последний процесс невозможен.
Точно также при смешении водного раствора какой-либо соли с чистой водой всегда наблюдается диффузия, которая приводит к выравниванию концентрации раствора во всей жидкости. Однако, никогда не наблюдается, чтобы растворенное в какой-либо жидкости вещество (соль) самопроизвольно собралось бы в одной ее части, в то время как во второй части оказался бы чистый растворитель.
Таким образом, возможные с точки зрения первого начала термодинамики процессы оказываются неравноценными в отношении их протекания: одни из них возможны, а другие нет.
На различие таких процессов и указывает второе начало термодинамики, которое можно сформулировать так: "В изолированной системе возможны только такие процессы, при которых энтропия системы возрастает". Т.е.
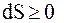 или
или 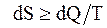 . (8.60)
. (8.60)
Следовательно, чтобы ответить на вопрос, возможен ли в изолированной системе тот или иной процесс, необходимо рассчитать изменение энтропии системы, которым сопровождается этот процесс и если оно положительно, то данный процесс возможен, если отрицательно - нет.
Таким образом, второе начало термодинамики определяет направление термодинамических процессов и указывает на физический смысл энтропии: энтропия - мера рассеяния энергии, т.е. характеризует ту часть энергии, которую нельзя превратить в работу.
Надо отметить, что вывод о невозможность превращения всего тепла, полученного от нагревателя, в работу справедлив не только для тепловой машины, работающей по циклу Карно, но и для тепловой машины, работающей по любому циклическому принципу. Это связано с тем, что любой произвольный замкнутый процесс (цикл) можно представить в виде элементарных циклов Карно. Для каждого элементарного цикла справедливо соотношение
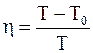 =
= 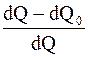 .
.
Откуда 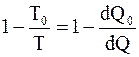 , или
, или 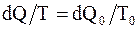 т.е.
т.е. 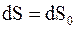 , следовательно,
, следовательно, 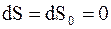 и
и 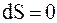 .
.
Таким образом, энтропия S системы это однозначная функция ее состояния. Приращение (изменение) энтропии не зависит от характера и последовательности процессов при переходе системы из одного состояния в другое, а определяется лишь исходным и конечным состояниями. С другой стороны в каждом элементарном цикле Карно некоторое количество тепла 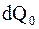 передается холодильнику. Таким образом, тепловая машина, работающая по любому циклическому принципу, не может полностью превратить получаемое от нагревателя тепло в работу.
передается холодильнику. Таким образом, тепловая машина, работающая по любому циклическому принципу, не может полностью превратить получаемое от нагревателя тепло в работу.
Принято называть тепловую машину, которая была бы в состоянии полностью превратить получаемое от нагревателя тепло в полезную работу, вечным двигателем второго рода.
На основании выше изложенного, можно сделать вывод о том, что любая конструкция, реализующая вечный двигатель второго рода, нереалистична.
Дата добавления: 2021-07-19; просмотров: 922; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
