Основные уравнения и граничные условия
Методы
Были созданы десять виртуальных моделей аневризмы с пятью различными параметрами асимметрии в диапазоне от β = 0,2 до 1,0 и с постоянной или переменной толщиной стенки для изучения потока и динамики стенки с помощью анализа взаимодействия жидкости и структуры. Стенка аневризмы была спроектирована так, чтобы иметь однородную толщину 1,5 мм или переменную толщину в диапазоне 0,5 - 1,5 мм.
Полученные результаты
Результаты позволяют количественно прогнозировать структуру потока и механику стенки, а также влияние асимметрии аневризмы и неоднородности толщины стенки на оценку пикового напряжения стенки. Эти параметры влияют на величину и распределение напряжений фон Мизеса;
изменение толщины стенки увеличивает максимальное напряжение по Мизесу в 4 раза по сравнению с его аналогом с однородной толщиной. Ретроградный поток до пика систолы наблюдался в мешке аневризмы для всех моделей, что связано с упругой энергией, запасенной в податливой стенке артерии, и силой расширения артерии во время систолы.
Вывод
И толщина стенки, и асимметрия геометрии влияют на напряжение, проявляемое аневримзой брюшной аорты. Наши результаты показывают, что асимметричная аневризма с вариациями толщины стенки будет подвергаться более высоким механическим напряжениям и повышенному риску разрыва, чем более веретенообразная аневризма с однородной толщиной стенки. Таким образом, важно точно воспроизвести геометрию сосуда и толщину стенки в расчетных прогнозах биомеханики.
|
|
|
Фон
Аневризма брюшной аорты - это локальное увеличение аорты, которое возникает преимущественно ниже почечной бифуркации, и представляют собой социально значимое сердечно-сосудистое заболевание. В недавнем исследовании сообщается, что распространенность аневризмы брюшной аорты составляет 8,8% среди населения старше 65 лет, причем мужчины страдают чаще, чем женщины, в соотношении 4:1. Аневризмы малоизвестны среди простого населения, но они являются важной причиной смертности. Пятнадцать тысяч человек ежегодно умирают от разрыва АБА только в России, что делает эту болезнь ведущей причиной смерти и поражающая 1 из 250 человек в возрасте старше 50 лет. Поскольку вероятность диагностирования аневризмы увеличивается с возрастом, ожидается, что частота аневризмы аорты будет увеличиваться с постоянным старением населения. Аневризмы можно лечить хирургическим путем, однако типичное лечение основано на оценке хирурга риска разрыва, общей пригодности пациента к операции, а также его продолжительности жизни. Несмотря на значительные улучшения в хирургических процедурах и методах визуализации, показатели смертности и заболеваемости, связанные с нелечеными разрывами АБА, остаются очень высокими. Заболевание ААА представляет собой серьезный риск для здоровья, поскольку этот вид аневризмы обычно протекает бессимптомно до момента ее разрыва. Оптимальная стратегия ясна: предотвращение разрыва аневризмы является основной целью лечения аневризматического заболевания.
|
|
|
Выбор между плановым лечением аневризмы и консервативным лечением заболевания затруднен из-за отсутствия надежного предиктора риска разрыва. Критический поперечный диаметр AAA от 5 до 6 см является наиболее частым пороговым значением, используемым в клинической практике для рекомендации хирургического вмешательства или эндоваскулярного вмешательства. Однако небольшие аневризмы также могут разорваться, и общая смертность, связанная с ними, может превышать 50%. Следовательно, в идеале решение о восстановлении аневризмы должно основываться не только на максимальном поперечном размере, а скорее на более надежном критерии, связанном с фактическим потенциалом разрыва конкретной артерии пациента, например, пиковым напряжением и прочностью стенки AAA. Поскольку разрыв аневризмы - это явление, которое происходит, когда механическое напряжение, действующее на расширяющуюся внутреннюю стенку, превышает ее прочность на разрыв, критерий восстановления, основанный на количественной оценке напряжения и прочности аневризмы, мог бы способствовать лучшему методу определения АБА с повышенным риском. К сожалению, в настоящее время не существует метода измерения напряжения или прочности тканей. Однако математические и вычислительные модели могут использоваться для прогнозирования среды механической жидкости и твердого тела в аневризматической аорте.
|
|
|
Напряжение стенки аневризмы является результатом нескольких факторов, таких как характеристика материала стенки, форма и размер мешка аневризмы, наличие внутрипросветного тромба и динамическое взаимодействие стенки с кровотоком. Поскольку внутренние механические силы поддерживаются динамическим действием крови, протекающей в аорте, количественная оценка гемодинамики имеет важное значение для характеристики их биомеханической среды. Обоснование исследований биомеханики основано на хорошо известном факте, что механика жидкости и стенок играет важную роль в патологических состояниях кровеносных сосудов.
|
|
|
Важно учитывать, как динамику кровотока, так и реакцию стенки, связанную с пульсирующим характером потока, для точного моделирования аневризмы. С постоянным улучшением времени обработки, вычислительные модели для конкретных пациентов в клинических условиях, вероятно, будут использоваться в ближайшем будущем в качестве инструмента для эффективного принятия решений при хирургическом и эндоваскулярном восстановлении аневризмы брюшной аорты.
В этой работе мы описываем сложное взаимодействие кровотока и податливой стенки аневризмы брюшной аорты для определения влияния асимметрии аневризмы и неоднородности толщины стенки на механические напряжения и динамику потока крови. В исследовании использовались десять виртуальных моделей, цель которых - предоставить метод количественной оценки механики стенок аневризмы. Последнюю затем можно сравнить со средней прочностью ткани стенки аневризмы аорты, чтобы обеспечить прогноз потенциала разрыва.
Методы
Геометрия AAA
Десять виртуальных моделей аневризмы были созданы с помощью программного обеспечения …………….. .
Модели различаются степенью асимметрии и неоднородности стенки и состоят из жидкой области 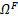 , представляющей просвет аорты, и твердой области
, представляющей просвет аорты, и твердой области 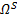 , представляющей стенку аневризмы. Жидкая область характеризуется круглыми поперечными сечениями, параллельными плоскости xy, с диаметром d = 2 см на входном и выходном участках и максимальным диаметром D = 3d в средней части мешочка аневризмы.
, представляющей стенку аневризмы. Жидкая область характеризуется круглыми поперечными сечениями, параллельными плоскости xy, с диаметром d = 2 см на входном и выходном участках и максимальным диаметром D = 3d в средней части мешочка аневризмы.
Асимметрия модели определяется параметром β, заданным формулой:
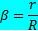
где r и R - радиусы, измеренные в средней части мешка AБA от продольной оси z до задней и передней стенок, соответственно, как показано на вставке на рис. 1 (а). Таким образом, β = 1,0 дает осесимметричную аневризму.

Рисунок 1. Геометрия для модели β = 0,6:
(а) жидкие и твердые области с постоянной толщиной стенки.
(б) твердые области с переменной толщиной стенки.
Геометрия жидкой области задается уравнением. (2), который определяет диаметр каждого поперечного сечения  и отклонение его центроида от оси z,
и отклонение его центроида от оси z, 
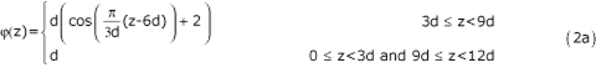
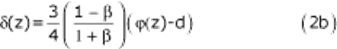
Геометрия твердой области задается стенкой AAA либо постоянной толщины, либо переменной толщины. Оба типа конструкций стенок моделируют толщину аневризмы как материала, обычно выталкиваемого с поверхности, окружающей просвет. Модель постоянной толщины имеет толщину  а модель переменной толщины имеет
а модель переменной толщины имеет 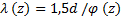 (в мм) на каждом поперечном сечении.
(в мм) на каждом поперечном сечении.
Отсюда следует, что локальная толщина стенки варьируется от 0,5 мм до 1,5 мм (в среднем 1,0 мм для мешка AAA), что обратно пропорционально локальному диаметру поперечного сечения. В случае разрыва AAA толщина стенки в месте разрыва может составлять всего 0,23 мм при средней ширине поверхности 1,45 мм. Асимметрия виртуального AAA задается βε {1,0, 0,8, 0,6, 0,4, 0,2}, что дает в общей сложности десять геометрий, пять из которых имеют одинаковую толщину стенки (UW), а другие пять - переменную толщину стенки (VW ). β = 1,0 соответствует азимутальной симметрии, а β = 0,2 - это AAA, при которой только передняя стенка расширена, а задняя стенка почти плоская. На рисунке 1 (а) показано β = 0,6 с объектами  в жидкой области в модели с однородной толщиной. Рисунок 1 (b) качественно иллюстрирует область переменной толщины
в жидкой области в модели с однородной толщиной. Рисунок 1 (b) качественно иллюстрирует область переменной толщины  в трех разных местах стенки для одной и той же модели β = 0,6.
в трех разных местах стенки для одной и той же модели β = 0,6.
Основные уравнения и граничные условия
Основными уравнениями для жидкой области являются уравнения неразрывности и уравнения Навье-Стокса с предположениями об однородном, несжимаемом и ньютоновском потоке. Была принята произвольная лагранжево-эйлерова формулировка (ALE). Формулировка ALE вводит движущуюся систему координат для моделирования деформации жидкой области. Уравнения сохранения импульса и массы, управляющие потоком, даются уравнением. (3) в форме ALE:
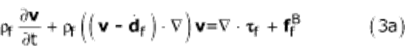

Где  - плотность жидкости,
- плотность жидкости,  - тензор напряжений жидкости,
- тензор напряжений жидкости,  - объемные силы на единицу объема, v - вектор скорости жидкости,
- объемные силы на единицу объема, v - вектор скорости жидкости, 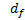 - координата скорости движения соответственно. В формулировке ALE (
- координата скорости движения соответственно. В формулировке ALE (  - относительная скорость жидкости по отношению к движущейся координатной скорости.
- относительная скорость жидкости по отношению к движущейся координатной скорости.
Моделируется кровь с плотностью 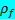 =
= 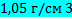 и динамической вязкостью
и динамической вязкостью 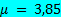 сП.
сП.
Основным уравнением для твердой области является уравнение сохранения импульса, задаваемое формулой (4). В отличие от формулировки ALE уравнений жидкости, принята лагранжева система координат:
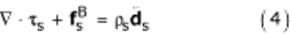
где 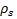 - плотность стенки AAA,
- плотность стенки AAA, 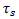 - тензор напряжений твердого тела,
- тензор напряжений твердого тела, 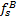 - объемные силы на единицу объема и
- объемные силы на единицу объема и 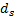 - локальное ускорение твердого тела.
- локальное ускорение твердого тела.
Предполагается, что стенка AAA представляет собой изотропное, линейное, упругое твердое тело с плотностью 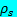 = 2,0 г / см 3 , модулем Юнга
= 2,0 г / см 3 , модулем Юнга 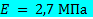 и коэффициентом Пуассона υ = 0,45. Предыдущие исследования показали, что ткань аневризмы представляет собой нелинейный, изотропный, гиперэластичный материал. Следовательно, существенная линейность стенки AAA является упрощением анализа и напряжений в этом исследовании. В формулировке предполагается, что стенка AAA претерпевает большие смещения и небольшие деформации.
и коэффициентом Пуассона υ = 0,45. Предыдущие исследования показали, что ткань аневризмы представляет собой нелинейный, изотропный, гиперэластичный материал. Следовательно, существенная линейность стенки AAA является упрощением анализа и напряжений в этом исследовании. В формулировке предполагается, что стенка AAA претерпевает большие смещения и небольшие деформации.
Для задания граничных условий граница жидкостной области разбивается на следующие области: вход ( 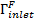 ), выпускное отверстие (
), выпускное отверстие ( 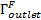 ) и интерфейс взаимодействия жидкость-конструкция (
) и интерфейс взаимодействия жидкость-конструкция ( 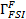 ), как показано на рисунке 1 (а).
), как показано на рисунке 1 (а).
Применяемые граничные условия на областях, не относящихся к FSI: (i) зависящий от времени полностью развернутый профиль скорости и (ii) зависящее от времени нормальное сцепление (из-за давления в просвете) на . Они представлены формулой. (5) следующим образом:

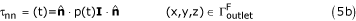
где τ nn - нормальное тяговое усилие, u (t) и p (t) - зависящие от времени формы волны скорости и давления, показанные на рисунке 2, обозначающие нормаль соответствующей границы, а I - стандартная единичная матрица.

Зависимость от времени, представленная u(t) и p(t), задается представлениями ряда Фурье форм волны, обобщенных в формуле. (6):

N - количество гармоник, используемых для воспроизведения измерений in vivo скорости просвета (N = 18), u(t) и давления (N = 7), p (t), соответственно.
Эти формы волн представляют собой трехфазные импульсы, соответствующие нормальным условиям гемодинамики в инфраренальном сегменте брюшной аорты человека, о которых впервые сообщили Mills et al.
Использование входной переходной скорости, основанной на нормальной физиологии, оправдано тем фактом, что входное граничное условие применяется над проксимальной шейкой аневризмы, недилатированным сегментом брюшной аорты. В обычных условиях покоя кровоток в брюшной аорте обычно ламинарный; замедление потока, достигнутое после пиковой систолы, вызывает ламинарные условия возмущенного потока и образование вихрей даже в смоделированных условиях физической нагрузки. Пиковый систолический поток на входе возникает при t = 0,304 секунды, а пиковое давление на выходе при t = 0,4 секунды.
· Среднее по времени число Рейнольдса Re m = 410, что характерно для пациента в состоянии покоя. Re m рассчитывается как 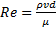 , где – v - усредненная по времени средняя скорость на входе, а d - диаметр на входе.
, где – v - усредненная по времени средняя скорость на входе, а d - диаметр на входе.
· Число Уомерсли,  , характеризует частоту потока ω (ω = 2π / T и T = 1,0 секунды), геометрию и вязкостные свойства жидкости и составляет α = 13,1, типичное значение для брюшной аорты человека в условиях покоя.
, характеризует частоту потока ω (ω = 2π / T и T = 1,0 секунды), геометрию и вязкостные свойства жидкости и составляет α = 13,1, типичное значение для брюшной аорты человека в условиях покоя.
· Амплитудный коэффициент формы волны скорости определяется как

На рисунке 1 (b) показана граница твердой области, разделенная на входную ( ), выходную ( ) и границу раздела жидкость-структура ( ). Интерфейсы FSI идентичны и соединяют жидкую и твердую области. Граничные условия на не-FSI областях твердой области накладывают нулевой сдвиг на концах и, как задается уравнением. (7). Это соответствует полной фиксации концов домена, имитирующей фиксацию аорты окружающими тканями и органами. Численные эксперименты с целью минимизации напряжений в проксимальной и дистальной части шеи позволили разместить входной и выходной участки на расстоянии 1,5d от мешка аневризмы.
Эффект асимметрии
Динамика кровотока в моделях аневризмы определяется относительной податливостью сосуда, определяемой его неоднородной формой (асимметрией и толщиной стенки) и характеристиками материала стенки. На рис. 5 показаны схемы потока для β = 0,2 и β = 1,0 при t = 0,4 с (пиковое систолическое давление по отношению к граничному условию нормальной тяги на выходе) для равномерной толщины стенки. Векторы скорости иллюстрируют обтекаемый профиль без вихрей, путь потока, обычно связанный с состоянием систолического ускорения. Эта характеристика потока существенно отличается от описанной в [ 11] для наиболее асимметричной жесткой модели AAA (β = 0,3), поскольку энергия, запасенная расширяющимся податливым сосудом во время систолы, выбрасывает вихрь вниз по потоку вскоре после пикового потока. Фазовая задержка (0,096 секунды) между кривыми входной скорости и выходного давления также учитывает эту разницу, то есть поток начал временно замедляться в то время, когда стенка полностью расширяется из-за систолического давления.
Рисунок 5. 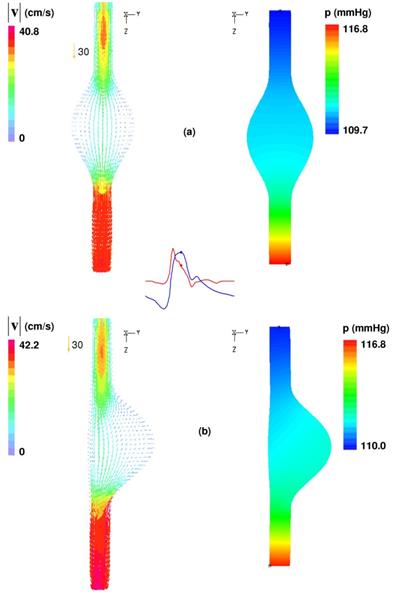
Векторы скорости и давление жидкости у стенки при t = 0,4 с в плоскости yz для моделей с однородной толщиной стенки (UW) (а) β = 1,0 и (б) β = 0,2.
Распределение давления на стенку между двумя моделями почти идентично в продольном сечении, заданном плоскостью YZ. Поскольку модель с β = 0,2 содержит такой же объем жидкости в мешочке аневризмы, этот результат не является полностью неожиданным. Более того, изменение направления градиента давления, обусловленное более низким давлением на входе, а не на выходе, означает ранее заявленный эффект фазового сдвига на динамику потока, а также влияние противоположной формы волны давления, накладываемой на торговая точка. С наступлением условий диастолического потока скорость на входе начинает замедляться, уменьшая общий градиент давления. Ожидается, что по мере продолжения сердечного цикла это падение давления будет уменьшаться, создавая области реверсирования потока и рециркуляции, в которых преобладают конвективные эффекты, т. Е.
Оценка влияния асимметрии на структуру потока ниже по потоку от мешочка AAA показывает, что для равномерной толщины стенки динамика вихря, генерируемая для β = 0,2 и β = 1,0, практически идентична на одних и тех же временных стадиях цикла потока. Однако вихри, которые развиваются и рассеиваются в аневризме, остаются в средней части и дистальном конце мешка для β = 1,0, тогда как β = 0,2 подвержены более сильным рециркуляционным потокам, и вихри перемещаются вверх по потоку к проксимальному концу аневризмы, особенно в диастолу (t ≥ 0,6 с). Это перемещение вихря вдоль передней стенки является эффектом ретроградного потока, вызванного фазовым сдвигом формы волны скорость-давление и мгновенным изменением направления потока во время диастолы. Асимметричная геометрия модели с β = 0,2 усиливает этот эффект, позволяя вихрям дольше оставаться вдоль выпирающей передней стенки из-за местного замедления потока. И наоборот, симметричная модель имеет меньшую кривизну вдоль передней стенки, и вихри развиваются и рассеиваются быстрее, поскольку конвективные эффекты слабее.
Рост вихря внутри мешка AAA создает благоприятные условия для увеличения скорости отложения тромбоцитов, образования тромбов и повышенного риска разрыва [ 28 ]. Влияние динамики потока аневризмы на механику стенки может быть определено с помощью прогнозов напряжения Фон Мизеса, энергетической формулировки, принятой вместо представления девяти компонентов тензора напряжений второго порядка. Это величина напряжения, используемая в области механики разрушения, которая характеризует энергию деформации (α σ 2 / E) материала, подверженного нагрузке и деформации. Следовательно, его можно использовать в качестве критерия отказа по отношению к экспериментальному значению допустимого напряжения. Согласно теории Хубера-фон Мизеса-Хенки, отказ должен произойти, если уравнение (10) действительно:
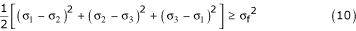
где член в левой части представляет собой квадрат напряжения Фон Мизеса, которое является функцией локальных главных напряжений σ 1 , σ 2 и σ 3 при определенном напряженном состоянии конструкции, а σ f - одноосное разрушение материала.
Геометрия хорошо известна как фактор, способствующий расширению аневризмы и потенциалу разрыва, независимо от неоднородности стенки. Рисунок 6 показывает величину смещения и распределение напряжений для моделей с равномерной толщиной стенки β = 0,2 и β = 1,0. В каждом случае в точках перегиба кривизны аневризмы возникают значительные градиенты. Для β = 1,0 изменения кривизны приводят к более высоким смещениям и повышенному напряжению, что указывает на эффект потока через постепенное расширение и сжатие геометрии. При β = 0,2 только передняя стенка (левая рамка) отображает градиент смещения в точках перегиба, в то время как напряжение Фон Мизеса является максимальным на задней стенке (правая рамка). Это результат кровотока и давления жидкости, действующих на стенку уменьшающейся кривизны, так как задняя стенка этой модели почти плоская.

Рисунок 6
Распределение смещения и напряжения стенки по Мизесу при t = 0,4 с для моделей с однородной толщиной стенки (UW) (а) β = 1,0 и (б) β = 0,2. Символ Δ указывает место максимального напряжения стенки.
Сравнение величины напряжения стенки между β = 1,0 и β = 0,2 при t = 0,4 с показывает, что симметричный AAA подвержен напряжению Фон Мизеса на 14% ниже (23,8 Н / см 2 по сравнению с 27,7 Н / см 2 ), чем сильно асимметричный. Эффект асимметрии подтверждается рисунком 7, где напряжение для всех пяти моделей масштабировано до максимума модели с β = 0,2. Изменение положения максимального напряжения во многом связано с изменением формы мешка аневризмы. В частности, между β = 0,6 и β = 0,4 местоположение смещается от передней стенки на дистальном конце к задней стенке в среднем сечении, что является следствием уменьшения кривизны задней стенки, что обеспечивает высокую скорость потока вдоль этой стенки.
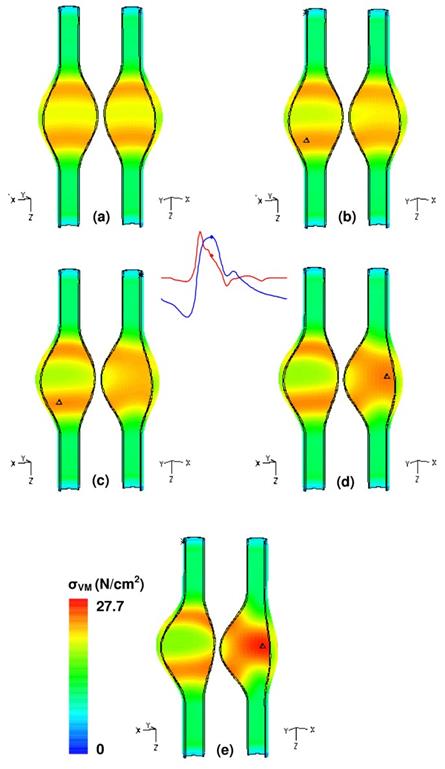
Рисунок 7
Распределение напряжения стенки по Мизесу при t = 0,4 с для моделей возрастающей асимметрии и однородной толщины стенки (UW): (а) β = 1,0, (б) β = 0,8, (в) β = 0,6, (г) β = 0,4 , д) β = 0,2. Символ Δ указывает место максимального напряжения стенки.
Предыдущие авторы сообщали о влиянии асимметричной формы и изменения геометрии на механику стенок AAA. Elger и др. [ 29 ] изучали осесимметричные гипотетические модели AAA и пришли к выводу, что окружные напряжения больше для форм аневризмы меньшей кривизны при постоянном максимальном диаметре. В квазистатическом анализе напряжений твердых тел (CSS S ) Vorp и соавторы [ 30 ] оценили распределение напряжений по фон Мизесу в виртуальных моделях AAA, подобных тем, которые представлены в этой работе, для различной асимметрии и переменного максимального диаметра. Они сообщают о сопутствующем увеличении напряжения стенки с увеличением диаметра и асимметрии со значениями напряжения того же порядка величины, что и в настоящих исследованиях FSI для моделей UW.
Эффект толщины стенки
Фактором, имеющим все большее значение при прогнозировании риска разрыва AAA, является неоднородность стенки, в частности ее толщина. Трудно точно оценить этот размер на КТ-изображениях конкретного пациента из-за кальцификации, тромба и отсутствия четкого определения изображения между внутренней и внешней поверхностями стенки. Поэтому при моделировании отдельных AAA обычно принимается однородная толщина 1,5 мм [ 13 ]. Однако экспериментальный отбор образцов стенок показывает, что стенка на самом деле неоднородна, истончается в ответ на пульсацию и прогрессирующее расширение мешка аневризмы [ 31 ].
Как видно из рисунка 8, переменная толщина стенки влияет на динамику потока, а также на распределение напряжений при t = 0,4 с, независимо от симметрии. При β = 1,0 видна преимущественно связанная структура потока с однородной толщиной стенки, в то время как кольцеобразный вихрь наблюдается около дистального конца для переменной толщины стенки. Также важное значение для образования вихрей имеет периодический характер ускорения потока и ретроградный поток, обнаруживаемый на дистальном конце в обеих моделях. В модели переменной толщины стенки поток меняет направление на противоположное чаще, обеспечивая отрицательные скорости потока на дальнем конце почти в два раза чаще, чем в модели с однородной толщиной стенки. В основном это происходит из-за повышенной податливости и большей деформации более тонкой стенки, которая возникает в результате изменений импульса, генерируемых жидкостью на протяжении сердечного цикла.

Рис.8. Влияние равномерной (слева) и переменной (справа) толщины стенки: (а) векторы скорости плоскости yz и (б) распределение напряжений по Мизесу при t = 0,4 с для модели β = 1,0. Символ Δ указывает место максимального напряжения стенки.
Картины напряжения фон Мизеса для модели с β = 1,0, показанные на рисунке 8 для t = 0,4 с, демонстрируют важность толщины стенки для критерия потенциала разрыва AAA. Предположение об однородной толщине стенки приводит к недооценке максимального напряжения стенки (23,8 Н / см 2 для UW и 105,0 Н / см 2 для VW) почти на 77% по сравнению с моделью переменной толщины стенки. Максимальное напряжение возникает там, где стенка самая тонкая, в средней части мешочка; для модели с однородной толщиной стенки максимальное напряжение возникает вблизи проксимального и дистального концов аневризмы, что указывает на важность изменений геометрии в механике аневризмы. Этот эффект показан на рисунке 9, как для пикового смещения, так и для пикового напряжения по Мизесу, с равномерным масштабом стенки, представленным левой вертикальной осью, и переменным масштабом стенки, соответствующим правой вертикальной оси. Для метода FSI максимальное напряжение стенки и максимальное смещение не достигаются при t = 0,4 с, как в случае CSS S и CSS T.методов, но скорее в течение 0,304 с <t <0,4 с, что соответствует интервалу фазовой задержки между пиковыми граничными условиями на входе и выходе. Следовательно, из этого следует, что эффекты граничных условий потока и тяги в FSI не передаются мгновенно на стенку AAA, что приводит к максимальной деформации после пикового потока на входе. Это происходит из-за упругой энергии, накопленной в стенке AAA от предыдущих пульсирующих циклов моделирования, ведущих до и во время последнего пульсирующего цикла, который используется для целей постобработки. На рисунке 9, модель переменной толщины стенки показывает повышенные перемещения и напряжения, нелинейно уменьшающиеся с увеличением симметрии. При фиксированной асимметрии нелинейное изменение максимального напряжения стенки, обусловленное исключительно неоднородным характером толщины стенки, является более значительным: 4-кратное увеличение для β = 1,0 и 4,7-кратное увеличение для β = 0,2. Эти результаты показывают, что независимо от местоположения переменная толщина стенки AAA, как предполагалось в этой работе, оказывает более значительное влияние на пиковое напряжение стенки, чем асимметричная форма самого мешка аневризмы при фиксированном максимальном поперечном диаметре. Дальнейшая проверка относительного веса этих двух переменных в прогнозировании риска разрыва АБА по FSI требуется для моделей, ориентированных на пациента.

Рис.9. Влияние асимметрии на смещение пика (а) и пиковое напряжение стенки (б).
Дата добавления: 2021-03-18; просмотров: 100; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
