Каждая реакция – по 0.5 баллов
Задача №9-1
1. Наиболее вероятно, что оксид ZO содержит 20% кислорода и 80% Z. Молярная масса оксида ZO: М(ZO) = Ar(O) / ω(O) = 16 / 0.2 = 80 г/моль, тогда
М(Z) = 80 – 16 = 64 г/моль – это медь Cu
Представим оксид Y как Э2Оn, где n - валентность элемента Э. Выразим атомную массу Э через n:
Мr (Э2Оn) = Ar(O)∙n / ω(О) = 16n / 0.4396 = 36.4n
Аr (Э) = (36.4n – 16n) / 2 = 10.2n
Перебором n от 1 до 8 получаем единственный разумный ответ при n = 5:
Аr (Э) = 10.2n = 51 г/моль – ванадий, тогда формула оксида V2O5.
Формулу минерала Х можно представить как CunFemSk
При обжиге минерала на воздухе вся сера переходит в сернистый газ, то есть n(S) = n(SO2) = V / VМ = 0.448 / 22.4 = 0.02 моль,
m (S) = M(S) × n(S) = 32 × 0.02 = 0.64 г
Тогда массовая доля серы в составе минерала
ω( S ) = m(S) / m(минерала) = 0.64 / 1.84 = 0.3478 или 34.78%
Массовая доля меди в составе минерала также равна 34.78%
ω(Fe) = 100 – 34.78×2 = 30.44%, тогда
n : m : k = (34.78 / 64) : (30.44 / 56) : (34.78 / 32) = 0.543 : 0.543 : 1.086 = 1 : 1 : 2, то есть простейшая формула минерала – CuFeS2
Данная формула также подтверждается составом твердого остатка после обжига: m(Fe2O3) = m(CuO) = 0.8 г
Итак, формулы искомых веществ:
Х = CuFeS 2
Y = V2O5
Z = Cu
ZO = CuO
Минерал Х называется халькопирит
2. Уравнения реакций:
4CuFeS2 + 13O2 = 4CuO + 2Fe2O3 + 8SO2 (t°)
Fe2O3 + 3C = 2Fe + 3CO (t°)
CuO + C = Cu + CO (t°)
2SO2 + O2 = 2SO3 (t°, V2O5)
SO3 + H2O = H2SO4
3. Исходное количество минерала:
n(CuFeS2) = m / M = 1000000 / 184 = 5434.78 моль
Из схемы CuFeS2 → Сu + Fe + 2H2SO4
получаем, что n(Cu)теор = n(Fe)теор = n(CuFeS2) = 5434.78 моль
n(Cu)практ = n(Fe)практ = n(CuFeS2) × η = 5434.78 × 0.8 = 4347.83 моль
|
|
|
m ( Cu )практ = n(Cu) × M(Cu) = 4347 × 64 = 278261 г = 278.26 кг
m ( Fe )практ = n(Fe) × M(Fe) = 4347 × 56 = 243478 г = 243.49 кг
n(H2SO4)практ = 2n(CuFeS2) × η = 2 × 5434.78 × 0.8 = 8695.6 моль
m(96% H2SO4) практ = n(H2SO4) × M(H2SO4) / ω(H2SO4) =
= 8695.6 × 98 / 0.96 = 887681 г = 887.68 кг
| № | Элемент ответа | Баллы |
| 1. | Расчет массовой доли серы Формулы веществ X , Y , Z , ZO Название минерала Х | 0.5 б 1×4 = 4 б 0.5 б |
| 2 | Уравнения реакций | 0.5×5 = 2.5 б |
| 3. | Расчет массы железа, Расчет масс металла Z и 96% серной кислоты | 0.5 б 1×2 = 2 б |
| Итого | 10 баллов |
Задача №9-2
1. Из кристаллической решетки видно, что сингония орторомбическая при этом из 12 атомов металла принадлежит элементарной ячейки 8 атомов, 4 в объеме и 4 из 8 атомов расположенных на двух гранях, итого 8 атомов.
Определим молекулярную массу по уравнению 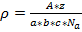 , где ρ-плотность, A-относительная атомная масса, z-количество атомов принадлежащих элементарной ячейке, a,b,c-геометрические параметры элементарной ячейки, Na-число Авогадро.
, где ρ-плотность, A-относительная атомная масса, z-количество атомов принадлежащих элементарной ячейке, a,b,c-геометрические параметры элементарной ячейки, Na-число Авогадро.
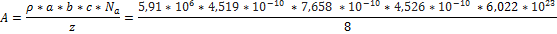
A = 69,68 что соответствует Галлию AGa = 69,723.
2. С кислотами окислителями алюминий не реагирует из-за окисления поверхности металла и образования плотной оксидной пленки, процесс называют пассивацией.
|
|
|
3. При прокаливании гидроксидов выделяется вода и образуется оксид. Массовая доля воды ω = 0,438 / 5 = 0,0876, молекулярная масса M = 18/0,0876 = 207,61 г/моль.
Исходя из уравнения Mex(OH)y = MexOy-z + zH2O составим таблицу:
| x y-z | 1 | 2 | 3 |
| 1 | 189,61 (Os) | 171,61 | 153,61 |
| 2 | 94,805 | 85,805 (Rb) | 76,805 (Ga) |
Только галлий из гидроксида при прокаливании дает оксид галлия III.
Метагидроксид галлия содержит 31,15 % кислорода, молекулярная масса на галлий и водород в зависимости от количества кислорода: 1O – 35,36, 2O – 70,72, 3O – 106,09 г/моль. Ближе всего к атомной массе галлия при 2 кислородах GaOOH метагидроксид галлия или метагаллиевая кислота HGaO2.
4. Уравнения реакций:
Ga + 6HNO3 = Ga(NO3)3 + 3NO2 +3H2O (уравнение 1)
Ga(NO3)3 + 3NaOH = Ga(OH)3 + 3NaNO3 (уравнение 2)
Ga(OH)3 = GaOOH + H2O (уравнение 3)
2GaOOH = Ga2O3 + H2O (уравнение 4)
Разбаловка
| Определение металла и расчет по параметрам кристаллической решетки | 1+1 = 2 б. |
| Описание процесса пассивации алюминия | 1 б. |
| Определение состава с расчетами | 3 б. |
| Написание уравнений реакций (1) – (4) | 4x1 = 4 б. |
| ИТОГО | 10 б. |
|
|
|
Задача №9-3
1) Определим металлы в растворе
Раствор 1:
Очевидно, что по описанию это свинец
Pb + H2SO4 → PbSO4↓ + H2 (3)
Pb2+ + H2S → PbS↓ + 2H+ (4)
PbS + 4H2O2 → PbSO4 + 4H2O (5)
Раствор 2:
Из описания можно сделать вывод, что это медь
Cu2+ + 2NH2CH2COOH → Cu(NH2CH2COO)2 + 2H+ (6)
Cu2+ + 2I- → CuI↓ + 0,5I2 (7)
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI (8)
2)
M + Pb2+ → M2+ + Pb (1)
M + Cu2+ → M2+ + Cu (2)
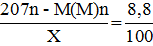
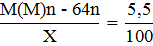
Откуда М(М) = 119 г/моль, что соответствует Sn
3)
SnO + 2H+ → Sn2+ + H2O (9)
SnO + 2 NaOH +H2O → Na2[Sn(OH)4] (10)
Ион [Sn(OH)3]-
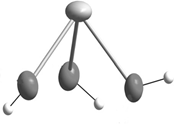
Геометрия – тетраэдр, пространственная форма треугольной пирамиды
Разбалловка
| Написаны уравнения (1)-(8). | 8×0,25б.=2б. |
| Написаны уравнения (9)-(10). | 2×1б.=2б. |
| Определен металл пластинки. | 4б. |
| Определена геометрия иона. | 2б. |
| Итого | 10б. |
Задача №9-4
1. Гидролиз тионилхлорида протекает по уравнению:
| SOCl2 + H2O = SO2 + 2 HCl | (1) |
2. Пропускание смеси SO2 + HCl через раствор Ba(OH)2 и H2O2 приводит к образованию осадка BaSO4 за счет окисления образующегося сульфита бария.
| Ba(OH)2 + H2O2 + SO2 = BaSO4 + 2 H2O | (2) |
Осадок Б – сульфат бария BaSO4, что подтверждается данными по массовой доле кислорода в этом соединении.
3. В ходе анализа образца на содержание воды образовалось 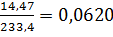 моль BaSO4. Из стехиометрии реакций следует, что в исходной навеске содержалось также 0,0620 моль воды или 0,0620·18,02 = 1,117 г H2O. Массовая доля воды в образце равна
моль BaSO4. Из стехиометрии реакций следует, что в исходной навеске содержалось также 0,0620 моль воды или 0,0620·18,02 = 1,117 г H2O. Массовая доля воды в образце равна 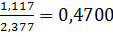 или 47,00%.
или 47,00%.
|
|
|
4. Образование осадка сульфата бария свидетельствует о том, что в состав соли входил анион, содержащий серу. Это могли быть сульфид-, сульфит-, сульфат-, тиосульфат-анион и другие, поскольку в системе присутствовал окислитель – пероксид водорода.
Образовалось 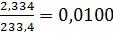 моль сульфата бария, следовательно в исходной навеске соли содержалось 0,0100 моль серы в составе некоторого аниона.
моль сульфата бария, следовательно в исходной навеске соли содержалось 0,0100 моль серы в составе некоторого аниона.
Ранее было найдено содержание воды в образце – 1,117 г.
Тогда в составе навески содержится 1,260 г соли, значит её молярная масса равна 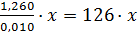 г/моль, где x – число атомов серы в формульной единице.
г/моль, где x – число атомов серы в формульной единице.
При x = 1 получаем М = 126 г/моль, что соответствует сульфиту натрия, следовательно в исходной навеске содержался кристаллогидрат Na2SO3·nH2O.
Массовая доля сульфита натрия в образце составляет 53,00%. Также должно выполняться соотношение: 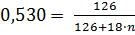 , откуда n = 6,20.
, откуда n = 6,20.
Таким образом, молекулярная формула соли Na2SO3·6,2 H2O.
Разбалловка
| Написание уравнений (1) – (2) | 2х1 б. = 2 б. |
| Определение осадка Б | 1 б. |
| Установление массовой доли воды в соединении А | 2 б. |
| Установление формулы сульфита натрия | 2,5 б. |
| Установление конечной формулы кристаллогидрата | 2,5 б. |
| ИТОГО | 10 б. |
Задача №9-5
1. Кирпичное окрашивание пламени – наличие в веществе катионов Ca2+. Образование желтого осадка в присутствии молибдата аммония – наличие фосфат-ионов в веществе, значит вещество А – фосфат кальция.
Стойкое вещество Б с высокой температурой плавления, которое подвержено действию фтора и плавиковой кислоты – диоксид кремния.
Вещество В – фосфор, поскольку при нагревании с восстановителем в виде кокса будет восстанавливаться фосфат-анион.
Вещество Г – монооксид углерода, дающий формиат натрия при нагреве с кристаллической щелочью.
Вещество Е – оксид кальция, вещество Д – силикат кальция.
Реакции:
| 2 Ca3(PO4)2 + 10 C + 6 SiO2 = 6 CaSiO3 + 10 CO + P4 | (1) |
| 2 Ca3(PO4)2 + 10 C = 6 CaO + 10 CO + P4 | (2) |
| Ca3(PO4)2 + 24 (NH4)2MoO4 + 48 HNO3 = 2 (NH4)3H4[P(Mo2O7)6] + 42 NH4NO3 + 20 H2O + 3 Ca(NO3)2 | (3) |
| SiO2 + 2 F2 = SiF4 + O2 | (4) |
| SiO2 + 6 HF = H2[SiF6] | (5) |
| CO + NaOH = HCOONa | (6) |
| CaO + SiO2 = CaSiO3 | (7) |
2. Запишем уравнение реакции 1:
2 Ca3(PO4)2(к) + 10 C(к) + 6 SiO2(к) = 6 CaSiO3(к) + 10 CO(г) + P4(к)
Рассчитаем Δ H реакции по закону Гесса:
Δ Hо298 = ΣΔ Hообр.298продуктов реакции – ΣΔ Hообр.298исходных веществ = 10Δ Hообр.298(CO(г)) + 6Δ Hообр.298(CaSiO3(к)) – 6Δ Hообр.298(SiO2(к)) – 2Δ Hообр.298(Ca3(PO4)2(к)) = – 10·110,50 – 6·1579 + 2·4119,10 + 6·903,50 = 3080 кДж·моль-1.
Рассчитаем Δ S реакции по закону Гесса:
Δ Sо298 = ΣΔ Sообр.298продуктов реакции – ΣΔ Sообр.298исходных веществ =
= 10Δ Sообр.298(CO(г)) + 6Δ Sообр.298(CaSiO3(к)) + Δ Sообр.298(P4(к)) – 6Δ Sообр.298(SiO2(к)) – 2Δ Sообр.298(Ca3(PO4)2(к)) – 10Δ Sообр.298(С(к)) = 10·197,54 + 6·87,45 + 1·41,09 – 6·46,86 – 2·236 – 10·5,74 = 1730,63 Дж·моль-1·K-1.
Точкой, после которой станет возможно самопроизвольное протекание процесса, является состояние, при котором Δ G = 0. Рассчитаем его:
Δ G = Δ H – TΔ S = 3 080 000 – T·1730,63=0
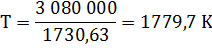
Таким образом, при температуре выше 1779,7 К возможно самопроизвольное протекание реакции 1.
Запишем уравнение реакции 2:
2 Ca3(PO4)2(к) + 10 C(к) = 6 CaO(к) + 10 CO(г) + P4(к)
Рассчитаем Δ H реакции по закону Гесса:
Δ Hо298 = ΣΔ Hообр.298продуктов реакции – ΣΔ Hообр.298исходных веществ = 10Δ Hообр.298(CO(г)) + 6Δ Hообр.298(CaO (к)) – 2Δ Hообр.298(Ca3(PO4)2(к)) = – 10·110,50 – 6·635,1 + 2·4119,10 = 3322,6 кДж·моль-1.
Рассчитаем Δ S реакции по закону Гесса:
Δ Sо298 = ΣΔ Sообр.298продуктов реакции – ΣΔ Sообр.298исходных веществ =
= 10Δ Sообр.298(CO(г)) + 6Δ Sообр.298(CaO(к)) + Δ Sообр.298(P4(к)) – 2Δ Sообр.298(Ca3(PO4)2(к)) – 10Δ Sообр.298(С(к)) = 10·197,54 + 6·38,1 + 1·41,09 – 2·236 – 10·5,74 = 1715,69 Дж·моль-1·K-1.
Точкой, после которой станет возможно самопроизвольное протекание процесса, является состояние, при котором Δ G = 0. Рассчитаем его:
Δ G = Δ H – TΔ S = 3 322 600 – T·1715,69=0
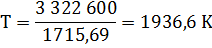
Таким образом, при температуре выше 1936,6 К возможно самопроизвольное протекание реакции 2.
3. Вероятно, экономически более выгодным способом является способ получения фосфора по реакции 1, поскольку он требует более низкой температуры, что способствует меньшим капитальным затратам при построении и проектировании установки. Более точное предположение построить трудно, поскольку мы обладаем недостаточной информацией о стоимости диоксида кремния и затратах на проведение процесса при более высокой температуре (разница в 157 К).
Разбалловка
| Определение веществ А–Е и доломита | 6х0,5 б. = 3 б. |
| Написание уравнений (1) – (7) | 7х0,5 б. = 3,5 б. |
| Расчет Δ H и Δ S для реакций 1 и 2, расчет температуры, при которой становится возможным самопроизвольное протекание процесса | 6х0,5 б. = 3 б. |
| Написание любого аргументированного решения в пользу реакции 1 или невозможности построить точное предположение. | 0,5 б. |
| ИТОГО | 10 б. |
Задания 10 класса
Представлен один из возможных вариантов решения заданий
Задача №10-1
1. При реакции карбоновых кислот с NaHCO3 выделяется углекислый газ, для одноосновных кислот n(кислоты) = n(СО2). Рассчитаем n(СО2) по уравнению Менделеева-Клапейрона:
n(СО2) = PV/(RT) = 98.658×3.83 / (8.314×303) = 0.15 моль
Таким образом, n(X) = 0.15 моль и М(Х) = 9 / 0.15 = 60 г/моль – данная молярная масса соответствует уксусной кислоте:
Брутто-формула Х: С2Н4О2
Структурная формула Х: 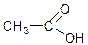
Реакция 1: СН3СООН + NaHCO3 = СН3СООNa + CO2↑ + Н2О
2. Реакция 2: СН3СООН ⇆ Н+ + СН3СОО-
К1 = 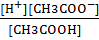
При С>>К получим К1 = [Н+]2 / С,
[Н+] = 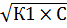 =
= 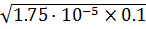 = 1.323·10-3 моль/л
= 1.323·10-3 моль/л
рН = -lg[Н+] = 2.88
3. При 120°С средняя молярная пара Х равна 4.034×29 = 117 г/моль, что почти вдвое больше молярной массы уксусной кислоты. Это наталкивает на мысль о димеризации Х. Действительно, в парах уксусная кислота образует димеры за счет прочных водородных связей (реакция 3):
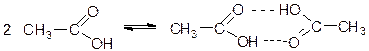
Обозначим за х мольную долю димера и рассчитаем состав равновесной смеси.
При 120°С: 120х + 60(1–х) = 117, х = 0.95, то есть смесь содержит 95% димера и 5% мономера.
При 230°С: 120х + 60(1–х) = 2.897×29 = 84, х = 0.4, то есть смесь содержит 40% димера и 60% мономера.
Если обозначить димер как Х2, то константа равновесия данной процесса: К = χ(Х2) / χ(Х)2
При 120°С: К2 = 0.95 / (0.05)2 = 380
При 230°С: К3 = 0.4 / (0.6)2 = 1.111
Если известны константы равновесия для двух температур, изменение энтальпии процесса можно найти по формуле:
ΔН = 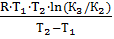 =
= 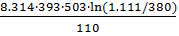 = – 87179 Дж = – 87.179 кДж
= – 87179 Дж = – 87.179 кДж
4. Структурные формулы:
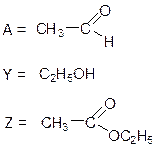
5. Реакция 4:
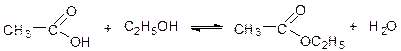
Значения ΔrH, ΔrS рассчитаем по следствию из закона Гесса:
ΔrH = –285.8 + (–469.5) – (–484.9) – (–277.6) = 7.2 кДж
ΔrS = 70 + 259 – 160.7 – 159.8 = 8.5 Дж/К
ΔrG = ΔrH – T×ΔrS = 7200 – 298×8.5 = 4667 Дж = 4.67 кДж
Константа равновесия:
lnK = – ΔrG / (RT) = –4667 / (8.314×298) = –1.884, К4 = 0.152
6. Исходная смесь содержит:
n(C2H5OH) = 100×0.8×0.96/46 = 1.67 моль
n(CH3COOH) = 200×1.07×0.8/60 = 2.85 моль
n(H2O) = (100×0.8×0.04 + 200×1.07×0.2) / 18 = 2.56 моль
Пусть, в состоянии равновесия образуется по х моль CH3COOС2Н5 и Н2О
Состав равновесной смеси:
n(C2H5OH) = 1.67 – х
n(CH3COOH) = 2.85 – х
n(CH3COOС2Н5) = х
n(Н2О) = 2.56 + х
К4 = х(2.56 + х) / (2.85 – х)(1.67 – х), откуда х = 0.21 моль
m(Z) = m(CH3COOС2Н5) = 0.21×88 = 18.48 г
| № | Элемент ответа | Баллы |
| 1. | Брутто-формула Х Структурная формула Х Уравнение реакции 1. | 0.5 б 0.5 б 0.5 б |
| 2 | Уравнение реакции 2 Выражение константы К1 рН 0.1 М водного раствора Х | 0.5 б 0.5 б 0.5 б |
| 3. | Уравнение реакции 3 Обьяснение про водородные связи Состав равновесных смесей (мол.%) при 120 и 230°С Значения К2 и К3 Изменение энтальпии (ΔrH) для реакции 3. | 0.5 б 0.5 б 0.5 б 0.5 б 0.5 б |
| 4. | Структурные формулы веществ A, Y, Z. | 0.5×3 = 1.5 б |
| 5. | Уравнение реакции 4 Значения ΔrH, ΔrS и ΔrG Значение K4. | 0.5 б 0.5×3 = 1.5 б 0.5 б |
| 6. | Масса Z | 0.5 б |
| Итого | 10 баллов |
Задача №10-2
1) Определим металлы в растворе
Раствор 1:
Очевидно, что по описанию это свинец
Pb + H2SO4 → PbSO4↓ + H2 (3)
Pb2+ + H2S → PbS↓ + 2H+ (4)
PbS + 4H2O2 → PbSO4 + 4H2O (5)
Раствор 2:
Из описания можно сделать вывод, что это медь
Cu2+ + 2NH2CH2COOH → Cu(NH2CH2COO)2 + 2H+ (6)
Cu2+ + 2I- → CuI↓ + 0,5I2 (7)
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI (8)
2)
M + Pb2+ → M2+ + Pb (1)
M + Cu2+ → M2+ + Cu (2)
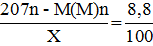
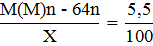
Откуда М(М) = 119 г/моль, что соответствует Sn
3)
SnO + 2H+ → Sn2+ + H2O (9)
SnO + 2 NaOH +H2O → Na2[Sn(OH)4] (10)
Ион [Sn(OH)3]-

Геометрия – тетраэдр, пространственная форма треугольной пирамиды
Разбалловка
| Написаны уравнения (1)-(8). | 8×0,25б.=2б. |
| Написаны уравнения (9)-(10). | 2×1б.=2б. |
| Определен металл пластинки. | 4б. |
| Определена геометрия иона. | 2б. |
| Итого | 10б. |
Задача №10-3
При хранении сульфид натрия окисляется кислородом воздуха до сульфата, тиосульфата и сульфита натрия. Таким образом, навеска может представлять собой смесь воды, сульфида натрия, сульфата натрия, сульфита натрия и тиосульфата натрия, о чем свидетельствуют проведенные реакции.
1. Na2S + 2HCl→ H2S + 2NaCl
2. Na2S2O3 + 2HCl → S↓ + SO2 + H2O + 2NaCl
3. Na2SO3 + 2HCl → SO2 + H2O + 2NaCl
4. Na2SO4 + HCl → не идет
5. SO2 + H2S + 2Ba(OH)2 → BaSO3↓ + BaS + 3H2O
6. Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Из реакций 1-4 становится ясно, что желтый осадок – сера, образующаяся из тиосульфата натрия.
n(Na2S2O3) = n(S) = m(S)/M(S) = 1.114/32 = 0.03481 моль
В подкисленном растворе, оставшемся после фильтрования возможно осадить только сульфат-ионы.
n(NaSO4) = n(BaSO4) = m(BaSO4)/M(BaSO4) = 4.101/233 = 0.0176 моль
А осадок, образующийся из смеси газов после пропускания их через гидроксид бария – BaSO3. Таким образом:
n(SO2)=n(BaSO3)=m(BaSO3)/M=13.910/217=0.0641 моль
SO2 мог образоваться только из тиосульфат- или сульфит-ионов, содержащихся в смеси. Видим, что n(SO2)≠n(Na2S2O3), а значит сульфит-ионы в растворе присутствуют.
n(SO32-) = n(SO2) - n(Na2S2O3) = 0,0641 – 0,03481 = 0.02929 моль
m(Na2S2O3) = n(Na2S2O3)·M=0.03481·158=5.5004 г
m(Na2SO3) = n(Na2SO3)·M=0.02929·126=3,6905 г
m(Na2SO4) = n(Na2SO4)·M=0.0176·142·=2,4993 г
m(H2O)=m(навески)·ω(H2O)=20·0.0754/0.4558=3,3085 г
m(Na2S) = 20-3,3085-5.5004-2.4993-3,6905=5.0013 г
ω(Na2S2O3) = 5.5004/20 = 27,5%
ω(Na2SO3) = 3,6905/20 = 18,45%
ω (Na2S) = 5,0013/20 = 25%
ω (Na2SO4) = 2,4993/20 = 12.5%
ω (H2O) =16,55%
Разбалловка
| Написание реакций 1-3,5,6 | 5*1=5б. |
| За предположение о наличии S2O32- , SO32- и SO42- | 3*0,5=1,5б. |
| Определение массовых долей веществ, составляющих смесь | 5*0,7=3,5б. |
| ИТОГО | 10б. |
Задача №10-4
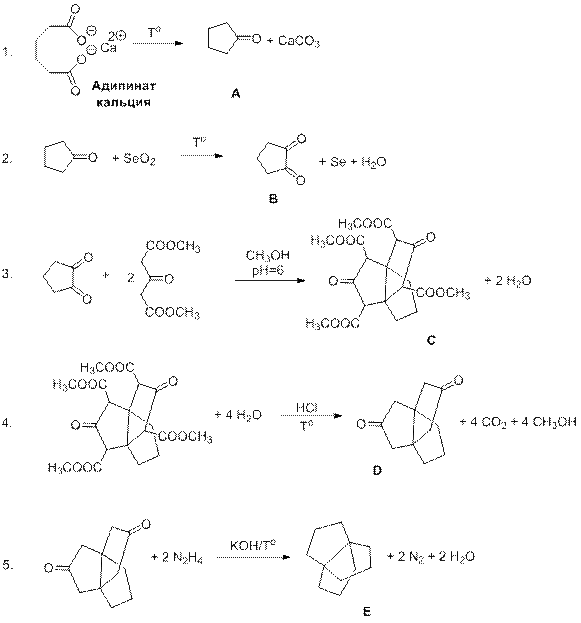
Разбалловка:
| Написание уравнений 1-5 | 5·2=10б |
| ИТОГО | 10б |
Задача №10-5
1) Определим формулу простого вещества
p = x ⋅ p*
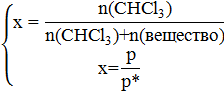
n(CHCl3) = 100/119,5 = 0,8368 моль
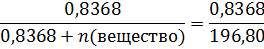
n(вещество) = 0,0106 моль
М(вещество) = 27/0,0106 = 254,7 г/моль
254,7/2 = 127,35 – это I2
254,7/4 = 63,68 – Cu4 не существует
254,7/8 = 31,84 – S8 не подходит условию
Значит простое вещество – йод I2
2)
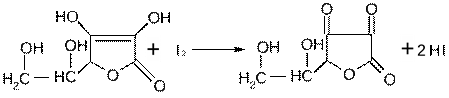
Очевидно, что бинарное вещество KI
19+53=72
Cu2+ + 3I- - e- = CuI↓ + I2
2Na2S2O3 + I2 = Na2S4O6 + 2NaI
3) Возгонка – переход вещества из твердого состояния в газообразное.
Сорбенты: активированный уголь, пористый оксид алюминия, силикагель и др. (Балл ставится при упоминании хотя бы одного сорбента)
4)
KI + I2 = KI3
Йод в воде коричневый
Йод в хлороформе фиолетовый
Разбалловка
| Найдено количество вещества хлороформа; Найдено количество неизвестного вещества; Определена молекулярная масса простого вещества; Определено вещества Х. | 1б. 1б. 1б. 2б. |
| Написаны уравнения реакций (1)-(2). | 2×1б.=2б. |
| Написаны уравнения реакций (3)-(4). | 2×0,5б.=1б. |
| Верно интерпретировано понятие возгонки; Приведен хотя бы 1 разумный сорбент. | 0,5б. 0,5б. |
| Верно написаны цвета растворов Х в воде и хлороформе. | 1б. |
| Итого | 10б. |
Задания 11 класса
Представлен один из возможных вариантов решения заданий
Задача №11-1
1) AxBy
Допустим, что растворяется металл А
AxBy + 2xH2O → xA(OH)2 + xH2 + yB
2H2 + O2 → 2H2O
n(O2) = (16⋅0,21)/22,4 = 0,15 моль, тогда n(Н2) = 0,3 моль, следовательно n(A) = 0,3 моль
2)
A(OH)2 + 2HNO3 → 2H2O + A(NO3)2
B + 6HNO3(конц.) → B(NO3)3 + 3 H2O + 3NO2
B(NO3)3 + zH2O → B(NO3)3⋅zH2O
B(NO3)3⋅zH2O → B(NO3)3 + zH2O
n(H2O) = (60,9362 – 60,7506)/18 = 0,01031 моль
m(B(NO3)3) = 0,8144 г
n(B(NO3)3) = m/M = 0,8144/(M(B) + 186)
(z⋅0,8144)/(M(B) + 186) = 0,01031
Откуда M(B) = z⋅78,9913 – 186,0039
z = 1 …
…
z = 5, M(B) = 209 г/моль, что соответствует Bi
n(Bi(NO3)3⋅5H2O) = 97/485 = 0,2 моль
3)
n(A) = 0,3 моль
n(B) = 0,2 моль
Следовательно A3B2, n(A3B2) = 0,1 моль
M(A3B2) = 53,800/0,1 = 538 г/моль
3x +2⋅209 = 538 г/моль, значит x = 40 г/моль, что соответствует Ca
Ответ: Ca3Bi2
Разбалловка
| Написана схема реакции растворения части сплава в воде. | 1б. |
| Рассчитано количество вещества выделившегося водорода. | 1б. |
| Найдено количество вещества А. | 1б. |
| Написаны схемы реакций растворения В в азотной кислоте и получения кристаллогидрата. | 2×0,5б.=1б. |
| Определен Bi. | 2б. |
| Найдено количество вещества кристаллогидрата. | 1б. |
| Вывод о стехиометрической формуле сплава. | 1б. |
| Определен Са. | 2б. |
| Итого | 10б. |
Задача №11-2
| № | Элемент ответа (допускаются иные формулировки и способы решения, удовлетворяющие условию задачи) | Баллы |
| 1. | Основным газообразным продуктом окисления органических веществ является углекислый газ, поэтому, А – СО2 (М = 44 г/моль). Значение молярной массы можно подтвердить расчетом эквимолярной смеси с водородом:
М(смеси) = ½(М(СО2) + М(Н2)) = (44 + 2) / 2 = 23 г/моль
ρ(смеси) = М / Vm = 23 / 22,4 = 1.027 г/л
Молярную массу 44 г/моль также имеют: пропан (C3H8), оксид азота (I) (N2O) и этиленоксид (оксиран, С2Н4О, ω(О) = 16 / 44 = 36.36%).
Из условия задачи следует, что
А – СО2 – углекислый газ или оксид углерода (IV),
Б – C 3 H 8 - пропан,
В – N 2 O - оксид азота (I), оксид диазота
Г – С2Н4О 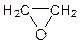 этиленоксид, эпоксид или оксиран, этиленоксид, эпоксид или оксиран,
| Формулы по 0.5 б структурная формула Г - 0.5 б названия по 0.25 б, всего 3.5б |
| 2. | Х - углерод С, а Y - кислород О. Электронные конфигурации атомов этих химических элементов: С(+6) 1s22s22p2 О(+8) 1s22s22p4 По периоду ПСХЭ слева направо происходит уменьшение радиусов атомов, следовательно, у углерода, расположенного левее кислорода, радиус атома больше. С уменьшением радиуса атома происходит увеличение электроотрицательности и усиление неметаллических свойств. Поэтому у кислорода, расположенного правее в периоде ПСХЭ, неметаллические свойства выражены сильнее. | Элементы Х и Y по 0.5 б, всего 1 б Конфигурации по 0.5 б, всего 1 б 0.5 б |
| 3 | Лабораторный способ получения оксида азота (I):
NH4NO2 = N2O + 2H2O (при нагревании) или
NH4Cl + NaNO2 = N2O + NaCl + 2H2O (при нагревании)
Промышленный способ получения этиленоксида:
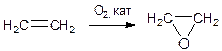
| 0.5 б 0.5 б |
| 4. | Реакция 1: С3Н8 + 5О2 = 3СО2 + 4Н2О Реакция 2: С3Н8 + 10N2О = 3СО2 + 4Н2О + 10N2 Реакция 3: 2N2О = 2N2 + O2 n(С3Н8) = m / M = 6.6 / 44 = 0.15 моль, тогда тепловой эффект реакции 1: Q1 = 332.85 / 0.15 = 2219 кДж тепловой эффект реакции 2: Q2 = 455.85 / 0.15 = 3039 кДж Термохимические уравнения: Реакция 1: С3Н8 + 5О2 = 3СО2 + 4Н2О + 2219 кДж Реакция 2: С3Н8 + 10N2О = 3СО2 + 4Н2О + 10N2 + 3039 кДж | 0.5 б 0.5 б 0.5 б Каждый тепловой эффект по 0.5 б, всего 1 б. |
| 5. | Если вычесть из уравнения 2 уравнение 1, получим: 10N2О = 10N2 + 5O2 Q = 3039 – 2219 = 820 кДж, тогда на 2 моль N2О тепловой эффект = 820 / 5 = 164 кДж/моль Реакция 3: 2N2О = 2N2 + O2 + 164 кДж | 0.5 б |
| Итого | 10 баллов |
Задача №11-3
1.
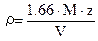 , где r – плотность кристаллического вещества, г/см3; M – молярная масса вещества, г/моль; Z – число формульных единиц, содержащихся в одной элементарной ячейке; V – объем элементарной ячейки, Å3. По описанию понятно, что оксид – MO2, Z = 4, тогда молярная масса оксида » 269.09, что соответствует M = Np. 1.5 балла. Указание на Np без расчета – 0.5 балла
, где r – плотность кристаллического вещества, г/см3; M – молярная масса вещества, г/моль; Z – число формульных единиц, содержащихся в одной элементарной ячейке; V – объем элементарной ячейки, Å3. По описанию понятно, что оксид – MO2, Z = 4, тогда молярная масса оксида » 269.09, что соответствует M = Np. 1.5 балла. Указание на Np без расчета – 0.5 балла
2. Без учета катион-катионных взаимодействий наиболее близкое к 18 значение реализуется в комплексе [NpO2(H2O)5] (2 + 3.41∙2 + 1.81∙5 = 17.87), КЧ = 7
Расчет – 0.5 балла
Формула – 0.5 балла
КЧ – 0.5 балла
3. C учетом катион-катионных взаимодействий одного атома кислорода: наиболее устойчив комплекс [NpO2(H2O)4]+ (2 + 3.41∙2 + 1.81∙4 + 1.93∙1 = 17.99), КЧ = 7
Расчет – 0.5 балла
Формула – 1 балл
КЧ – 1 балл
Проявление катион-катионного взаимодействия приводит к тому, что один из кислородов катиона NpO2+ становится “мостиковым”, т.е. принадлежит атому Np на ½, но одновременно в экваториальной плоскости появляется “мостиковый” кислород от соседнего катиона NpO2+, в связи с чем “состав” катиона не изменяется, но КЧ повышается до 7, что напрямую не видно из формулы [NpO2(H2O)4]+.
4. C учетом катион-катионных взаимодействий двух атома кислорода: наиболее устойчив комплекс [NpO2(H2O)3]+ (2 + 3.41∙2 + 1.81∙3 + 1.93∙2 = 18.11), КЧ = 7
Расчет – 0.5 балла
Формула – 1 балл
КЧ – 1 балл
Проявление катион-катионного взаимодействия приводит к тому, что оба из кислорода катиона NpO2+ становятся “мостиковым”, т.е. принадлежат атому Np на ½, но одновременно в экваториальной плоскости появляется два “мостиковых” кислорода от соседних катионов NpO2+, в связи с чем “состав” катиона не изменяется, но КЧ повышается до 7, что напрямую не видно из формулы [NpO2(H2O)3]+.
Каждая реакция – по 0.5 баллов
5. Np(C2O4)2 + O2 = NpO2 + 4CO2
6. 2NpO2(OH)2 = Np2O5 + 1/2O2 + 2H2O
7. 9(NH4)2Np2O7 = 2N2 + 14NH3 + 6Np3O8 + 15H2O
8. Np3O8 + 4HClO4 = 2NpO2ClO4 + NpO2(ClO4)2 + 2H2O
Задача №11-4
При определении веществ А’ и B’ необходимо применить формулы расчета по брутто-формуле. В цепочке можно заметить использование двух молекул фталимида калия, а значит используются дибромпроизводные.
CnH2nBr2 – общая формула соединений А’ и B’.
2·80/(14n+2·80) = 0.741
2·80/(14n+2·80) = 0.696
n=4
n=5
 [V1]
[V1]
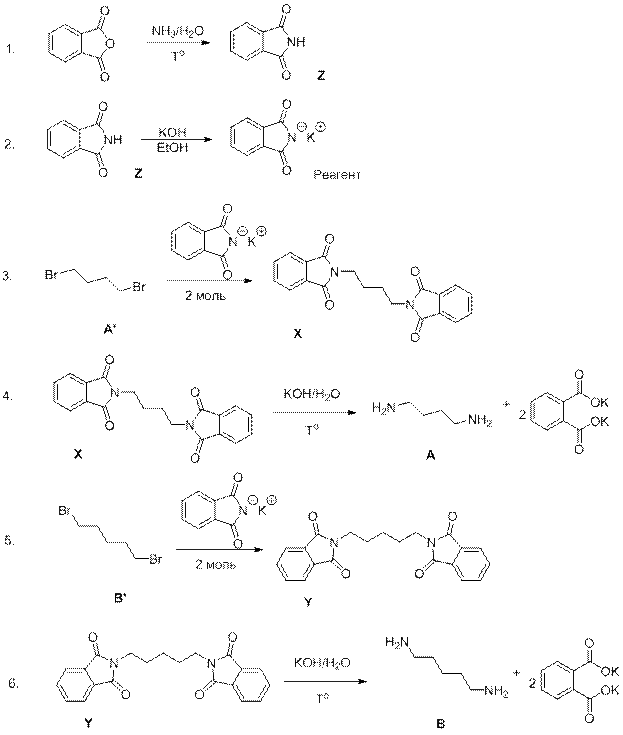
В реакциях, проведенных Дмитрием происходит постадийное образование солей между аммиаком (амином) и галогеналканом и дальнейшее образование первичного, вторичного или третичного амина. Таким образом в его реакторе образовывались (в т.ч. полимерные):
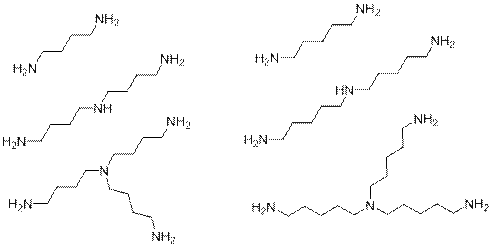
Разбалловка:
| Написание реакций 1 – 6 | 6·1=6б. |
| Установление формул A’ и B’ | 2·1=2б. |
| Написание побочных продуктов или описание реакции с объяснением получаемых побочных продуктов | 2б. |
| Итого | 10б. |
Задача №11-5
1. Основной компонент природного газа – метан или CH4.
| CH4 + H2O = 3 H2 + CO | (1) |
| CH4 + CO2 = 2 H2 + 2 CO | (2) |
Вещество А – СH4, метан,
Вещество B – СO, оксид углерода (II),
Вещество C – H2, водород.
Смесь веществ B и C – синтез-газ.
2. Поскольку вещество IV имеет меньшую температуру кипения, чем вещество V, то можно утверждать, что оно имеет разветвленное строение, а вещество V соответственно линейное. Таким образом, вещество V – бутанол-1, вещество IV – 2-метилпропанол-1 или изобутанол, соответственно вещество D – бутаналь, вещество D' – изобутаналь. Вещество E – продукт альдольной конденсации бутаналя, 3-гидрокси-2-этилгексаналь. При нагревании вещества E отщепляется вода, что составляет 12,5% массы, и образуется вещество F – 2-этилгекс-2-еналь. Далее происходит восстановление двойной связи и образование вещества G – 2-этилгексаналя, который окисляется в вещество I – 2-этилгексановую кислоту. При получении вещества H происходит восстановление двойной связи и альдегидной группы с образованием 2-этилгексанола.
Определим вещество J по продуктам горения. Из количеств веществ элементов в этих соединениях сможем посчитать простейшую формулу вещества А.
| Углерод | Водород | Кислород | |
| Масса/объем соединений после сжигания | 0,3584 л (CO2) | 0,108 г (H2O) | Посчитаем чуть позже |
| Количество в-ва продуктов | 0,016 моль (CO2) | 0,006 моль (H2O) | |
| Количество в-ва элементов | 0,016 моль (C) | 0,012 моль (H) | |
| Масса элемента | 0,192 г | 0,012 г | 0,128 г |
| Количество в-ва элементов | 0,016 моль (C) | 0,012 моль (H) | 0,008 моль |
| Соотношение | 4 | 3 | 2 |
Предварительный простейший состав описывается формулой C4H3O2. Поскольку при такой формуле тяжело нарисовать искомую формулу, а также проблематично вступление 2-этилгексанола в реакцию в двукратном избытке, поэтому умножим на два и запишем новую формулу C8H6O4. Условия данных по протонному ЯМР-спектру ограничивают выбор только терефталевой кислотой в качестве вещества J. Соответственно вещество III это бис(2-этилгексил)терефталат. Вещество M можно получить окислением нафталина, также оно является производным одного из изомеров терефталевой кислоты, по этим данным можно решить, что M – фталевый ангидрид.
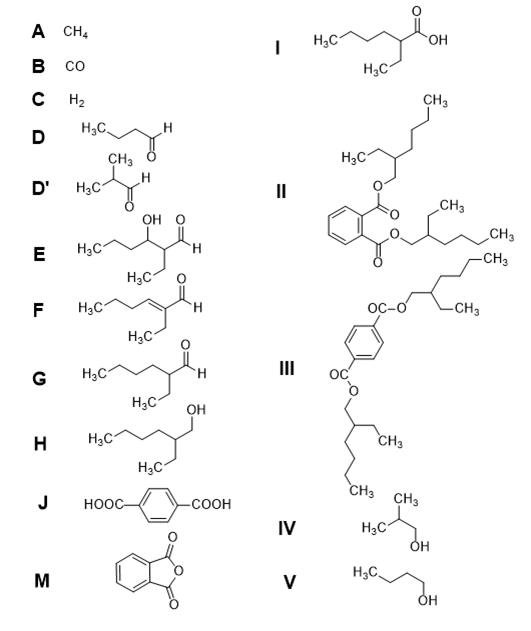
3. Вещества I, B, C известны из условий задачи ранее, судя по подсказке про правило 18 электронов и 2-этилгексановую кислоту в качестве второго продукта, вещество K – комплекс металла с оксидом углерода (II) в качестве лигандов.
Посчитаем массу металла из массовой доли:
Массовая доля CO – 65,54%, металла – 34,46%, тогда 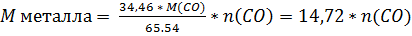 , для n=4 подходит Co. Таким образом простейшая формула комплекса – (Co(CO)4)n, однако n=1 не соответствует правилу 18 электронов, поскольку у кобальта электронная конфигурация 3d7 4s2, 4 лиганда CO дает ещё 8, итого 17 электронов. При удвоении кобальт может образовать связь Co-Co и дополнить уровень до 18 электронов.
, для n=4 подходит Co. Таким образом простейшая формула комплекса – (Co(CO)4)n, однако n=1 не соответствует правилу 18 электронов, поскольку у кобальта электронная конфигурация 3d7 4s2, 4 лиганда CO дает ещё 8, итого 17 электронов. При удвоении кобальт может образовать связь Co-Co и дополнить уровень до 18 электронов.
Вещество K – Co2(CO)8, октокарбонилдикобальт, L – HCo(CO)4, тетракарбонилкобальтовая кислота.
Разбалловка
| Написание уравнений реакций (1) – (2) | 2х0,25 б. = 0,5 б. |
| Название смеси веществ B и C | 0,5 б. |
| Написание названий веществ A–H, J–M, I–V | 18х0,25 б. = 4,5 б. |
| Написание формул веществ A–H, J–M, I–V | 18х0,25 б. = 4,5 б. |
| ИТОГО | 10 б. |
[V1]Совсем неочевидно, что молекулы неразветвленные. Запах у всех изомеров будет вполне себе мерзкий.
При проверке стоит засчитывать детям любые изомеры, где атомы галогена находится при первичных атомах углерода (со вторичными галогенидами реакция Габриэля (с фталмидом калия) обычно не проводится): 1,3-дибром-2-метилпропан (A’) и 1,3-дибром-2,2-диметилпропан или ): 1,3-дибром-2-метилбутан (B’)
Дата добавления: 2021-03-18; просмотров: 44; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
