Каталитическое карбонилирование метанола
Уксусная кислота
| Уксусная кислота | |
|
| |
|
| |
| Общие | |
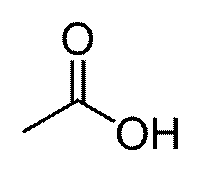
| Химическая формула | CH3COOH |
| Физические свойства | |
| Состояние (ст. усл.) | бесцветная жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура плавления | 16,75 °C |
| Температура кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Молярная теплоёмкость (ст. усл.) | 123,4 Дж/(моль·К) |
| Энтальпия образования (ст. усл.) | −487 кДж/моль |
| Химические свойства | |
| pKa | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
У́ксусная кислота (эта́новая кислота) — органическое вещество с формулой CH3COOH. Слабая, предельная одноосно́вная карбоновая кислота. Производные уксусной кислоты носят название «ацетаты».
История
Уксус является продуктом брожения вина и известен человеку с давних времен.
Первое упоминание о практическом применении уксусной кислоты относится к третьему веку до н. э. Греческий ученый Теофраст впервые описал действие уксуса на металлы, приводящее к образованию некоторых используемых в искусстве пигментов. Уксус применялся для получения «свинцовых белил», а также ярь-медянки (зелёной смеси солей меди, содержащей помимо всего ацетат меди).
В Древнем Риме готовили специально прокисшее вино в свинцовых горшках. В результате получался очень сладкий напиток, который называли «сапа». «Сапа» содержала большое количество ацетата свинца — очень сладкого вещества, которое также называют «свинцовым сахаром» или «сахаром Сатурна». Высокая популярность «сапы» была причиной хронического отравления свинцом, распространенного среди римской аристократии.[1]
|
|
|
В VIII веке арабский алхимик Джабир ибн Хайян впервые получил концентрированную уксусную кислоту путем перегонки.
Во времена Эпохи Возрождения уксусную кислоту получали путём возгонки ацетатов некоторых металлов (чаще всего использовался ацетат меди (II)) (при сухой перегонке ацетатов металлов получается ацетон, вполне промышленный способ до середины 20 века).
Свойства уксусной кислоты меняются в зависимости от содержания в ней воды. В связи с этим многие века химики ошибочно считали, что кислота из вина и кислота из ацетатов на самом деле являются двумя разными веществами. Идентичность веществ, полученных различными способами, была показана немецким алхимиком XVI века Андреа Либавиусом (нем. Andreas Libavius) и французским химиком Пьером Августом Адэ (фр. Pierre Auguste Adet)[1].

Завод, производящий уксусную кислоту. 1884 год.
В 1847 году немецкий химик Адольф Кольбе впервые синтезировал уксусную кислоту из неорганических материалов. Последовательность превращений включала в себя хлорированиесероуглерода до тетрахлорметана с последующим пиролизом до тетрахлорэтилена. Дальнейшее хлорирование в воде привело к трихлоруксусной кислоте, которая после электролитического восстановления превратилась в уксусную кислоту.[2]
|
|
|
В конце XIX — начале XX века большую часть уксусной кислоты получали перегонкой древесины. Основным производителем уксусной кислоты являлась Германия. В 1910 году ею было произведено более 10 тыс. тонн кислоты, причем около 30 % этого количества было израсходовано на производство красителя индиго.[1][3]
Закрыть этот раздел

Ледяная уксусная кислота
Уксусная кислота представляет собой бесцветную жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Смешивается со многимирастворителями; в уксусной кислоте хорошо растворимы неорганические соединения и газы, такие как HF, HCl, HBr, HI и другие. Существует в виде циклических и линейных димеров[4].
Абсолютная уксусная кислота называется ледяной, ибо при замерзании образует льдовидную массу (см. изображение справа).
|
|
|
§ Давление паров (в мм. рт. ст.):
§ 10 (17,1 °C)
§ 40 (42,4 °C)
§ 100 (62,2 °C)
§ 400 (98,1 °C)
§ 560 (109 °C)
§ 1520 (143,5 °C)
§ 3800 (180,3 °C)
§ Диэлектрическая проницаемость: 6,15 (20 °C)
§ Динамическая вязкость жидкостей и газов (в мПа·с): 1,155 (25,2 °C); 0,79 (50 °C)
§ Поверхностное натяжение: 27,8 мН/м (20 °C)
§ Удельная теплоемкость при постоянном давлении: 2,01 Дж/г·K (17 °C)
§ Стандартная энергия Гиббса образования Δ f G 0 (298 К, кДж/моль): −392,5 (ж)
§ Стандартная энтропия образования Δ f S 0 (298 К, Дж/моль·K): 159,8 (ж)
§ Энтальпия плавления ΔH пл: 11,53 кДж/моль
§ Температура вспышки в воздухе: 38 °C
§ Температура самовоспламенения на воздухе: 454 °C
§ Теплота сгорания: 876,1 кДж/моль
Уксусная кислота образует двойные азеотропные смеси со следующими веществами.
| Вещество | t кип , °C | массовая доля уксусной кислоты |
| четыреххлористый углерод | 76,5 | 3 % |
| циклогексан | 81,8 | 6,3 % |
| бензол | 88,05 | 2 % |
| толуол | 104,9 | 34 % |
| гептан | 91,9 | 33 % |
| трихлорэтилен | 86,5 | 4 % |
| этилбензол | 114,65 | 66 % |
| о-ксилол | 116 | 76 % |
| п-ксилол | 115,25 | 72 % |
| бромоформ | 118 | 83 % |
§
§ Уксусная кислота образует тройные азеотропные смеси
§ с водой и бензолом (t кип 88 °C);
§ с водой и бутилацетатом (t кип 89 °C).
Закрыть этот раздел
Получение
§ Уксусную кислоту можно получить окислением ацетальдегида кислородом воздуха. Процесс проводят в присутствии катализатора — ацетата марганца (II) Mn(CH3COO)2 при температуре 50-60 °С:
|
|
|
2 CH3CHO + O2 → 2 CH3COOH
В промышленности
Окислительные методы
Ранними промышленными методами получения уксусной кислоты были окисление ацетальдегида и бутана[5].
Ацетальдегид окислялся в присутствии ацетата марганца (II) при повышенной температуре и давлении. Выход уксусной кислоты составлял около 95 %.
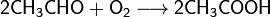
Окисление н-бутана проводилось при температуре 150—200 °C и давлении 150 атм. Катализатором этого процесса являлся ацетат кобальта.
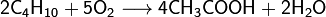
Оба метода базировались на окислении продуктов крекинга нефти. В результате повышения цен на нефть оба метода стали экономически невыгодными, и были вытеснены более совершенными каталитическими процессами карбонилирования метанола[5].
Каталитическое карбонилирование метанола
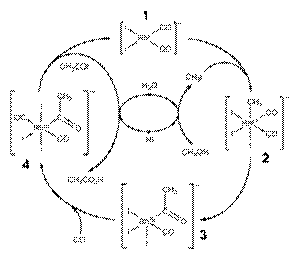
Каталитическая схема процесса фирмы Monsanto
Важным способом промышленного синтеза уксусной кислоты является каталитическое карбонилирование метанола моноксидом углерода[6], которое происходит по формальному уравнению:
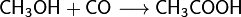
Реакция карбонилирования метанола была открыта учеными фирмы BASF в 1913 году. В 1960 году эта компания запустила первый завод, производящий уксусную кислоту этим методом.[7]Катализатором превращения служил йодид кобальта.
Усовершенствованная реакция синтеза уксусной кислоты карбонилированием метанола была внедрена исследователями фирмы Monsanto в 1970 году.[8][9] Это гомогенный процесс, в котором используются соли родия в качестве катализаторов, а также йодид-ионы в качестве промоторов. Важной особенностью метода является большая скорость, а также высокая селективность (99 % по метанолу и 90 % по CO).[5]
Этим способом получают чуть более 50 % всей промышленной уксусной кислоты.[10]
В процессе фирмы BP в качестве катализаторов используются соединения иридия.
Дата добавления: 2021-03-18; просмотров: 140; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!