Угольная кислота. Карбонаты. Жёсткость воды
Оксиды углерода
Углерод образует два оксида: оксид углерода (II) – CO и оксид углерода (IV) – CO2. Сравним свойства этих оксидов. Оксид углерода (II) или угарный газ является бесцветным газом, он не имеет запаха, малорастворим в воде. Ядовит. Температура плавления -205 0C. При дыхании он попадает в кровь и соединяясь с гемоглобином крови образует соединение – карбоксигемоглобин, которое не даёт гемоглобину переносить кислород. При вдыхании воздуха, в котором содержится одна десятая процента угарного газа, человек может потерять сознание и умереть. Угарный газ образуется при неполном сгорании топлива.

СО – несолеобразующий оксид. Он обладает восстановительными свойствами, так как углерод здесь находится в промежуточной степени окисления +2.
Оксид углерода два горит в кислороде с образованием оксида углерода (IV).
В этой реакции углерод повышает свою степень окисления с +2 до +4, а кислород понижает с 0 до -2. Поэтому углерод является восстановителем, а кислород окислителем. В этой реакции каждый атом углерода отдаёт по два электрона молекуле кислорода.
2С0 + О2 0(нед) = 2С+2О-2
Кроме этого, оксид углерода (II) восстанавливает металлы из их оксидов. Например, в реакции оксида железа (III) с оксидом углерода (II), СО отнимает кислород от железа, при этом образуется железо и углекислый газ.
Fe2+3O3 + 3C+2O = 2Fe0 + 3C+4O2↑
В этой реакции железо понижает свою степень окисления с +3 до 0, а углерод повышает с +2 до +4, при этом каждый атом углерода отдаёт по два электрона атомам железа. Углерод выступает в роли восстановителя, а железо в роли окислителя.
|
|
|
Оксид углерода (IV) – СО2 – углекислый газ не имеет запаха, бесцветный, в полтора раза тяжелее воздуха, при обычных условиях в одном объёме воды растворяется один объём углекислого газа. При давлении около шестидесяти атмосфер углекислый газ превращается в бесцветную жидкость. При испарении этой жидкости получается снегообразная масса, которую называют «сухой лёд», используемый для хранения пищевых продуктов. В больших количествах он вызывает удушье. Углекислый газ не горит и не поддерживает горение.


Оксид углерода (IV) – кислотный оксид. Он реагирует со щелочами. Например, в реакции с известковой водой (Ca(OH)2), известковая вода мутнеет, потому что образуется соль – карбонат кальция (CaCO3). Эта реакция является качественной реакцией на углекислый газ.
CO2 + Ca(OH)2 = CaCO3↓ + H2O

Оксид углерода (IV) взаимодействует и с основными оксидами. Например, в реакции с оксидом магния (MgO) образуется соль – карбонат магния (MgCO3).
CO2 + MgO = MgCO3
При растворении углекислого газа в воде образуется слабая неустойчивая угольная кислота (H2CO3).
|
|
|
CO2 + H2O ↔ H2CO3
Углекислый газ не горит, но магний продолжает гореть в углекислом газе с образованием оксида магния и выделением углерода в виде сажи (C).
CO2 + 2Mg = 2MgO + C
В промышленности углекислый газ получают обжигом известняка (CaCO3):CaCO3 = CaO + CO2↑ (t)
В лаборатории углекислый газ получают действием соляной кислоты (HCl) на карбонат кальция (CaCO3):
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O

Углекислый газ используют для изготовления шипучих напитков и получения соды, для создания «дыма» на сцене, для хранения мороженого, в пенных огнетушителях.





Сравнительна таблица оксидов углерода

Угольная кислота. Карбонаты. Жёсткость воды
Угольная кислота образуется при растворении оксида углерода (IV) в воде. Эта кислота нестойкая и почти сразу распадается на исходные вещества – углекислый газ и воду.
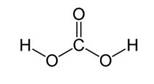

Получим угольную кислоту и исследуем её свойства. Собрав прибор для получения газов и проверив его на герметичность, следует поместить в пробирку кусочки мрамора и прилить соляной кислоты. После чего мы можем наблюдать выделение газа, который следует пропустить через воду с лакмусом. При этом видно, что лакмус изменил окраску с фиолетовой на красную. Но через некоторое время лакмус опять меняет свою окраску с красной на фиолетовую, потому что образовавшаяся угольная кислота является нестойкой и через некоторое время распадается на исходные вещества – углекислый газ и воду.
|
|
|
 СО2 + Н2О ↔ Н2СО3
СО2 + Н2О ↔ Н2СО3
Как двухосновная кислота угольная кислота диссоциирует по двум ступеням: на первой ступени образуется ион водорода и гидрокарбонат-ион, а на второй – ион водорода и карбонат-ион:
Н2CO3 ↔ H+ + HCO3-
HCO3- ↔ H+ + CO32-
Угольная кислота образует два типа солей: средние – карбоната и кислые – гидрокарбонаты. Например, CaCO3 – карбонат кальция, Ca(HCO3)2 – гидрокарбонат кальция. Из карбонатов в воде растворимы только соли калия, натрия и аммония. Карбонаты других металлов нерастворимы в воде и при нагревании разлагаются на оксид металла и углекислый газ. При разложение карбоната магния образуется оксид магния и углекислый газ, а при разложении карбоната кальция образуется оксид кальция и углекислый газ. При нагревании карбоната аммония образуется аммиак, вода и углекислый газ.
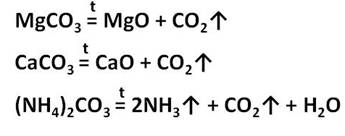
Кислые соли растворимы в воде.
Карбонаты могут превращаться в гидрокарбонаты: если через них пропустить углекислый газ в присутствии воды. Например, если через известковую воду пропускать углекислый газ, то сначала известковая вода мутнеет, вследствие образования карбоната кальция, но при дальнейшем пропускании углекислого газа помутнение исчезает, потому что карбонат переходит в гидрокарбонат.
|
|
|

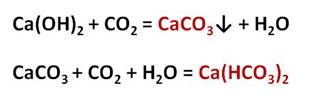
Наличием гидрокарбонатов кальция и магния в природной воде объясняется её временная жёсткость. В жёсткой воде плохо мылится мыло, трудно стирать бельё, плохо развариваются овощи. Если нагреть растворимый гидрокарбонат кальция, то образуется снова карбонат кальция – нерастворимая в воде соль.


Эта реакция приводит к образованию накипи на стенках котлов, чайников, труб парового отопления. В природе в результате этой реакции в пещерах формируются свисающие вниз сталактиты, навстречу которым снизу вырастают сталагмиты.




Другие соли кальция и магния, такие как хлориды и сульфаты, придают воде постоянную жёсткость. Для её устранения нужно использовать карбонат натрия – Na2CO3 – соду, которая переводит ионы кальция в осадок. Например, в реакции хлорида кальция с карбонатом натрия образуется нерастворимая соль – карбонат кальция и хлорид натрия. Таким образом, карбонат натрия перевёл растворимую соль кальция – хлорид кальция, в нерастворимую – карбонат кальция.

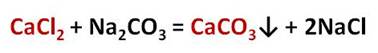
Соду можно использовать и для устранения временной жёсткости.
Качественными реакциями на карбонаты и гидрокарбонаты являются реакции этих солей с кислотами. Например, если в раствор карбоната натрия добавить соляной кислоты, то происходит «вскипание» раствора, из-за образовавшегося углекислого газа. То же самое можно наблюдать при добавлении соляной кислоты к гидрокарбонату натрия.
CO32- + 2H+ = H2O + CO2↑ HCO3- + H+ = H2O + CO2↑
Из солей угольной кислоты наиболее широко применяют кристаллическую соду – Na2CO3 ∙ 10H2O, кальцинированную соду – Na2CO3 – в стекольной, мыловаренной, целлюлозно-бумажной, текстильной, нефтеперерабатывающей и других отраслях промышленности, а в быту её используют как моющее средство.

Сода была известна человеку примерно за полторы – две тысячи лет до нашей эры, а может быть и раньше. Её добывали из содовых озёр и извлекали из месторождений. Первые сведения о получении соды путём упаривания воды озёр относятся к шестьдесят четвертому г н. э. и приведены в сочинениях древнеримского врача и ботаника ДиоскоридаПедания о лекарственных веществах.



Питьевая сода – NaHCO3 – применяется в медицине, хлебопечении, пищевой промышленности, питьевая сода входит в состав наполнителя для огнетушителей.

Карбонат калия, или поташ – K2CO3 – используют для получения мыла, в фотографии, в качестве удобрения, при изготовлении тугоплавкого стекла.

Известняк, или мрамор – CaCO3 – используют в строительстве как облицовочный и строительный материал. Он необходим для получения извести, его вносят в почву для понижения кислотности, мел необходим для побелки, а также в стекольной, резиновой и других областях промышленности.

Дата добавления: 2021-03-18; просмотров: 327; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
