Реальные газы. Уравнение Ван-дер-Ваальса
Поведение таких газов как гелий, водород, азот, кислород хорошо описывается уравнением состояния идеального газа:
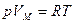
лишь до тех пор, пока суммарный объем молекул пренебрежимо мал по сравнению с объемом сосуда, в котором заключен газ. С ростом давления (при 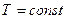 ) оказывается, что
) оказывается, что 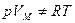 .
.
Причин этому две:
1. собственный размер молекул; он и уменьшает объем, доступный для движения молекул, при нормальных условиях он составляет ~ 0,07% объема сосуда с газом, а при 100 атм. уже 70%,
2. сложный характер взаимодействия между молекулами.
Типичная кривая зависимости энергии взаимодействия 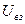 от расстояния
от расстояния 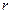 между их центрами приведена на рис. 7.4. На малых расстояниях (
между их центрами приведена на рис. 7.4. На малых расстояниях ( 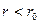 ) молекулы отталкиваются, на больших (
) молекулы отталкиваются, на больших (  ) - притягиваются.
) - притягиваются.
Эти причины можно учесть путем введения поправок в уравнение состояния идеальных газов, что и сделал Ван-дер-Ваальс. В результате уравнение состояния одного моля реального газа приняло вид:
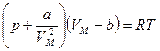 . (7.20)
. (7.20)
Это и есть уравнение Ван-дер-Ваальса.
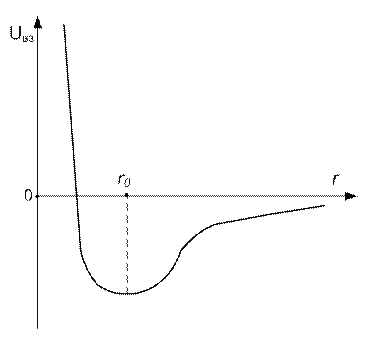
Рис.7.4
Здесь 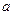 и
и 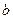 - постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
- постоянные Ван-дер-Ваальса, для разных газов они имеют свои значения.
Если мы имеем дело не с одним, а с 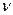 молями газа объемом
молями газа объемом 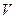 , то в уравнении (7.20) следует сделать замену:
, то в уравнении (7.20) следует сделать замену:
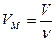 .
.
В результате уравнение для произвольной массы газа будет иметь вид:
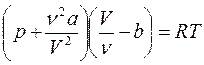 (7.21)
(7.21)
|
|
|
Поправка в первой скобке уравнения (7.20) 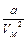 обусловлена силами притяжения между молекулами. Она имеет размерность давления, и ее иногда называют внутренним давлением. На стенку сосуда такой газ оказывает давление
обусловлена силами притяжения между молекулами. Она имеет размерность давления, и ее иногда называют внутренним давлением. На стенку сосуда такой газ оказывает давление 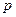 . Однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы
. Однако, если бы силы притяжения между молекулами мгновенно исчезли, то давление на стенку стало бы 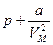 . То есть при переходе от идеального газа к реальному давление на стенку уменьшается из-за сил притяжения между молекулами.
. То есть при переходе от идеального газа к реальному давление на стенку уменьшается из-за сил притяжения между молекулами.
Поправка 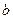 , как легко сообразить, связана с собственным объемом молекул, ее размерность м3/моль.
, как легко сообразить, связана с собственным объемом молекул, ее размерность м3/моль.
Газ, подчиняющийся уравнению (7.20), называют ван-дер-ваальсовским.
Задачи
Задача 1. Найти давление, при котором плотность углекислого газа с температурой 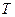 = 300 К окажется равной
= 300 К окажется равной 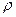 = 500 кг/м3.
= 500 кг/м3.
Решение
Считая газ ван-дер-ваальсовским, подставим в уравнение
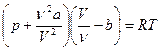
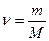 ;
; 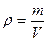 . Получим
. Получим
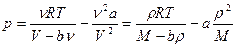
Для углекислого газа
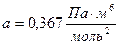 ,
, 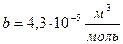 ,
, 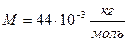 . В результате подстановки найдем
. В результате подстановки найдем  атм. Расчет же по формуле
атм. Расчет же по формуле 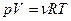 , из которой следует, что
, из которой следует, что 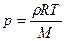 , дает 280 атм. Различие весьма значительное.
, дает 280 атм. Различие весьма значительное.
Задача 2. Средняя квадратичная скорость молекул, некоторого газа при нормальных условиях ( 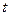 = 00 С,
= 00 С, 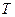 = 273 К,
= 273 К, 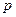 = 1 атм = 105 Па) равна 461 м/с. Какое количество молекул содержится в 1 кг этого газа?
= 1 атм = 105 Па) равна 461 м/с. Какое количество молекул содержится в 1 кг этого газа?
|
|
|
Решение
Согласно (7.17) средняя квадратичная скорость
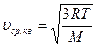 , отсюда
, отсюда 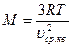
Число молекул
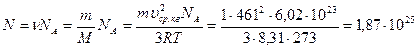 .
.
Задача 3. Чему равна энергия теплового движения 20 г кислорода О2 при температуре 100 С? Какая часть этой энергии приходится на долю поступательного и какая – на долю вращательного движения?
Решение
Средняя энергия теплового движения одной молекулы газа определяется выражением
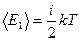 .
.
Учитывая, что  , получим энергию теплового движения
, получим энергию теплового движения 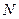 молекул газа
молекул газа
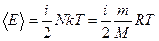 .
.
Для двухатомного газа число степеней свободы 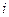 = 5, причем
= 5, причем  .
.
Тогда на долю поступательного движения приходится
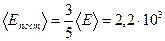 Дж,
Дж,
а на долю вращательного движения
 Дж.
Дж.
Задача 4.Баллон содержит  = 80 г кислорода и
= 80 г кислорода и 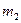 = 320 г аргона. Давление смеси
= 320 г аргона. Давление смеси 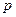 = 1МПа, температура
= 1МПа, температура 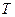 = 300К. Принимая данные газа за идеальные, определить объем
= 300К. Принимая данные газа за идеальные, определить объем 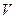 баллона.
баллона.
Решение
По закону Дальтона давление смеси равно сумме парциальных давлений газов, входящих в состав смеси. Парциальным давлением газа называется давление, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
По уравнению Клапейрона - Менделеева парциальные давления кислорода 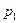 и аргона
и аргона 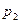 выражаются формулами:
выражаются формулами:
|
|
|
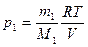 и
и 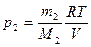 .
.
Следовательно, давление смеси газов
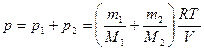 ,
,
отсюда
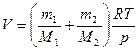 .
.
Подставим численные значения и произведем вычисления:
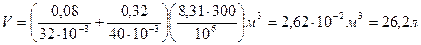
Задача 5. Давление смеси азота и водорода при температуре 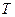 = 320 К и плотности
= 320 К и плотности 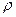 = 0,3 г/л равно
= 0,3 г/л равно 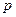 = 2 атм. Найти концентрации молекул азота
= 2 атм. Найти концентрации молекул азота 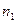 и водорода
и водорода 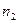 в смеси.
в смеси.
Решение
По закону Дальтона 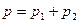 . Так как
. Так как 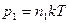 ,
, 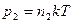 , то
, то
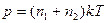 . (1)
. (1)
Масса смеси 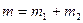 , где
, где
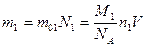 , так как
, так как 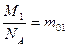 - масса молекулы азота,
- масса молекулы азота,  - число молекул в объеме
- число молекул в объеме 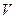 .
.
Аналогично
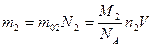 .
.
Учитывая, что 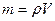 , получим
, получим
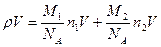
или
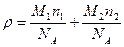 (2)
(2)
Решая систему уравнений (1) и (2) относительно 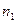 и
и 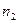 и учитывая, что
и учитывая, что 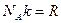 ,
,
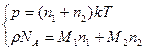 ;
;
получим
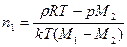 ,
, 
Подставив численные значения физических величин в единицах СИ: 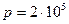 Па,
Па, 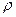 = 0,3 кг/м3,
= 0,3 кг/м3, 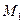 = 0,028 кг/моль,
= 0,028 кг/моль, 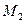 = 0,002 кг/моль,
= 0,002 кг/моль,  = 8,31 Дж/(моль·К),
= 8,31 Дж/(моль·К),
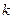 = 1,38·10-23 Дж/К, получим
= 1,38·10-23 Дж/К, получим
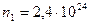 м-1,
м-1, 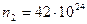 м-1.
м-1.
Задача 6.Уравнение процесса. Найти максимально возможную температуру одного моля идеального газа, совершающего процесс 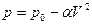 , где
, где 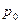 и
и 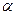 - положительные постоянные.
- положительные постоянные.
Решение
Для этого следует сначала найти зависимость 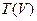 , а затем из условия
, а затем из условия 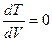 определим
определим 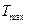 .
.
Итак, учитывая, что 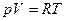 , запишем данный в условии процесс в виде:
, запишем данный в условии процесс в виде:
|
|
|
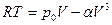 . (1)
. (1)
Дифференцируем это уравнение по 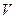 :
:
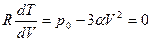 (2)
(2)
Отсюда 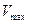 , соответствующая максимуму
, соответствующая максимуму 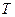 , равно
, равно 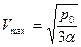 .
.
Подстановка этого выражения в (1) дает:
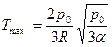 .
.
Тесты
1. В сосуде находится 2 моля гелия. Сколько примерно атомов гелия находится в сосуде?
(1) 6,62∙1034; (2) 6,02∙1023; (3) 2,408∙1024; (4) 12,04∙1023; (5) среди ответов нет правильного.
2. Чему равно число степеней свободы атома аргона?
(1) 1; (2) 2; (3) 3; (4)4; (5) 5.
3. Абсолютная температура определяет:
(1) внутреннюю энергию; (2) запас теплоты; (3) запас работы; (4) количество вещества; (5) концентрацию частиц.
4. Средняя кинетическая энергия поступательного движения молекулы идеального газа равна:
(1) 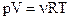 ; (2)
; (2) 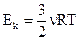 ; (3)
; (3) 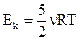 ; (4)
; (4) 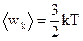 ; (5)
; (5) 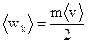 .
.
5. Равновесное состояние термодинамической системы – это состояние, при котором…
(1) все термодинамические параметры системы соответствуют нормальным условиям; (2) все термодинамические параметры системы могут заметно меняться даже при неизменных внешних условиях; (3) все термодинамические параметры системы имеют постоянное значение даже при изменении внешних условий; (4) лишь часть термодинамических параметров системы имеет постоянное значение, не меняющееся при неизменных внешних условиях; (5) все термодинамические параметры системы имеют постоянное значение, не меняющееся при неизменных внешних условиях.
6 Как меняется средняя квадратичная скорость молекул идеального газа с изменением объема газа V в изобарном процессе?
(1) Увеличивается с увеличением V; (2) Уменьшается с увеличением V; (3) Увеличивается при любом изменении V; (4) Остается неизменной при любом изменении V; (5) Уменьшается при любом изменении V.
7. Каков объем 10 молей углекислого газа при нормальных условиях?
(1) 22,4 м3; (2) 22,4 л; (3) 44 м3; (4) 0,224 м3; (5) 440 л.
8. В стальном баллоне находится идеальный газ. Как изменится давление газа, если половину газа выпустить из сосуда, а абсолютную температуру газа уменьшить в 2 раза?
(1) уменьшится в 2 раза; (2) увеличится в 2 раза; (3) не изменится; (4) увеличится в 4 раза; (5) уменьшится в 4 раза.
9. Диаметр атомов в СИ имеет порядок:
(1) 10–3 м; (2) 10–6 м; (3) 10–1 м; (4)10–10 м ; (5) 10–15 м.
10. Какой параметр x идеального газа можно определить по формуле 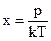 , где p – давление газа; k – постоянная Больцмана; T – абсолютная температура идеального газа.
, где p – давление газа; k – постоянная Больцмана; T – абсолютная температура идеального газа.
(1) объем; (2) давление; (3) температура; (4) концентрация молекул; (5) средняя квадратичная скорость молекул.
11. Выберите правильное утверждение о распределении энергии по степеням свободы.
(1) При одинаковой температуре молекулы всех идеальных газов имеют одинаковую энергию; (2) Молекулы всех газов, обладающие одним и тем же числом степеней свободы, имеют одинаковую энергию; (3) На каждую поступательную и вращательную степени свободы молекулы идеального газа приходится одна и та же энергия, равная kT /2; (4) Энергия молекул зависит от температуры газа и не зависит от числа степеней свободы; (5) На каждую поступательную и вращательную степени свободы молекулы идеального газа приходится одна и та же энергия, равная RT /2.
12. Во сколько раз уменьшилось давление идеального газа при уменьшении средней квадратичной скорости молекул газа в 4 раза?
(1) – давление не изменилось; (2) в 2 раза; (3) в 4 раза; (4) в 8 раз; (5) в 16 раз.
13. Во сколько раз изменилось давление идеального газа в сосуде постоянного объема, если его абсолютная температура уменьшилась в 9 раз?
(1) возросло в 3 раза; (2) уменьшилось в 6 раз; (3) возросло в 9 раз; (4) уменьшилось в 9 раз; (5) давление не изменилось.
14. Какая физическая величина x вычисляется по формуле x = nkT? Здесь n – концентрация молекул, T – абсолютная температура идеального газа.
(1) средняя кинетическая энергия молекул; (2) давление газа; (3) средняя скорость молекул; (4) внутренняя энергия идеального газа(5) абсолютная температура.
15. Основное уравнение молекулярно-кинетической теории имеет вид:
(1) 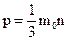 ; (2)
; (2) 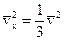 ;(3)
;(3) 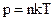 ; (4)
; (4) 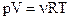 ; (5)
; (5) 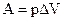 .
.
16. Уравнение Ван-дер-Ваальса описывает состояние:
(1) замкнутой системы (уравнение состояния); (2) изменение энергии замкнутой системы; (3) изменение импульса замкнутой системы; (4) идеального газа; (5) реального газа.
17. В сосуде смесь газов: 1 моль 4He и 1 моль неона 20Ne. Одинаковое ли парциальное давление оказывает каждый из газов на стенки сосуда?
(1) парциальные давления гелия и неона одинаковы; (2) давление гелия больше; (3) давление неона больше; (4) нет возможности вычислить парциальное давление отдельного газа.
18. По международному соглашению массы всех атомов и молекул сравнивают:
(1) с 1/12 массы атома водорода; (2) с 1/12 массы атома кислорода; (3) с 1/12 массы атома углерода; (4) с 1/24 массы атома хлора; (5) с 1/92 атома урана.
19. В идеальном газе…
(1) молекулы на расстоянии не взаимодействуют, их столкновения носят характер упругого удара; (2) молекулы на расстоянии притягиваются, их собственный объём пренебрежимо мал по сравнению с объёмом, в котором газ находится; (3) молекулы на расстоянии отталкиваются, их столкновения носят характер упругого удара; (4) столкновения молекул носят характер неупругого удара; (5) собственным объёмом молекул газа нельзя пренебречь по сравнению с объёмом, в котором газ находится.
20. Учёт какого физического фактора приводит к появлению члена 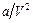 в уравнении Ван-дер-Ваальса
в уравнении Ван-дер-Ваальса 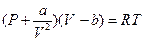 ?
?
(1) Отталкивания молекул на близких расстояниях; (2) Притяжения молекул на больших расстояниях; (3) Неупругого столкновения молекул; (4) Объёмом молекул нельзя пренебрегать по сравнению с объёмом газа; (5) Хаотического движения молекул
Дата добавления: 2021-03-18; просмотров: 753; Мы поможем в написании вашей работы! |

Мы поможем в написании ваших работ!
